ANGPTL 3和ECE-1在食管癌患者中的表达及临床意义
2019-07-06刘仲阳袁欣
刘仲阳,袁欣
(保定市第二中心医院 胸外科,河北 保定 072750)
食管癌(esophageal carcinoma,EC)是最常见的消化系统恶性肿瘤之一,据统计,2012年全球EC 的新发病例约45.6 万,死亡病例约40.0 万[1]。我国EC的发病率居世界首位,每年约有25.9 万新发病例,21.1 万死亡病例[2]。近年来,EC 的诊断和治疗取得了较大进展,然而EC 患者的预后仍不乐观,其5年生存率仅25%左右[3]。侵袭和转移是导致EC 患者不良预后的主要原因[4],而新生血管形成在EC 侵袭转移过程中发挥重要作用。血管生成素样蛋白(angiopoietinlike protein,ANGPTL)是一类分泌型糖蛋白,其结构类似于血管生成素,而功能与血管内皮生长因子相似,ANGPTL 3 可诱导新生血管形成[5],进而促进肿瘤生长和侵袭。目前关于ANGPTL 3 的研究尚处于初始阶段,且ANGPTL 3 在EC 发生、发展过程中的作用所知甚少。内皮素(Endothelin,ET)系统高度活化与肿瘤新生血管形成密切相关[6],内皮素转化酶(endothelinconverting enzyme,ECE)可裂解前体ET,进而激活ET 系统。有研究证实,内皮素转化酶-1(endothelinconverting enzyme-1,ECE-1)可诱导前列腺癌细胞发生侵袭[7]。本研究旨在检测ANGPTL 3、ECE-1 在EC组织中的表达情况,分析其表达对EC 患者病情预测及预后判断的应用价值。
1 资料与方法
1.1 临床资料
选取2011年1月—2013年1月保定市第二中心医院行切除手术的EC 患者的癌组织及其癌旁正常组织的石蜡标本。纳入标准:①具备完整的病历资料;②术前未接受放化疗;③术后经病理诊断证实为EC;④均签署知情同意书。排除标准:①严重肝肾功能不全;②合并全身性感染;③合并其他恶性肿瘤等。共选取95 例EC 患者。其中,男性49 例,女性46 例;年龄<60 岁患者65 例,≥60 岁患者30 例;中高分化程度 72 例,低分化程度23 例;肿瘤直径<5 cm 58 例,肿瘤直径≥5 cm 37 例;有淋巴结转移52 例,无淋巴结转移43 例;有远处转移34 例,无远处转移61 例;TNM分期,Ⅰ、Ⅱ期75 例,Ⅲ、Ⅳ期20 例。研究经本院医学伦理委员会审核通过。
1.2 免疫组织化学法检测ANGPTL 3、ECE-1 的表达
取EC 组织和癌旁正常组织的石蜡标本,常规二甲苯脱蜡、浸泡水化(依次为100%、95%、80%和70%酒精)后,蒸馏水清洗3 次,每次3 min;滴加3% H2O2,孵育10 min,灭活内源性过氧化物酶,磷酸盐缓冲液(PBS)洗涤3 次,每次3 min;枸橼酸钠溶液(10 mmol/L,pH 6.0),加热至100℃,持续10 min,逐渐冷却至室温,进行抗原修复,PBS 洗涤3 次,每次3 min;滴加羊血清工作液,37℃封闭10 min,弃去血清;分别滴加ANGPTL 3、ECE-1 一抗工作液,4℃孵育过夜,PBS 洗涤3 次,每次3 min;滴加生物素二抗,室温孵育30 min,PBS 洗涤3 次,每次3 min;滴加新鲜配制的DAB 溶液,进行显色反应,蒸馏水清洗3 次,每次3 min;苏木精-伊红染色法复染,梯度酒精脱水干燥,二甲苯透明,中性树胶封片。结果判定:ANGPTL 3、ECE-1 主要定位于细胞质。光学显微镜下,随机选取10 个高倍视野,每个视野计数100 个肿瘤细胞。阳性细胞百分比:<5%为0 分;6%~25%为1 分;26 %~50% 为2 分;51%~75% 为3 分;>75%为4 分。着色强度:黄色为1 分;棕黄色为2 分;棕褐色为3 分。根据阳性细胞百分比评分与着色强度评分的乘积进行结果判定,5~12 分为阳性表达,0~4 分为阴性表达。
1.3 术后随访
以患者术后为起点,通过电话、门诊等方式对患者及其家属进行随访,随访时间为手术后1~60 个月,直至患者死亡或者随访时间结束。
1.4 统计学方法
数据分析采用SPSS 19.0 统计软件。计数资料以例或率(%)表示,两样本间阳性率的比较分别采用χ2检验,两蛋白表达水平间的相关性采用Pearson 相关分析,EC 患者预后的影响分析采用Kaplan Meier 法、Log-rank χ2检验及Cox 比例风险回归模型,对各组生存率曲线分布进行分析,P<0.05 为差异有统计学 意义。
2 结果
2.1 ANGPTL 3、ECE-1 在不同食管组织中的表达情况
EC组织中ANGPTL 3的阳性表达率与癌旁正常组织比较,差异有统计学意义(χ2=73.889,P=0.000),EC 组织[63.16%(60/95)]高于癌旁正常组织[4.21%(4/95)];EC 组织中ECE-1 的阳性表达率与癌旁正常组织比较,差异有统计学意义(χ2=66.193,P=0.000);EC 组织[53.68%(51/95)]高于癌旁正常组织[1.05%(1/95)]。见图1、2。
2.2 EC 组织中ANGPTL 3、ECE-1 表达与患者临床病例特征的关系
EC 组织中,ANGPTL 3 表达与患者年龄、性别、肿瘤分化程度、淋巴结转移、远处转移及TNM 分期均无关(P>0.05),而与肿瘤直径相关(P<0.05)。ANGPTL 3 在肿瘤直径≥5cm 的EC 组织中的阳性表达率为78.38%(29/37),高于在肿瘤直径<5 cm 的EC组织中的阳性表达率[53.45%(31/58)](P<0.05);ECE-1 表达与患者年龄、性别、肿瘤分化程度、肿瘤直径、淋巴结转移及TNM 分期均无关(P>0.05),而与远处转移相关(P<0.05)。ECE-1 在有远处转移的EC 组织中的阳性表达率为76.47%(26/34),高于无远处转移的EC 癌组织中的阳性表达率[40.98%(25/61)](P<0.05)。见表1。
2.3 EC 组织中ANGPTL 3 与ECE-1 表达的相关性
Pearson 相关分析结果显示,在EC 组织中,ANGPTL 3与ECE-1表达呈正相关(r=0.610,P=0.000)(见表2)。相关散点数据见图3。
2.4 EC 组织中ANGPTL 3、ECE-1 表达对患者预后的影响
根据EC 组织中ANGPTL 3表达情况,将EC患者分为ANGPTL 3阳性表达组和ANGPTL 3 阴性表达组,ANGPTL 3 阳性表达组术后5年总生存率与ANGPTL 3 阴性表达组比较,差异有统计学意义(χ2=29.760,P=0.000),ANGPTL 3 阳性表达组[25.00%(15/60)]低于ANGPTL 3阴性表达组[82.86%(29/35)]。Log-rank χ2检验结果显示,ANGPTL 3 阳性表达组的平均生存时间与ANGPTL 3阴性表达组比较,差异有统计学意义(χ2=26.979,P=0.000),ANGPTL 3 阳性表达组[(40.35±2.43)个月]低于ANGPTL 3 阴性表达组[(56.17±1.59)个月](见图4A)。
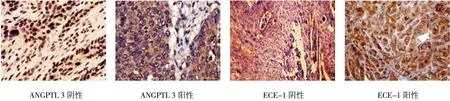
图1 EC 组织中ANGPTL 3、ECE-1 的表达情况 (苏木精-伊红 ×200)
根据EC 癌组织中ECE-1 表达情况,将EC 患者分为ECE-1 阳性表达组和ECE-1 阴性表达组,ECE-1 阳性表达组的术后5年总生存率与ECE-1 阴性表达组比较,差异有统计学意义(χ2=7.464,P=0.006),ECE-1 阳性表达组[33.33%(17/51)]低于 ECE-1 阴性表达组[61.36%(27/44)]。Log-rank χ2检验结果显示,ECE-1 阳性表达组的平均生存时间与ECE-1 阴性表达组比较,差异有统计学意义(χ2=9.788,P=0.002),ECE-1 阳性表达组[(40.43±2.67)个月]低于ECE-1 阴性表达组[(52.84±2.00)个月](见图4B)。

表1 患者临床病例特征与EC 组织中ANGPTL 3、ECE-1 表达的关系 例

表2 EC 组织中ANGPTL 3、ECE-1 表达的相关性 例
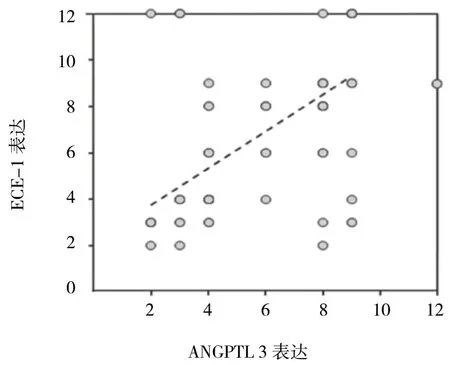
图3 EC 组织中ANGPTL 3、ECE-1 表达相关性散点图
2.5 EC 生存预后的影响因素分析
以本研究95 例患者资料为样本,以EC 生存预后状态为应变量(赋值:1=死亡,0=生存,t=生存期),建立Cox 比例风险模型。自变量为EC 组织中ANGPTL 3、ECE-1 表达。此外,加上单因素分析中 α入=0.10 的指标,如肿瘤分化程度、远处转移、肿瘤直径及TNM 分期等指标/因素,回归过程采用后退法,自变量退出α出=0.05。回归结果:远处转移及ANGPTL3、ECE-1 表达均被保留入回归模型(P<0.05),相对危险度为1.6~2.3,提示远处转移,ANGPTL 3、ECE-1 表达阳性是影响EC 生存预后的危险因素。见表3。

图4 EC 组织中ANGPTL 3、ECE-1 表达对患者预后的影响

表3 EC 生存预后的影响因素Cox 分析结果
3 讨论
目前发现的ANGPTL 家族蛋白共有8 种,分别命名为ANGPTL 1~8,且不同ANGPTL 蛋白在功能上表现出多样性,如ANGPTL 1 在炎症、脂肪代谢中发挥作用,而ANGPTL 3 参与调节胰岛素抵抗、脂肪代谢等[8]。ANGPTL 3 基因定位于染色体1p31,编码由460 个氨基酸组成的分子量约为70 kD 的分泌型蛋白,ANGPTL 3 在肝脏组织中特异性表达,而在其他组织中的表达量极少[9-10]。目前,关于ANGPTL 3与肿瘤的关系的研究较少,KOYAMA 等[11]在口腔癌中的研究发现,ANGPTL 3 呈高表达状态,且与肿瘤大小呈正相关。而本研究中,与癌旁正常组织比较,ANGPTL 3 在EC 癌组织中的表达增加,且肿瘤直径越大,ANGPTL 3 阳性率越高,提示ANGPTL 3 可能参与了EC 肿瘤形成。同时ANGPTL 3 高表达可促进肿瘤生长,新生血管形成是实体肿瘤生长必备条件,推测ANGPTL 3 可能通过诱导新生血管形成,进而促进肿瘤生长。CAMENISCH 等[5]证实ANGPTL 3 与整合素αvβ3 受体结合,可刺激血管生成,进而诱导内皮细胞的黏附和迁移。近年来,关于ANGPTL 3 促进新生血管形成的机制研究并未取得突破性进展,本研究将在后续工作中对其内在机制进行深入探究。
ET-1 是一种内源性生物多肽,具有强大的收缩血管作用,在调节微循环灌流及血管张力方面发挥非常重要的作用,ECE-1 可裂解前体ET-1,生成成熟的ET-1,进而参与机体的生理病理过程[12-13]。大量研究证实,ECE-1 在子宫内膜癌[14]、前列腺癌[15]、肺癌等[16]多种肿瘤细胞中表达增加,而关于ECE-1 在肿瘤细胞中所发挥的功能及其高表达的临床意义的报道较少,如SMOLLICH 等[17]发现,在乳腺癌患者中,ECE-1 高表达与高复发率密切相关。本研究结果显示,ECE-1在EC 组织中具有较高的阳性表达率,且ECE-1 高表达与肿瘤发生远处转移相关,提示ECE-1 在EC 发生和恶性进展(远处转移)中发挥促进作用。体外细胞水平的研究结果表明,ECE-1 能够促进口腔鳞癌细胞增殖[18]、增强前列腺癌细胞[19]和卵巢癌细胞[20]的侵袭能力,以上研究结论与本研究的临床病例研究结果,共同证实ECE-1 参与并促进肿瘤发生侵袭转移,本研究推测ECE-1 可能通过激活ET 系统,参与调节肿瘤新生血管形成过程,进而为肿瘤发生侵袭转移提供条件,其内在机制将在后续工作中进行深入探索。
以上结果提示,ANGPTL 3 和ECE-1 可能在新生血管形成过程中均发挥促进作用,本研究进一步地分析ANGPTL 3 与ECE-1 表达之间的相关性,Pearson相关分析结果显示,在EC 癌组织中ANGPTL 3 与ECE-1 表达之间呈正 相 关,提示ANGPTL 3 与ECE-1 在EC 肿瘤形成、肿瘤生长及恶性进展过程中可能发挥协同作用,共同诱导肿瘤新生血管形成。而Kaplan Meier 法的分析结果显示,ANGPTL 3 阳性表达及ECE-1 阳性表达,均可能预示着患者较低的术后总生存率和较短的平均生存时间,提示ANGPTL 3 和ECE-1 高表达与EC 患者不良预后密切相关。此外,Cox 回归分析也证实:ANGPTL 3 阳性表达及ECE-1阳性表达,均是EC 患者生存预后的危险因素。当然,由于本研究中的样本数量有限,为得到更确切的结论,后期将继续扩大样本量进行统计分析。
综上所述,本研究发现在EC 组织中,ANGPTL 3和ECE-1 均具有较高的阳性表达率,均与患者较差的病理特征、不良预后相关,且ANGPTL 3 与ECE-1表达之间呈正相关,提示ANGPTL 3 和ECE-1 可能在EC 发生、发展过程中发挥协同作用,且均具有作为EC 患者病情评估、预后判断及治疗靶点的潜能。
