EOF新辅助化疗联合腹腔镜下D2根治术对局部进展期胃癌的疗效分析
2019-07-06岳大成胡仕祥王世东
岳大成,胡仕祥,王世东
[河南省中医院(河南中医药大学第二附属医院) 1.普外一区,2.急诊科,河南 郑州 450002]
胃癌作为最常见的肿瘤之一,具有高发病率和高病死率的特点[1]。然而大部分患者发现时已经是中晚期,错过根治性手术机会[2]。新辅助化疗作为胃癌综合治疗中的重要部分,提高根治性手术机会,改善患者预后。血清可溶性E 黏钙蛋白(soluble E-cadherin,sE-cad)是E 黏钙蛋白(E-cadherin,E-cad)的降解产物,可反映患者体内E-cad 的水平及肿瘤细胞的侵袭程度[3]。肿瘤坏死因子受体相关因子-6(tumor necrosis receptor-associated factor 6,TRAF-6)是恶性肿瘤常见的高表达蛋白之一,与患者的临床病理分期,肿瘤细胞的侵袭转移有关[4]。本研究探讨表柔比星(epirubicin)+奥沙利铂(oxaliplatin)+氟尿嘧啶(5-FU)(EOF)新辅助化疗方案联合腹腔镜下D2 根治术治疗局部进展期胃癌的临床疗效,现报道如下。
1 资料与方法
1.1 一般资料
采用前瞻性队列研究设计,选取2011年8月—2012年11月河南省中医院收治的Ⅱ、Ⅲ期胃癌患者120 例为研究对象。其中,男性78 例,女性42 例;年龄23~68 岁,平均49 岁。以随机数字表法将患者分为观察组和对照组,各60 例。纳入标准:①所有患者符合UICC 第六版胃癌TNM 分期的局部进展期胃癌的诊断标准[5];②年龄18~65 岁;③经本院2 位外科医生独立评估认为是潜在可根治性切除患者;④具有可评价病灶;⑤既往无化疗史,能耐受化疗药物。排除标准:①严重的肝肾功能不全,或心功能不全的患者;②严重感染的患者;③无法控制的内科疾病患者;④既往有其他肿瘤病史的患者;⑤腹腔种植或证实远处转移患者;⑥临床资料不全的患者。本研究已通过医院医学伦理委员会的批准,所有患者均签署手术或化疗知情同意书。
1.2 治疗方案及疗效评估
观察组采用EOF 新辅助化疗+腹腔镜下D2 根治术。EOF 方案如下:第1 天:表柔比星50 mg/m2,奥沙利铂130 mg/m2,静脉滴注2 h;第2 天:氟尿嘧啶2 400 mg/m2,静脉滴注48 h。每21 天为1 个周期,共行4 个周期化疗。第2 周期结束2 周后复查超声胃镜及腹部增强CT 进行评估,如出现肿瘤明显增大、浸润、远处转移、肿瘤标志物升高等情况,则转为手术治疗。若排除肿瘤进展,则继续行EOF 方案化疗2 个周期。完成4 个EOF 化疗周期,再间隔约1 个月后行手术治疗。
对照组根据外科医生评估,在排除患者手术禁忌证后,行腹腔镜下D2 根治术。腹腔镜下D2 根治术组手术均由同一组医生进行。患者平卧两腿分开,采用气管插管下的全身麻醉手术。严格按照《腹腔镜胃癌手术操作指南(2007)》及《日本胃癌处理规约(第14 版)》进行操作,在腹腔镜下游离组织,根据肿瘤部位选择胃切除范围,达到R0 切除标准、清扫所属范围淋巴结,重建消化道。远端胃切除后采用残胃与空肠Roux-en-Y 吻合;全胃切除后采用食管空肠Roux-en-Y吻合。将脐部切口扩大至3 cm,切除的标本放入组织袋中取出。所有患者术后均禁食、胃肠减压及抗生素对症支持治疗。
两组患者在术后均采用XELOX 辅助化疗方案治疗4 周期:第1 天:奥沙利铂130 mg/m2,静脉滴注3 h;第1~14 天:卡培他滨1 000 mg/m2,口服,2 次/d,休息7 d;每3 周为1 周期。
1.3 观察指标
①两组患者在辅助化疗结束后,根据实体瘤评价标准(RECIST 1.1)[6]评估近期生存情况,治疗效果分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD)。临床总有效率=(CR 例数+PR 例数)/总例数×100%。肿瘤控制率=(CR 例数+PR 例数+SD 例数)/总例数×100%。②化疗期间密切观察患者是否有不良反应的出现并记录,依据常见不良反应事件评价标准4.0[7]进行判定。③随访及患者生存时间等近、远期生存情况;④两组患者血清sE-cad 及TRAF-6 表达水平检测:收集患者治疗前以及XELOX 化疗后空腹静脉血10 ml,4℃ 3 000 r/min 离心15 min 后留取上清液,采用ELISA 检测血清中sE-cad 及TRAF-6 水平,所有操作均严格按照说明书步骤进行。
1.4 随访
随访时间截止至2017年12月。辅助化疗结束后,前2年每6 个月门诊随访,进行肿瘤评估。2年后每半年进行1 次电话生存随访。
1.5 统计学方法
数据分析采用SPSS 17.0 统计软件,计量资料以均数±标准差(±s)表示,两组比较采用t检验;计数资料采用频数和率(%)表示,比较采用χ2检验或秩和检验;采用Kaplan-Meier 法绘制生存曲线,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较
120 例患者中,完成5年随访108 例,随访完成率为90.0%。其中观察组55 例,对照组53 例。失访12 例患者中,8 例搬离本市无法联系,4 例更换联系方式。两组患者一般资料见表1,两组患者在性别、年龄、BMI、肿瘤部位及直径、肿瘤病理学分型、肿瘤国际抗癌联盟(international union against cancer,UICC)分期等的比较,差异无统计学意义(P>0.05)。
2.2 两组患者近期疗效比较
观察组临床总有效率为30.0%,肿瘤控制率为78.3%,高于对照组的15.0%和60.0%,差异有统计学意义(P<0.05)。见表2。
2.3 两组患者不良反应比较
两组间不良反应的发生率差异无统计学意义(P>0.05)。见表3。
2.4 两组患者治疗前后血清sE-cad 及TRAF-6水平比较
治疗后,两组患者血清sE-cad 及TRAF-6 水平均较治疗前下降,且观察组低于对照组,差异有统计学意义(P<0.05)。见表4。
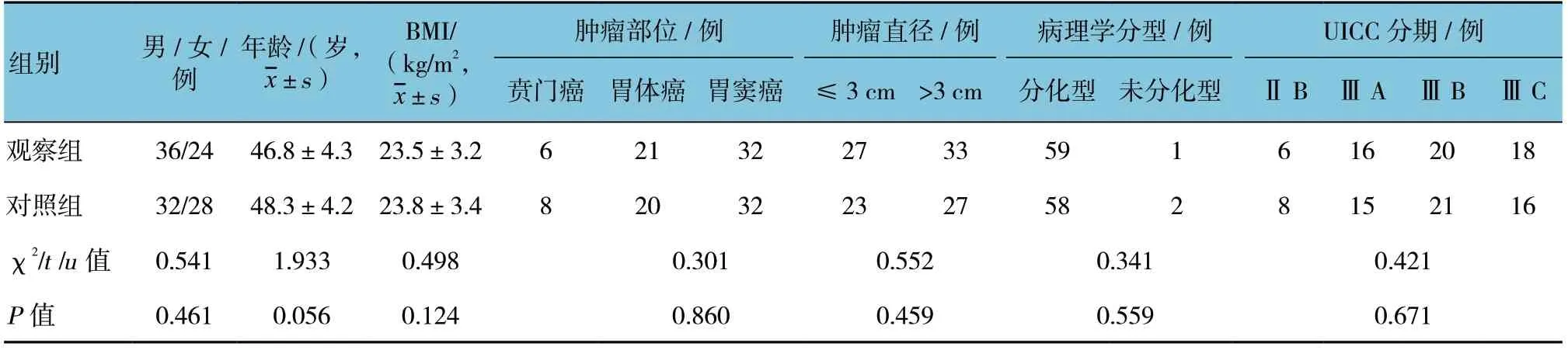
表1 两组患者术前一般临床资料比较 (n=60)

表2 两组患者治疗后近期疗效比较 (n=60)
2.5 随访及预后情况比较
120 例患者中最短随访58 d,最长1 780 d,中位生存时间682 d。截止2017年12月,观察组5 例失访,32 例死亡,23 例生存。对照组7 例失访,39 例死亡,14 例生存,生存曲线见图1,两组比较差异有统计学意义(χ2=4.532,P=0.039)。
表4 两组患者治疗前后血清sE-cad 及TRAF-6 水平比较 (n=60,±s)

表4 两组患者治疗前后血清sE-cad 及TRAF-6 水平比较 (n=60,±s)
组别sE-cad/(mg/ml)t 值 P 值TRAF-6/(ng/ml)t 值 P 值治疗前 治疗后 治疗前 治疗后观察组 2.637±0.729 1.541±0.360 10.442 0.000 1.723±0.841 1.048±0.523 7.358 0.000对照组 2.672±0.698 1.948±0.521 6.439 0.000 1.747±0.812 1.433±0.561 2.464 0.015 t 值 0.269 4.978 0.197 3.888 P 值 0.789 0.001 0.884 0.000
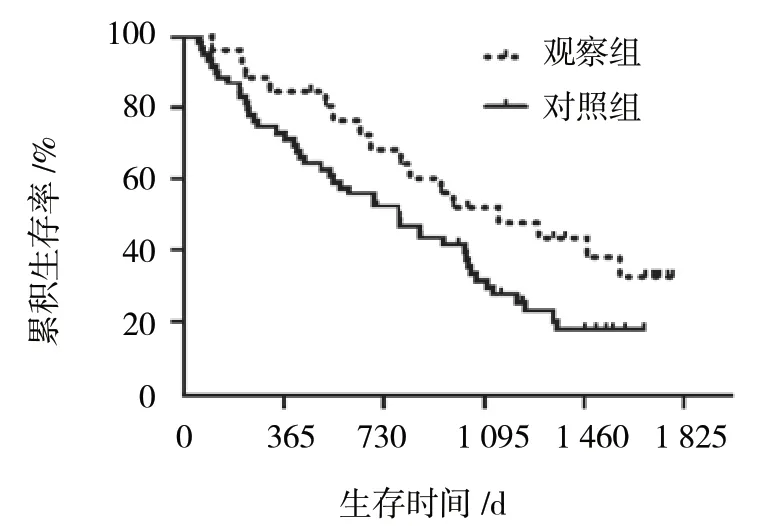
图1 两组患者生存曲线比较
3 讨论
新辅助化疗作为胃癌综合治疗中的一部分,已经得到了越来越多的关注[8]。两项大样本随机对照临床试验MAGIC 和FNCLCC/FFCD 研究结果均显示:新辅助化疗联合手术治疗能提高患者的总体生存率和无进展生存时间;MAGIC 研究研究还表明新辅助化疗还能降低肿瘤分期,提高R0 手术切除率,同时新辅助化疗联合手术治疗组的手术相关并发症并未增加[9]。此外,国内外荟萃分析研究均证实新辅助化疗在胃癌综合治疗中的价值,一项来自美国的回顾性研究也证实近年来新辅助化疗应用于胃癌治疗例数不断增加[10]。目前胃癌的新辅助化疗方案多以含铂类药物和氟尿嘧啶为基础,其中ECF 方案为目前最常用方案。但ECF 方案常引起较严重的肾功能不全、骨髓抑制等不良反应,常导致患者依从性变差。CUNNINGHAM 等研究则证实,奥沙利铂取代顺铂的EOF 方案较ECF 方案在治疗胃癌方面具有非劣效性[11]。笔者的研究表明,EOF化疗联合手术治疗组较单纯手术组生存时间延长。BUJKO 等[12]研究也表明,以奥沙利铂为基础的治疗方案在PFS 及OS 方面要优于顺铂,提示EOF 化疗方案在进展期胃癌的治疗中具有重要作用。
E-cad 是一种广泛分布于各种上皮细胞中钙离子依赖性跨膜糖蛋白,通过连环素与细胞骨架相连,可介导细胞间以及细胞与细胞外基质间的黏附反应,维持细胞间的极性[13]。研究表明,E-cad 蛋白表达量降低甚至不表达能够增加肿瘤细胞的侵袭性,促使肿瘤细胞生长并从原发灶脱离转移,是肿瘤细胞播散转移的特征之一。同时,E-cad 还能调节细胞周期,通过调节细胞周期蛋白D1、E 的密度而使细胞停滞于G0/G1期从而出现无限增殖的情况。sE-cad 则是E-cad 降解后的产物,由于肿瘤组织中组织蛋白酶活性增高,细胞表面的E-cad 被降解后进入血液循环,使得患者sE-cad增高。因此检测sE-cad可反应体内E-cad水平。TRAF-6 是肿瘤坏死因子超家族受体和Toll 样受体的重要配体蛋白之一,在多种恶性肿瘤患者体内均高表达,并可参与细胞增殖、转移、侵袭等多种生理功能。研究表明,TRAF-6 可通过调节UPP 和ALP 途径调节蛋白质降解,增加骨骼肌蛋白的消耗,从而引发或者加重恶病质[14]。笔者的研究结果也显示,治疗后两组sE-cad 及TRAF-6 水平均较治疗前下降,且观察组低于对照组,提示EOF 化疗能够降低sE-cad 及TRAF-6水平,从而降低肿瘤的侵袭性。张自森等[15]研究显示,血清sE-cad 表达水平与化疗疗效密切相关,42 例胃癌患者在FOLFOX4 方案化疗后血清sE-cad 下降;章国良等[16]研究显示,TRAF-6 表达水平与胃癌的TNM分期、淋巴结转移及病理分期有关;HAN 等[17]研究表明,TRAF-6 在胃癌患者中的表达量增加,并可通过调节p-Akt、Bcl-2、Bax 和MMP-9 等因子水平增加肿瘤细胞的侵袭力,提示EOF 化疗方案能够通过减少E-cad 的降解和下调TRAF-6 水平,减少肿瘤细胞增殖、侵袭及转移的能力,从而改善患者预后。
综上所述,EOF 化疗+全腹腔镜下D2 根治术较单纯的全腹腔镜下D2 根治术能有效改善患者近期与远期预后,耐受性好,并且能够有效降低sE-cad 及TRAF-6 水平,减少肿瘤侵袭。
