经自然腔道取标本手术与传统腹腔镜直肠癌手术的临床对比研究
2019-07-05付菁屿谢贻祥王传思王永森黄鸿武
付菁屿,谢贻祥,王传思,王永森,张 琦,黄鸿武
(1.安徽医科大学附属六安医院,安徽 六安,237005;2.安徽中医药大学第一附属医院)
直肠癌是我国最常见的恶性肿瘤之一,其发病率在世界范围内居男性第3位、女性第2位[1]。美国国家癌症中心数据表明,结直肠肿瘤患者人群中,60%~70%肿瘤分期为早期或中期,可行腹腔镜辅助手术治疗。相较传统开腹手术,腹腔镜手术具有明显优势,一方面具有更好的微创效果;另一方面,大量的循证医学证据表明,两者术后疗效无明显差异[2-3]。在微创外科手术发展的大背景下,外科医生开始追求在保证手术治疗效果的前提下,进一步减少机体损伤,更完整地保留患者组织机能,从而促进患者快速康复的手术效果。经自然腔道内镜手术即是顺应普通外科这一发展大趋势所诞生的,是普通外科手术发展的新方向[4]。经自然腔道内镜手术的定义是以自然腔道(气管、胃、结肠、阴道等)作为手术通路,无需经过传统人体表面皮肤做切口,自此概念提出之日即引起医学界的普遍关注[5]。通过此手术入路,能达到腹部无疤痕,最大程度地减轻患者术后痛苦,缩短术后康复时间。与传统腹腔镜手术相比,经自然腔道内镜手术以其独特的消化道重建方式与手术技巧,在保证肿瘤彻底切除的基础上,更好地保留机体与器官的基本功能,实现更好的微创效果。目前国内开展的腹腔镜直肠癌经自然腔道取标本手术(natural orifice specimen extraction surgery,NOSES),是使用腹腔镜器械、TEM或软质内镜等设备完成腹腔内手术操作,经自然腔道(肛门或阴道)取标本,从而达到腹壁无辅助切口的目的[6]。
1 资料与方法
1.1 临床资料 选取2013年2月至2018年11月安徽医科大学附属六安医院普通外科施行腹腔镜直肠癌手术的56例患者,平均(61.46±10.07)岁。体质指数平均(24.05±3.04)kg/m2,其中30例行腹腔镜NOSES(观察组),根据肿瘤所在位置、肿瘤直径分为3类,肿瘤位于中低位、直径3~5 cm者,经阴道拉出切除,共11例;肿瘤位于中低位、直径<3 cm者,经肛门拖出切除,共6例;肿瘤位于中位、直径<3 cm者,经直肠拉出切除,共13例。26例行传统腹腔镜手术(对照组)。本研究经医院伦理委员会批准,患者均签署知情同意书知情同意。
1.2 腹腔镜NOSES病例筛选 纳入标准:(1)术前病理报告确诊为直肠癌;(2)肿瘤下缘距齿状线4~10 cm;(3)肿瘤横径≤5 cm,肿瘤≤2/3肠周;(4)术前均行盆腔MRI,TMN分期为T1~2N0M0;(5)患者有保肛意愿。排除标准:(1)合并急性肠梗阻;(2)分期为T3N+M0及以上;(3)具有腹腔镜手术禁忌证。
1.3 手术步骤 (1)解剖与分离:气管插管全麻,患者取改良截石位,分别于中、下腹部穿刺Trocar,4孔法施术。手术遵循直肠全系膜切除原则,选择中间入路,Hem-o-lok闭合肠系膜下动静脉根部并离断,清扫周围淋巴脂肪组织,游离乙状结肠、直肠系膜后,沿Toldt间隙向外侧拓展游离结肠系膜,超声刀自上而下由中间向两边沿直肠后间隙游离系膜,分离并切断Hiatal韧带至肛提肌裂孔,切断双侧直肠侧韧带,沿邓氏筋膜游离直肠前壁,达内外括约肌间。(2)肿瘤标本的切除:①经直肠拖出:经肛于肿瘤下方置入一碘伏纱布,于肿瘤下方约2 cm处横行切开肠管,经肛将一无菌保护膜置入腹腔,将游离直肠及直肠断端置入套内,卵圆钳夹闭直肠断端经肛拉出,切断直肠移除标本(图1),将抵钉座置入乙状结肠断端后送回腹腔,直线切割闭合器闭合直肠残端,于肛门处置入吻合器,与近端乙状结肠钉砧端端对接,完成吻合。②经肛门拖出:分别裸化肿瘤上下预切位置2~3 cm,并于肿瘤下缘预切处环周切开肠壁,保护膜经肛门放入,用卵圆钳夹持近端直肠残端,经直肠完整拉出肛门外(图2),于肿瘤上方预切断处切除肿瘤所在段直肠,经肛将荷包缝合于近端乙状结肠的吻合器抵钉座送入腹腔。腹腔镜下用直线切割闭合器闭合远端直肠残端,吻合器体部置入肛内,乙状结肠直肠完成端端吻合。③经阴道拉出切除:近端乙状结肠系膜游离并裁剪至能拉出阴道外的足够长度,分别裸化肿瘤上下预切位置2~3 cm,以直线切割吻合器于预切处切断闭合肿瘤下缘约3 cm预切线处直肠,会阴组行阴道消毒后,通过阴道内诊指示以确认阴道后穹隆切口位置,用超声刀切开3~5 cm,放置切口保护套,通过阴道用卵圆钳完整拉出直肠残端(图3)。将肿瘤所在段直肠于肿瘤上预切线处切除足够长度,经阴道将荷包缝合于近端乙状结肠的吻合器抵钉座送入腹腔备吻合用,吻合器体部置入肛内,镜下直肠乙状结肠完成端端吻合。阴道后穹隆用可吸收线缝合。
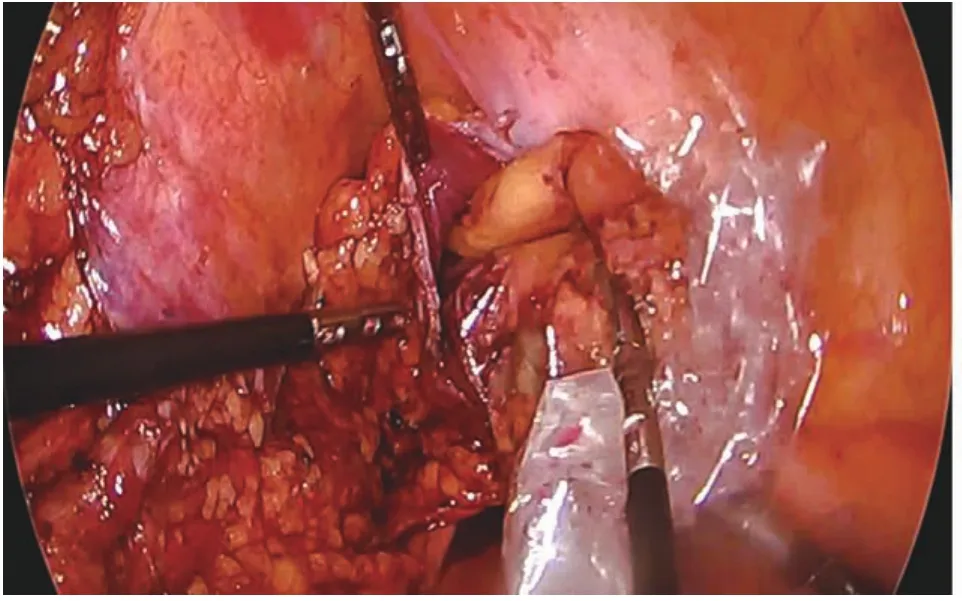
图1 将游离直肠及直肠断端经肛门拉出
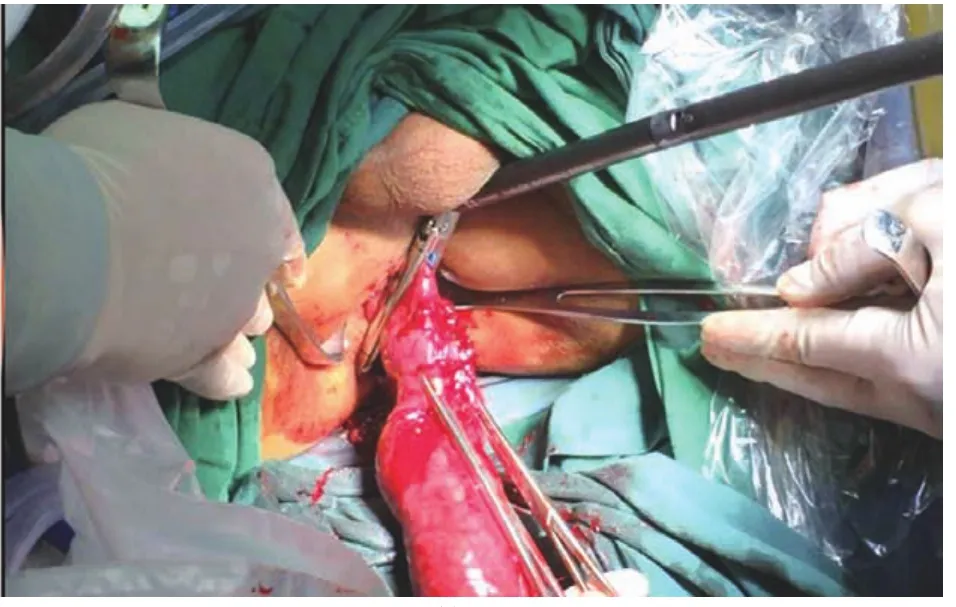
图2 将直肠经肛门拖出体外
1.4 观察指标 (1)临床指标:采用匹茨堡睡眠质量指数量表[7]、视觉模拟评分法[8]、正性负性情绪量表[9],睡眠质量评分满分为0~21分,每5分为1等级,共分为4个等级,得分越高者代表睡眠状态越差;情绪量表为5级评分法,共20个条目,依次计分为 1、2、3、4、5,量表中每一个维度的总分为50分。负性情绪评分得分越低者代表情绪状况越好。依据此标准,严格按照问卷设计的原则与方法,设计调查问卷。为确保研究资料的科学性、真实性、严谨性,要求被调查对象每人独立完成,且只能填一份。请被调查者认真阅读,并对相关细节作出必要的解释,使其能理解问卷中的每一个项目并掌握正确的填写方法。通过此方法,调查两组患者术后第1天疼痛评分、负性情绪评分、睡眠质量评分。同时统计两组住院时间、术中出血量、术后进食流质饮食时间、淋巴结清扫数量、术后并发症。(2)实验数据:分别于术前1 d及术后第1天、第3天、第5天抽取3 mL患者外周静脉血,于离心机中以3 000 r/min的速度离心10 min,留存血清样本,于-80℃冰箱中保存等待检测。以ELISA方法测试患者血清中IL-6、IL-8浓度,严格遵从试剂说明操作。
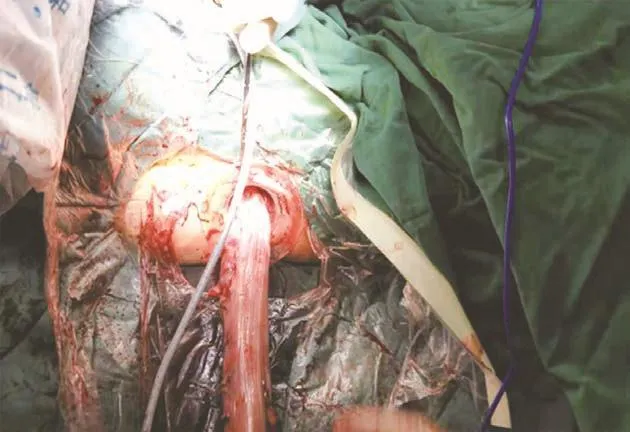
图3 将直肠经阴道拉出
1.5 统计学处理 采用SPSS 17.0软件进行数据分析,计量资料采用t检验,以均数±标准差(±s)表示;计数资料采用χ2检验,用频数表示,P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者临床资料的比较 两组患者性别、年龄、BMI指数、肿瘤大小、肿瘤下缘距肛缘距离、肿瘤浸润深度差异均无统计学意义(P>0.05),见表1。
2.2 两组患者临床指标的比较 两组手术时间、术中出血量、进食流质时间、清扫淋巴结数量差异均无统计学意义(P>0.05),住院时间、疼痛指数、睡眠质量评分、负性情绪评分方面差异有统计学意义(P<0.05),见表2。
2.3 术后并发症 两组患者术后并发症发生率差异无统计学意义(P>0.05),见表3。
2.4 实验数据指标 术前1 d及术后第1天、第3天、第5天,两组患者血清IL-6、IL-8差异均无统计学意义(P>0.05),见表4。
表1 两组患者一般资料的比较(±s)
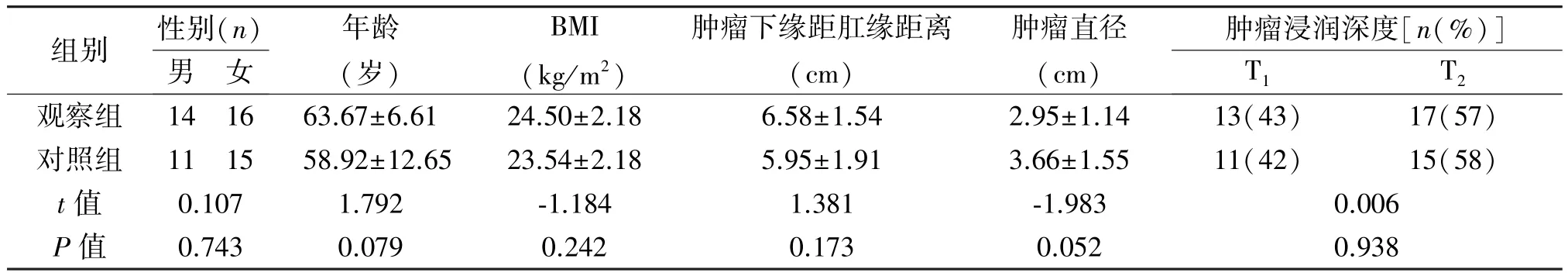
表1 两组患者一般资料的比较(±s)
组别 性别(n)肿瘤浸润深度[n(%)]男 女年龄(岁)BMI(kg/m2)肿瘤下缘距肛缘距离(cm)肿瘤直径(cm)T1 T2观察组 14 16 63.67±6.61 24.50±2.18 6.58±1.54 2.95±1.14 13(43) 17(57)对照组 11 15 58.92±12.65 23.54±2.18 5.95±1.91 3.66±1.55 11(42) 15(58)t值 0.107 1.792 -1.184 1.381 -1.983 0.006 P值 0.743 0.079 0.242 0.173 0.052 0.938
表2 两组患者临床指标的比较(±s)
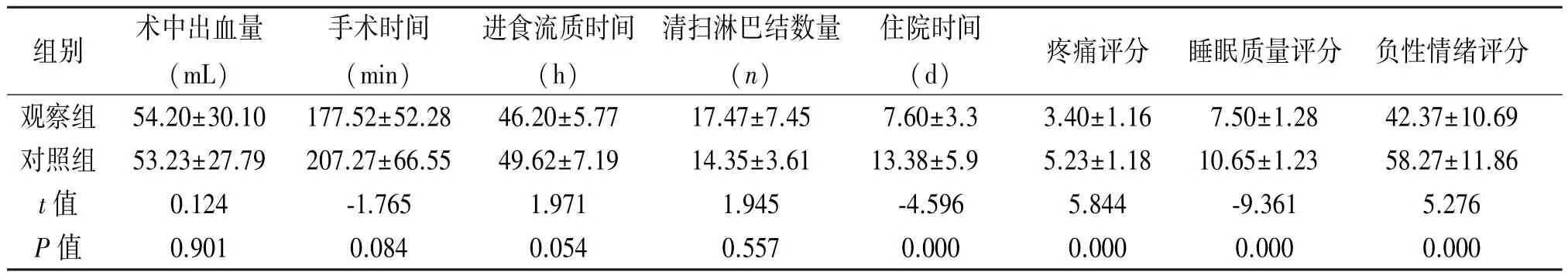
表2 两组患者临床指标的比较(±s)
组别 术中出血量(mL)手术时间(min)进食流质时间(h)清扫淋巴结数量(n)住院时间(d) 疼痛评分 睡眠质量评分 负性情绪评分观察组 54.20±30.10 177.52±52.28 46.20±5.77 17.47±7.45 7.60±3.3 3.40±1.16 7.50±1.28 42.37±10.69对照组 53.23±27.79 207.27±66.55 49.62±7.19 14.35±3.61 13.38±5.9 5.23±1.18 10.65±1.23 58.27±11.86 t值 0.124 -1.765 1.971 1.945 -4.596 5.844 -9.361 5.276 P值 0.901 0.084 0.054 0.557 0.000 0.000 0.000 0.000
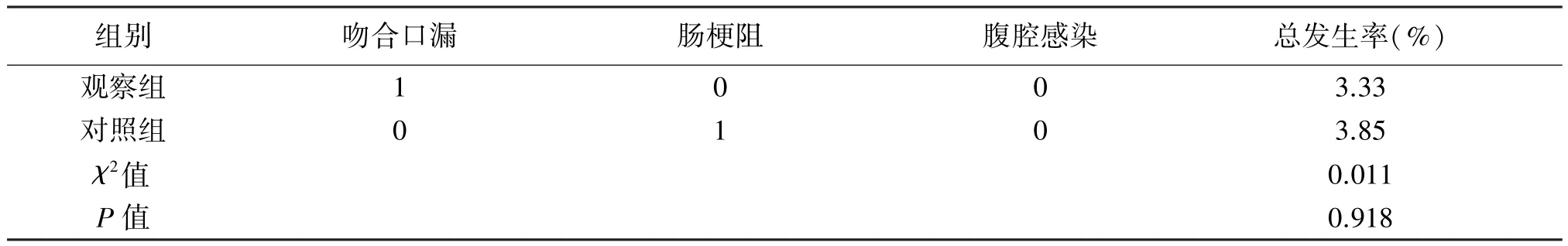
表3 两组患者术后并发症的比较(n)
表4 两组患者IL-6、IL-8水平的比较[(±s),ng/L]
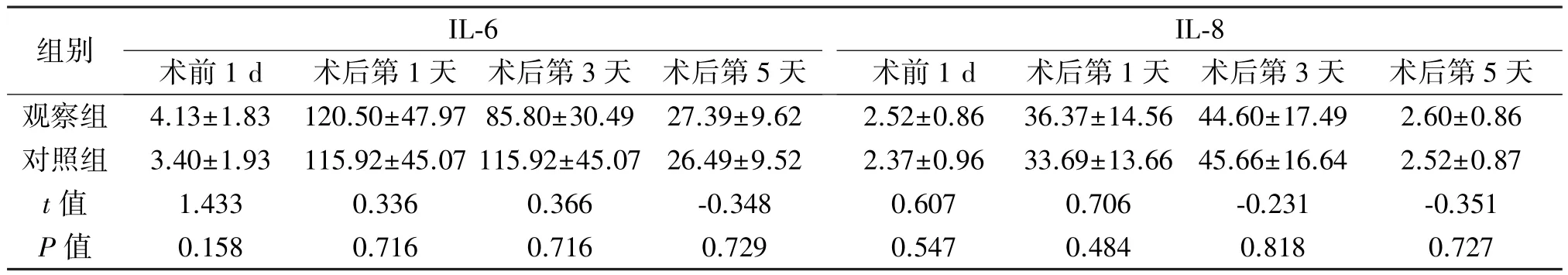
表4 两组患者IL-6、IL-8水平的比较[(±s),ng/L]
组别 IL-6 IL-8术前1 d 术后第1天 术后第3天 术后第5天 术前1 d 术后第1天 术后第3天 术后第5天观察组 4.13±1.83 120.50±47.97 85.80±30.49 27.39±9.62 2.52±0.86 36.37±14.56 44.60±17.49 2.60±0.86对照组 3.40±1.93 115.92±45.07 115.92±45.07 26.49±9.52 2.37±0.96 33.69±13.66 45.66±16.64 2.52±0.87 t值 1.433 0.336 0.366 -0.348 0.607 0.706 -0.231 -0.351 P值 0.158 0.716 0.716 0.729 0.547 0.484 0.818 0.727
3 讨 论
自上世纪90年代世界首例腹腔镜结直肠癌手术诞生以来,腹腔镜手术已成为直肠癌的主要治疗手段。大量临床研究表明,腹腔镜直肠癌手术完全符合外科手术肿瘤根治性切除的原则[10-11],而更多前瞻性研究表明,在直肠癌患者远期肿瘤学效果方面,腹腔镜手术相当于甚至优于传统开腹手术[12-13]。
随着微创外科理念的不断更新完善,外科医生对手术切口的要求更高,对“无疤痕”的追求越来越高。NOSES避免于腹部另做辅助切口,减少了腹部创伤,最大程度上保留了患者腹壁原有功能,美学效果更理想,在达到减少手术创伤目标的同时,既可完成手术标本的取出,又能实现消化道重建的目的。Wolthuis等[14]的研究表明,剧烈的切口疼痛是影响患者术后康复的一项重要因素,手术切口越大,对患者造成的疼痛感就会越强,患者术后诸如焦躁、恐惧等负面情绪同样会增加,从而对患者恢复产生严重的负面影响。本研究中,观察组住院时间、术后疼痛评分、睡眠质量分数、负性情绪评分优于对照组。由此表明,相较常规腹腔镜手术,NOSES减轻了术后疼痛感,可促进患者早期下床活动,减少了因腹部手术疤痕带来的心理负担,从而改善了患者的负性情绪与睡眠质量,患者在治疗过程中的信任度与主动性得以提升,使其在术后恢复期具有更好的舒适度。在加速机体康复的基础上,进一步使心理完全康复。另一方面,两组手术时间、术中出血量、清扫淋巴结数量、肠道功能恢复时间差异无统计学意义,表明NOSES符合传统腹腔镜手术的要求与标准。在术后并发症方面,观察组总发生率为3.33%,仅1例发生术后吻合口漏,无腹腔内感染、肠梗阻发生,相较对照组,并未增加围手术期并发症的发生风险。而且NOSES因腹部无辅助性切口,基本避免了切口感染、切口疝等相关并发症的发生,短期疗效令人满意。
外科手术的实质是对机体造成创伤的过程,创伤程度与血液内炎症因子的水平紧密相关[15-16],创伤后早期炎症反应的炎症因子与炎症反应程度呈现正相关关系。IL-6作为介导炎性反应的细胞因子,是由纤维母细胞、单核巨噬细胞、上皮细胞等多种细胞产生,能刺激参与免疫反应的细胞增殖、分化并提高其功能,对炎症反应刺激较为敏感,在炎性反应的早期阶段即可表达。手术对人体造成的损伤程度可通过白介素在人体血液内的浓度直接表现,当手术创伤较大时,IL-6会在应激的刺激下参与机体的免疫应答,从而大量表达。IL-8是趋化因子中的一员,在参与调节人类生殖生理与病理过程中发挥着重要作用,通过对中性粒细胞的趋化进而激活的作用实现对炎性反应的调节。IL-8通过损伤血管内皮细胞,造成组织器官坏死,并与IL-6联合产生了免疫应答的连锁反应,不但造成了机体严重的炎症反应,更加大损耗了机体的免疫应答与调节功能,进而增加了手术后感染与肿瘤复发转移扩散的几率[17-18]。NOSES在具体操作过程中的某些步骤(如吻合器钉砧自肛门置入腹腔内、腹腔内打开肠管),有造成术后感染率增加的可能[19]。本研究中,术前1 d及术后第1天、第3天、第5天,两组患者IL-6与IL-8差异无统计学意义(P>0.05),表明与传统腹腔镜手术相比,在术前肠道准备充分、精确把握手术关键步骤、遵循无菌操作基本原则的前提下,NOSES不会增加术后感染的风险。
综上所述,在遵循外科手术基本无菌无瘤操作的基础上,标本经肛门或阴道拉出,NOSES避免了腹部辅助切口,明显减轻了术后疼痛,更完整地保留了腹壁功能,加快了术后康复,缩短了住院时间,减轻了术后腹部疤痕对患者造成的不良心理暗示,完美地体现了快速康复理念,患者的生活质量得到进一步提升,具有微创效果与令人满意的近期疗效[20]。在掌握NOSES适应证与禁忌证的前提下,值得推广应用。
