腹腔镜袖状胃切除术后胃漏2例诊疗体会
2019-07-05杨晓平吴建林谭延禄刘志民
田 峰,杨晓平,吴建林,谭延禄,雷 森,刘志民
(淄博市中心医院,山东 淄博,255036)
随着腹腔镜技术的发展及手术经验的积累,腹腔镜袖状胃切除术(laparoscopic sleeve gastrectomy,LSG)已得到广泛认可并成为独立的代谢手术。随着LSG数量的日益增多,其相关手术并发症的报道逐渐增多,如胃漏、出血、营养不良、晚期体重回增等。胃漏是LSG术后最严重、最主要的并发症,可引起严重的腹腔感染,导致脓毒血症及多器官功能衰竭,甚至导致患者死亡。探讨LSG术后胃漏的发生原因及相关防治措施对于安全施行LSG、降低术后并发症发生率非常必要。2015年5月至2018年12月我院共完成46例LSG,其中发生胃漏2例,发生率为4.3%。现将这两例患者的诊疗体会报道如下,旨在总结SLG术后胃漏的处理经验,为同道提供借鉴。
1 资料与方法
1.1 临床资料 回顾分析2015年5月至2018年12月淄博市中心医院腹腔镜综合外科收治的LSG术后发生胃漏的2例患者的临床资料。病例 1,男,33岁,术前检查:体重105 kg,身高 1.74 m,腹围 128 cm,BMI 34.68 kg/m2,空腹血糖4.87 mmol/L,糖化血红蛋白5%,肝功能示高脂血症,超声提示脂肪肝,胃镜示胃底近贲门黏膜下隆起,术前诊断为原发性肥胖症及胃间质瘤,为我院第15例LSG患者。术中胃镜定位肿瘤于胃底近贲门及胃后壁,行腹腔镜胃间质瘤切除术+LSG,术中使用36Fr球囊胃管作引导,于胃底切开胃壁,将肿瘤及周围1 cm胃壁全层切除,镜下缝合胃壁,距幽门4 cm大弯侧胃壁起始,以切割闭合器紧贴球囊胃管依次向胃底切割闭合,至贲门左侧1 cm处,将缝合的胃底切线切除,胃切缘以3-0可吸收线缝合加固;患者于术后第7天出现心动过速、发热、腹痛及左肩部疼痛,上消化道造影提示造影剂溢出,瘘口位于食管胃底结合部,造影剂积聚于瘘口附近(图1),CT检查示左上腹腹腔积液、左下肺炎、胸腔积液,白细胞及C反应蛋白升高。病例 2,女,28岁,术前检查:体重170 kg,身高 1.78 m,腹围 147 cm,BMI 53.65 kg/m2,空腹血糖7.46 mmol/L,糖化血红蛋白7.9%,超声示重度脂肪肝,术前胃镜结果示食管裂孔疝,术前诊断为代谢综合征(2型糖尿病、高脂血症、高胰岛素血症)及食管裂孔疝,为我院第30例LSG患者,行腹腔镜食管裂孔疝修补术+LSG,术中使用36Fr球囊胃管作引导,患者于术后第8天出院,术后第22天出现心动过速、发热、腹痛及左肩部疼痛,上消化道造影提示造影剂溢出,瘘口位于食管胃底结合部,造影剂积聚于瘘口附近(图2),CT检查提示左上腹腹腔积液、左下肺炎、胸腔积液,白细胞及C反应蛋白升高。
1.2 方法 诊断明确后予以禁食、抑酸、抑酶、补液、抗感染等治疗,同时我们借助X线设备,通过间断消化道置管技术放置三腔喂养管(总长度150 cm、负压吸引腔95 cm、空肠喂养腔150 cm),一端开口在胃腔,一端在胃瘘口处,空肠营养管末端在空肠上段,可同时行胃肠减压、胃瘘口冲洗及肠内营养,并予以黎氏管腹腔冲洗引流,持续从三腔喂养管、腹腔黎氏管滴入无菌生理盐水,总量3 000~4 000 mL/d,滴速30滴/min,20~40 mmHg持续负压引流并保持通畅。
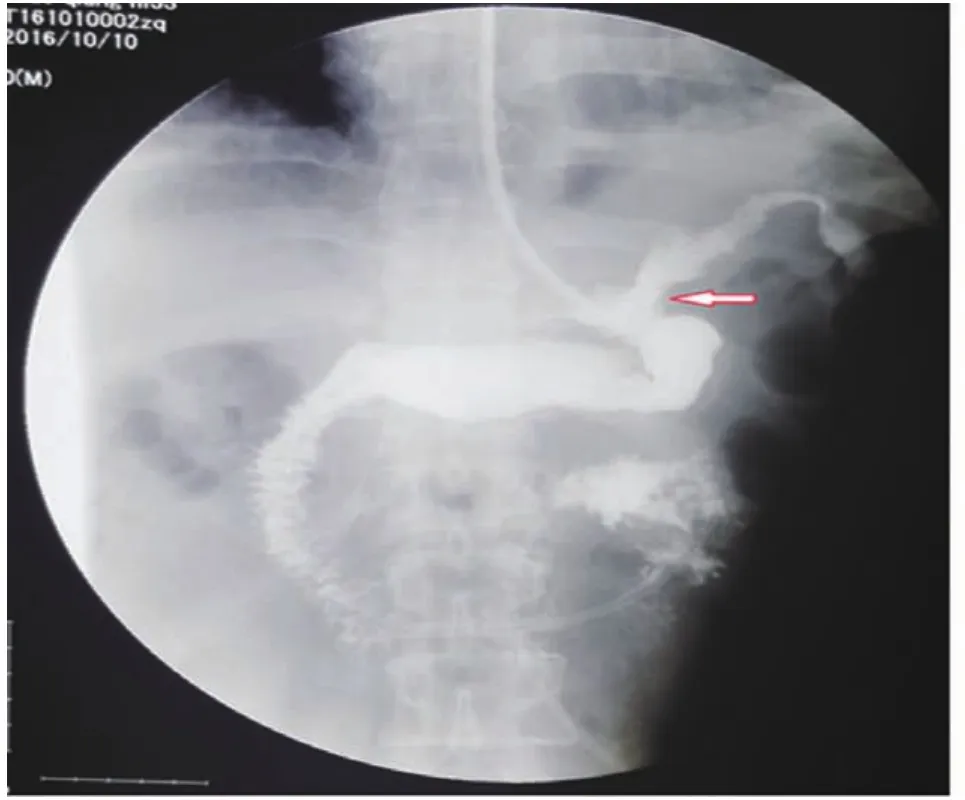
图1 病例1,瘘口位于食管胃底结合部
2 结 果
2例胃漏患者均获治愈。病例1治疗63 d后,复查上消化道造影,示原瘘口处无造影剂溢出,造影剂可顺利通过十二指肠(图3);病例2治疗17 d后复查上消化道造影,提示原瘘口处无造影剂溢出,造影剂可顺利通过十二指肠(图4)。
3 讨 论
LSG作为一种限制型减重手术,因操作简单、手术风险较小、疗效确切等优点,近年得到广泛开展[1],在胃肠道代谢手术中的比例显著提升[2],已成为减重外科的首选术式。LSG减重效果确切有效,可不同程度地缓解肥胖症、2型糖尿病、高脂血症、代谢综合征、呼吸睡眠暂停综合征等多种疾病,如何防治术后并发症成为代谢外科医师所关注的课题。
目前胃漏被认为是最严重的LSG术后并发症,如不能得到及时诊治,会发展为严重的脓毒血症、多器官功能衰竭,甚至死亡。胃漏治疗周期长、花费成本高,发生后需及时诊断并予以迅速有效的治疗。对于LSG术后胃漏的发生率,各医学中心存在差异,2011年国际袖状胃切除术专家组对12 799例LSG进行Meta分析,结果显示术后胃漏发生率为1.06%[3];Benedix等[4]于2017年进行的Meta分析表明,LSG术后胃漏发生率为1.53%;2018年Gaillard等[5]等报道205例手术,9例患者发生胃漏,发生率为4.4%。2015年5月~2018年12月笔者医院共完成46例LSG,发生胃漏2例,发生率为4.3%。
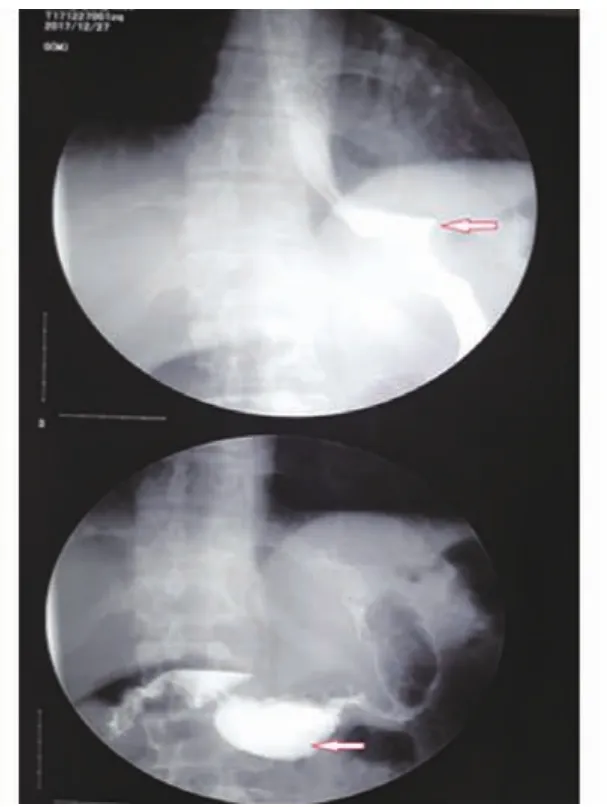
图3 病例1,治愈后复查见原瘘口处无造影剂溢出,造影剂顺利通过十二指肠
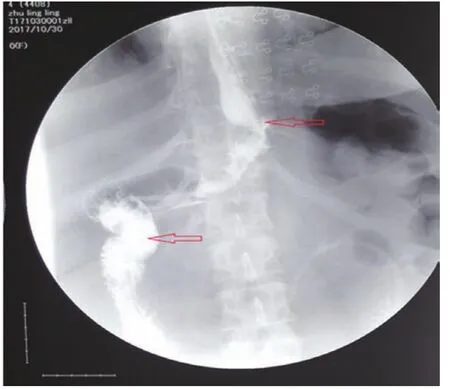
图4 病例2,治愈后复查见原瘘口处无造影剂溢出, 造影剂顺利通过十二指肠
LSG术后胃漏多发生于术后48 h内,典型的胃漏多发生于术后5~7 d,这是由于此时胃切缘愈合正处于炎症期与纤维化期,各种原因引起的切缘缺血将导致愈合不良从而发生胃漏[6-7]。Deitel等[8]根据LSG术后胃漏发生时间将其分为4期:(1)急性漏,发生于术后1周;(2)早期漏,发生于术后1~6周;(3)晚期漏,发生于术后6~12周;(4)慢性漏,发生于12周后。本研究中2例患者分别于术后第7天、第22天确诊胃漏,分别属于急性漏及早期漏。胃漏的位置包括近端、中段、远端、胃后壁及无法定位者,LSG术后胃漏发生部位通常位于胃近端切缘,尤以胃食管结合部最常见[9-10],本研究中2例患者瘘口均位于食管结合部。
大多数胃漏患者最早发生的症状为心动过速,发生时间多早于腹痛、发热,如果心率长时间>120次/min,在排除循环容量不足、疼痛等常见原因后,需特别警惕是否发生胃漏。LSG术后患者出现腹痛(多以左上腹为主)、发热,也应考虑有无胃漏发生。突发性左肩痛是LSG术后胃漏的典型症状,系漏出物积聚刺激左侧膈肌所致,予以引流后疼痛短时间内即可缓解。胃漏患者可有腹部压痛、反跳痛及肌紧张等腹膜炎表现,引流管可见黄色浑浊含絮状物液体。本研究中2例患者分别于术后第7天、第22天出现心动过速、发热、腹痛及左肩部疼痛。上消化道造影检查可明确胃漏及其位置、严重程度,是确诊的首选方法。2例患者上消化道造影均提示造影剂溢出,瘘口位于食管胃底结合部,CT检查提示左上腹腹腔积液、左下肺炎、胸腔积液,白细胞及C反应蛋白升高。
胃漏的治疗主要包括基础治疗、内镜治疗及手术治疗,基础治疗包括禁食、胃肠减压、补液、抗感染、抑酸、抑酶、营养支持等综合治疗。充分引流是最重要的治疗措施,引流通畅是治疗成功的关键,清除污染物并充分引流可避免积液扩散发展为弥漫性腹膜炎,控制局部感染,促进瘘口的愈合。胃漏发生后,术中放置的单腔乳胶引流管容易被胃内容物、血块或纤维素渗出物堵塞导致引流不畅。研究显示[11],腹腔镜胃癌根治术后发生吻合口漏时,放置黎氏引流管可将大量渗出物、炎症坏死物质、消化道内容物引出,使感染得到有效控制。三腔喂养管吸引腔的侧孔多,不易堵管,引流效率优于普通胃管[12]。我们应用三腔喂养管行胃瘘口冲洗及黎氏管腹腔冲洗引流的方法,生理盐水的持续冲洗能及时清除瘘口周围坏死组织、胃内容物、腹腔内消化液并稀释引流液,减轻对周围组织的刺激,有效控制感染、促进新鲜肉芽组织生长,加快瘘口愈合。双管腔负压引流对胃瘘口、腹腔内液体起到持续性引流作用,可实现充分引流的目的。营养支持是预后的保障,包括完全胃肠外营养、肠内营养两种方式,胃漏早期可采用完全胃肠外营养,病情稳定后可通过三腔喂养管行空肠肠内营养。早期肠内营养不仅可改善患者的营养状况,对防止肠黏膜萎缩及菌群易位具有重要意义[13]。本研究中2例胃漏患者首先予以完全胃肠外营养,病情稳定后行肠内营养,效果良好。持续良好的胃腔内减压,可减轻胃扩张,降低瘘口处的压力,有效减少漏出量,提高胃漏的治愈率。传统的临床治疗常采用胃肠减压管及鼻空肠管的方法,但大部分患者对于“双管齐下”的方式不能耐受。使用三腔喂养管减少了胃管置入这一环节,患者耐受性好,可同时实现胃肠减压、瘘口冲洗及经空肠肠内营养的目的。研究表明[14],内镜下覆膜支架置入可治疗急性近端胃漏或保守治疗未能愈合的胃漏,有条件的医院可选择在内镜下置入覆膜食管支架治疗,这是目前胃漏内镜下治疗的首选方法。对于血流动力学不稳定、弥漫性腹膜炎或长期不愈的患者,手术是唯一的治疗方法。
发生胃漏的危险因素包括:(1)超级肥胖症。研究显示,超级肥胖患者的胃漏发生率高达3%[3],也有学者发表了不同观点,Cottam等[15]为一组平均BMI 65.3 kg/m2的患者施行LSG,术后胃漏的发生率为1.2%。(2)血运因素。过度游离胃后壁[10]、裸化His角可能影响胃底处的动脉供血及静脉回流,导致血运障碍并影响胃闭合线的愈合。(3)过于贴近胃食管结合部激发钉仓。目前越来越多的学者建议距胃食管结合部至少2 cm处离断胃底。(4)校正管的选择。选择较大直径的校正管[16],可降低残胃压力、胃漏发生率。(5)残胃的顺应性下降。术后过早、过多、过快进食,会诱发剧烈呕吐,导致胃腔压力超过胃闭合线的耐受程度从而发生胃漏。(6)笔者认为,与远端胃癌根治术不同,LSG完整保留了幽门、贲门,残留胃腔压力较高,是术后发生胃漏的一个不可忽视的因素。我们考虑例1发生胃漏的原因为胃间质瘤位于胃底近贲门处,过于贴近胃食管结合处(<1 cm)击发钉枪,切割线跨过较厚的食管肌层及较薄的胃壁钉合不严密所致;例2发生胃漏的原因为食管裂孔疝修补过程中,His角过度裸化,减少了胃底处的动脉供血及静脉回流,导致胃食管结合处血运障碍,影响了胃闭合线的愈合。
胃漏的预防措施包括:(1)选择合适的校正胃管:建议直径在32~36Fr;(2)保护残胃血供:避免对近端胃后壁及His角处的过度游离;(3)正确处理胃食管结合部:使用白色钉仓,最后一次切割闭合时不应紧贴校正管,并将钉枪朝左侧稍偏转[17];(4)正确使用切割闭合器:击发离断胃壁前保证至少15 s的组织压榨时间,吻合器击发前应将胃的前后壁展平;(5)重视超级肥胖患者:增加穿刺孔,使用加长Trocar与器械;(6)加强饮食指导:早期以流食为主,少量多次,缓慢进食。
胃漏是LSG术后严重、棘手的并发症,受残胃血供、残胃大小、手术操作技术等多方面影响。选择合适的校正胃管、保护残胃血供、正确处理胃食管结合部及重视超级肥胖患者可降低胃漏发生率。早期准确诊断及有效治疗对于LSG术后胃漏患者具有重要意义,根据患者具体情况选择个体化的治疗方案能有效处理手术并发症。我们2例胃漏患者通过胃瘘口及腹腔的充分冲洗引流、胃肠减压、肠内营养支持等保守治疗获得痊愈。应用三腔喂养管行胃瘘口冲洗及肠内营养、黎氏管腹腔持续冲洗引流,可有效控制腹腔感染,提高胃漏治愈率,方法简单、易行,效果确切、安全,值得临床推广。
