银杏类制剂安全性研究进展*
2019-07-05郑伟然韩兆忠王正宽马晓瑛黄文哲屠鹏飞于学敏
郑伟然,韩兆忠,王正宽,施 静,马晓瑛,孙 郊,黄文哲,屠鹏飞,于学敏,萧 伟**
(1.江苏康缘药业股份有限公司 连云港 222001;2.中药制药过程新技术国家重点实验室连云港 222001;3.江苏省企业院士工作站 连云港 222001;4.北京大学 北京 100871)
银杏树最早出现于二叠纪,距今约有2.8亿年的历史,在1.2亿年前处于繁荣时期。在欧洲大约于270万年前-170万年前,北美洲约7-10万年前灭绝[1]。幸存下来的多分布在中国和亚洲的部分地区[2]。因此,银杏树被称为“活化石”。归因于其观赏价值,且具有较好的抵制污染、抗病虫害的能力,银杏树被人工培植,现已作为景观树种广泛分布在世界各地[3]。
元代医家李杲的《食物本草》最早记载了银杏的毒性和解毒方法:“小儿食之,发惊,多食,立死”,“连饮冷白酒几盏,吐出则生”[4]。后世历代文献多数都认为银杏有毒或有小毒。《本草蒙筌》谓其“阴毒之果,不可不防”。《本草纲目》认为白果“性温,有小毒。”《本草征要》云:“确有小毒,……小儿尤当慎之。”《滇南本草》:“不可多食,若食千枚,其人必死”。
银杏提取物作为食品补充剂已有几十年的历史,现已成为全球销量最大的植物类食品添加剂之一。同时银杏类的药物种类较多,不良反应也屡见报道。本文对对银杏类制剂的安全性研究进行综述,以期为临床应用和进一步开发此类制剂提供参考。
1 与毒性相关的化学成分
银杏酸(ginkgolic acids,GAs)是银杏果实和叶子中存在的苯酚类化合物,是引起过敏[5]、细胞毒性、致癌、致畸、致突变、遗传毒性毒[6-12]等毒副作用的主要物质。前联邦德国卫生局委员会1997年限定GAs在植物提取物中的含量必须低于5 μg·g-1[13]。2010版中国药典也限定EBG中GAs含量应低于10 mg·kg-1[14]。各厂家生产的银杏提取物中银杏酸的含量也有差异。例如意大利Indena S.p.A.生产的银杏提取物(IDN5933,Ginkgoselect®Plus,GAs 含 量 为 5 PPM[15]。 德 国 Dr.Willmar Schwabe Pharmaceuticals公司生产的标准银杏叶提取物EGb761含有小于5PPM的GAs,5-10%的有机酸[16]。其他的成分如银杏毒素4′-O-甲基吡哆醇(4-O-methylpyridoxine,MPN)属于神经毒素。细胞试验发现某些黄酮苷类如槲皮素、山柰酚、异鼠李素具有基因毒性[17,18],但大量的临床和流行病学研究尚未发现这些成分与癌症具有相关性,相反多数研究认为其具有抗癌防癌作用[19-24]。
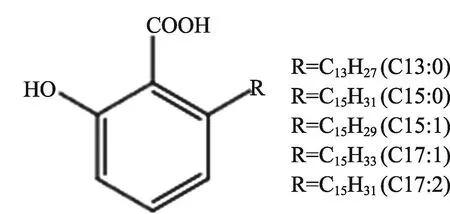
图1 银杏酸分子结构

图2 4'-O-甲基吡哆醇分子结构
2 主要的不良反应
大量的临床试验均表明银杏类制剂具有较好的耐受性,药物组和安慰剂组不良事件的发生率均未见统计学差异[25-29]。多数不良反应多散见于个案报道,这些报道多数认为不良反应多发生于合并用药或其他合并疾病的患者[30]。
2.1 过敏反应
过敏反应多发生在食用、接触银杏果实、种子或服用银杏粗提物的患者中。3例患者接触银杏果实的汁液后发生了过敏性皮炎[31]。一个45岁男性,服用银杏制剂治疗治疗耳鸣,48小时后四肢发生急性泛发性脓疱性皮炎,2天内,皮疹蔓延至面部。患者否认同时服用其他药物,否认之前服用过银杏制剂[32]。Dominik Metz[33]报道了一例77岁男性服用银杏制剂和淫羊藿后发生脉管炎性皮疹(vasculitic rash)的病历。Yuste[34]报道了一例服用银杏制剂所致重症多形红斑(Stevens-Johnson syndrome,SJS)。一个63岁的男性食用银杏果实后,诱发了皮肤黏膜过敏,出现了口唇炎、口腔炎、直肠炎和肛门搔痒症[35]。前期的大量临床和动物实验研究表明,烷基酚类如银杏酸是诱发过敏反应的主要成分[7]。豚鼠迟发型超敏试验已证实银杏酸的高致敏性[36]。
2.2 自发性出血
一项为期3年,对32万份门诊病历处方数据库中出血事件的调查,未发现使用银杏制剂使患者增加出血风险[6]。Kellermann对18个随机对照试验中的1985个使用银杏提取物患者的病历进行了meta分析,未发现和出血有关的高危因素[37]。Stephen Bent分析了15个病历报告,显示出血事件和服用银杏提取物之间存在可能的相关性。其中3个病历在服用银杏提取物时出血时间延长,6个病例在停用银杏制剂后出血停止[38]。很多个案报道了可能有银杏制剂引起的异常出血[39]。一个59岁韩国男性患者行肝移植手术后,常规术后超声检查发现肝顶部被膜下血肿,伴有右眼玻璃体出血,医生发现患者在手术前和术后均服用了银杏制剂[40]。
目前尚无确切的证据表明银杏类制剂是诱发出血的独立危险因素。很多发生出血的案例多伴有其他危险因素(如手术)。只有少数研究仅提供了出血时间[41],多数文献未提供既往服药史伴随用药,故无法判断是否与银杏制剂与药物之间发生了相互作用有关。
2.3 癫痫发作
一个36岁健康女性,无癫痫家族史。在食用银杏70-80颗果实后,出现呕吐和癫痫痉挛强直发作[42]。2001年,Gregory报道了7例和银杏制剂有关的癫痫发作的病历,其中3例为单独使用银杏类制剂[43]。
银杏种子中毒多源于其中的神经毒素4′-O-甲基吡哆醇(4-O-methylpyridoxine,MPN)[44]。MPN又叫银杏毒素,干预维生素B6的生物合成、代谢和功能,导致维生素B6缺乏从而进一步减少脑内γ-氨基丁酸(GABA)的合成[45,46]。尽管发生率很低,但银杏种子中毒症状一般较为严重,主要表现为强直阵挛性癫痫、呕吐、过度兴奋或意识丧失等[42,47]。银杏种子中MPN含量在170-404 ppm之间[48]。MPN非常耐热,烹饪或其他手段只能使其部分灭活[49]。银杏叶中含有极其微量的MPN,不足以产生危害。采用最新的技术手段检测银杏叶中的MPN,其含量均低于可测浓度(9 ppm)[50]。但是对于幼儿和有癫痫史的患者,使用时仍要慎重[51]。
2.4 致癌致突变
有细胞和动物试验显示银杏类制剂具有致癌性,但临床和流行病学研究未发现长期服用银杏类制剂与癌症具有相关性,甚至具有较好的抗癌作用。细胞试验研究显示,银杏制剂中主要的黄酮苷类包括槲皮素、山柰酚和异鼠李素导致的基因毒性的主要物质[17,18]。Ames试验[52]、小鼠淋巴瘤细胞试验[53]、微核试验[54]和中国仓鼠卵巢细胞染色体畸变试验[55]中,均发现银杏叶提取物中的两个主要成分槲皮素和山柰酚诱导的致突变和染色体断裂效应。在人肝癌细胞株HepG2、HELa细胞、人淋巴细胞的碱性单细胞凝胶电泳(SCGE)试验发现,槲皮素可以诱导DNA链的断裂[56]。但是也有研究发现,黄酮类物质如槲皮素和山柰酚,既有细胞/基因毒性,也有细胞/基因保护作用,这取决于黄酮的浓度和细胞的孵化周期[57]。
美国国家毒理学计划(National Toxicology Program,NTP)开展的3个月的毒理试验和2年的致癌试验研究[58,59]表明,大鼠给予125-2000 mg·kg-1的银杏提取物,每周5天,连续14周,出现明显的肝脏和甲状腺毒性。同时,在2年的致癌试验中,大鼠(100-1000mg·kg-1·天-1)和小鼠(200-2000 mg·kg-1·天-1)肝脏和甲状腺均出现了癌变。细菌基因突变试验中,银杏叶提取物在1-10 mg/板时,在鼠伤寒沙门氏菌株TA98和TA100中发生了基因突变[58]。
对一项大型随机双盲临床试验[29]数据的二次分析的结果未发现服用银杏叶提取物和癌症的发生率之间有相关性[60]。一项病例对照研究纳入668名卵巢癌患者作为病例组,721健康志愿者作为对照组。结果发现对照组服用银杏类制剂的人数占4.2%,而病例组服用银杏类制剂的人数仅占1.6%,服用银杏制剂与卵巢癌的发病率呈负相关[RR=0.41,95%CI=(0.20,0.84),P=0.01][61]。有较多的综述对槲皮素、山柰酚等黄酮类物质与癌症相关性的临床和流行病学资料进行系统性分析,发现这类物质均具有较好的抗癌性,未发现在人体应用中有致癌性的报道[19-24]。
银杏制剂较为偶发的不良反应还有胃肠不适、头痛、恶心呕吐、眩晕、躁动等[62,63]。
3 药物间相互作用
化药和中草药之间的相互作用一直备受关注。特别是对于那些治疗窗口很低的化学药物(如华法林和地高辛),联合用药可能会引起药物代谢和药效方面的改变,从而诱发严重的甚至危及生命的不良反应。因此,有需要深入研究药物之间发生相互作用的物质基础及其机制,为临床提供有价值的用药依据。
3.1 与抗血小板、抗凝药物联用
银杏内酯是天然的血小板活化因子受体拮抗剂,具有抗血小板作用[64]。病人服用抗血小板和/或抗凝药物,如华法林、非甾体类抗炎药如阿司匹林、布洛芬、罗非昔布等,同时服用正常剂量的银杏制剂后,出现了眼前房出血[65]、颅内出血[66]。近期一项研究从美国退伍军人管理局(Veterans Administration,VA)情报信息数据库中采集了807399个病例,其中11003例至少服用了1次华法林和银杏制剂(银杏组),另外796396例仅服用了华法林(非银杏组)。结果显示与非银杏组比较,同时服用银杏提取物和华法林组的患者出血风险显著增加[67]。与之相反的是,一项由50名男性健康志愿者参加的双盲双模拟研究中,对照组口服阿司匹林,试验组口服阿司匹林和EGb 761[68]。结果显示同时服用阿司匹林和EGb 761没有增加出血风险,其中包含使用EGb761的老年人群。一项双盲交叉试验[69],研究了服用辅酶Q10或银杏提取物对长期服用华法林患者的影响。试验招募了24例长期服用华法林用于复发性静脉血栓、机械心脏瓣膜或慢性房颤的患者。研究期间患者国际标准化比值(international normalised ratio,INR)保持稳定,未发现异常出血事件。
银杏提取物本身具有抗血小板和抗凝作用。与抗血小板或抗凝药物联合使用,可能是降低了血小板聚集后导致了出血风险的增加[39,70,71]。因此在临床治疗中,要采取保守的态度,对于服用抗血小板和抗凝药物的患者,要慎用银杏类制剂[72]。
3.2 与精神神经类药物联用
单独使用银杏制剂未见有镇静催眠作用的报道。一名80岁女性阿尔兹海默病患者,同时服用了曲唑酮和银杏制剂,数天后出现了昏迷。静脉滴注苯二氮卓受体拮抗剂氟马西尼后苏醒[73]。作者推测,银杏制剂中的黄酮类成分具有苯二氮卓激动剂样作用,增加了γ-氨基丁酸的活性;另一方面,黄酮类成分提高了CYP3A4活性,导致氟马西尼的活性代谢产物1-(3-氯苯基)哌嗪(mCPP)增加,进一步增强了γ-氨基丁酸的活性,从而导致患者昏迷。
银杏内酯能诱导CYP3A4的转录和蛋白表达,使其对卡马西平的代谢能力增强。银杏制剂与卡马西平联用后,卡马西平的血药浓度和平均滞留时间都明显缩短[74]。
两位老年癫痫患者服用丙戊酸钠病情控制良好,但是在服用银杏制剂后2周内癫痫复发。停用银杏制剂数月后,癫痫再次得到控制[75]。在英国,一个55岁的癫痫患者在服药依从性良好且病情得到控制的情况下,癫痫突然发作,抢救无效死亡。毒理学分析显示,患者血浆中的丙戊酸钠和苯妥英钠含量均低于有效水平。追问病史,发现患者生前一年内持续服用银杏制剂[76]。该文作者检索文献发现,银杏类制剂可以显著诱导CYP2C9和CYP2C19活性,而苯多英钠和丙戊酸钠都是通过这两种肝药酶代谢[77]。作者认为苯妥英的血药浓度下降虽然不能肯定地归因于这种药物与药物的相互作用,但在缺乏其他假设支持的情况下,至少这一特点是患者发生突发性癫痫的因素之一。因此作者建议有惊厥病史的人慎用银杏类制剂[76]。
3.3 与钙离子拮抗剂联用
M Smith[78]招募22名健康志愿者连续18天每日服用银杏制剂后再服用硝苯地平10 mg,硝苯地平的血药浓度明显上升,受试者的潮红、头痛等不良反应的发生率均高于单用硝苯地平的志愿者。银杏制剂中的黄酮类成分可抑制肝药酶CYP3A4,从而抑制了硝苯地平的代谢,导致了不良反应的发生。
银杏叶提取物可以提高肝药酶CYP3A2的mRNA水平,从而加快了尼卡地平的代谢,使尼卡地平的降压效果无法得到充分的发挥[79]。
3.4 其他药物联用
银杏内酯基因依赖性地诱导CYP2C19活性,加快奥美拉唑羟基化代谢,从而使奥美拉唑的的血药浓度和生物利用度降低,不能发挥应有的疗效[80]。
4 展望
全球对银杏制剂的使用量逐年增加,同时对银杏类制剂不良反应的报道越来越多。但是在一些国家,尤其是美国,银杏类制剂是作为食品添加剂上市的,依据当地法律,并不要求厂家提供毒理学报告并进行安全性监测,这就导致相当数量的不良反应没有报道[81];银杏制剂有的是作为非处方药或健康食品出售的,在说明书上往往没有说明其不良反应或药物之间的相互作用。而患者往往自己购买服用,临床医生在治疗中无法得知患者已服用这些药物,开出的药物可能会与银杏类制剂发生药物间的相互作用。这就要求国家建立更全面的药品食品不良反应监管体系,及时收集分析银杏类制剂不良反应的类型和发生规律并向社会公布。同时医患之间要加强沟通,医生要熟悉银杏类制剂的药物-药物间的相互作用,在明确患者的既往史和用药史的基础上开展治疗。另外,企业应该发挥不良反应监测的主体作用,积极研究银杏类制剂诱发毒性的物质基础及其病理机制,主动开展前瞻性、多中心、大样本的药物安全性医院集中监测研究、长期注册登记研究,同时全面收集不同来源的安全性证据,包括文献报道、国家药品不良反应监测中心药品不良反应自发呈报系统(spontaneous reporting system,SRS)数据、医院信息系统(hospital information system,HIS)等。以此为基础构建药物上市后安全性证据体[82],并实现数据的公开和共享。同时,对其有效物质进行提取纯化,摈弃容易诱发不良反应的杂质,从而开发更安全、更有效的药物,也是未来重要的研究方向。
