推拿对失神经骨骼肌萎缩大鼠的治疗作用及其机制*
2019-07-03万小凤唐成林赵丹丹安荟羽谯童茜
万小凤, 唐成林, 赵丹丹, 安荟羽, 马 翔, 谯童茜
(1. 重庆医科大学中医药学院, 重庆 400016; 2. 中医药防治代谢性疾病重庆市重点实验室, 重庆 400016)
骨骼肌是周围神经系统的靶器官,一旦失去神经支配,骨骼肌由于神经的营养作用丧失及自身废用而发生萎缩,如不及时治疗,将造成肢体功能障碍,严重影响患者的生活质量及劳动能力。由于神经再生速度有限和失神经肌萎缩的快速性、不可逆性,临床治疗上如何有效延缓失神经肌萎缩将是一个关键点。肌萎缩过程中,蛋白合成与蛋白降解之间的平衡被打破,肌蛋白分解率增加导致肌肉质量显著下降,肌纤维直径减小[1-2]。研究发现[3],泛素蛋白酶体系统可调节肌原纤维蛋白的降解,在介导肌肉萎缩方面发挥着重要的作用,其中泛素蛋白连接酶 E3s(ubiquitin protein ligase E3s)是该系统的关键酶。肌肉环状指基因1(muscle ring finger 1, MuRF1)和肌肉萎缩盒F基因(muscle atrophy F-box, MAFbx)作为泛素蛋白连接酶 E3s发挥作用,可导致肌球蛋白重链[4]和肌动蛋白[5]等肌收缩蛋白的降解。蛋白激酶B(protein kinase B, Akt)通过对叉头框蛋白O(forkhead box O,FoxO)转录因子家族的抑制作用,来防止骨骼肌萎缩关键因子MuRF1和MAFbx的转录上调从而抑制蛋白质降解[6-7]。最近的研究揭示microRNA(miRNA)在多种生物学和病理学过程中发挥着基础性作用[8-9],包括对骨骼肌形态、功能等方面均具有重要的调节作用,其中miR-23a通过与MAFbx和MuRF1 mRNA的3'-UTR结合以抑制它们的翻译,从而抵抗肌肉萎缩[10]。
运用推拿治疗肌肉方面的相关疾病,在临床上取得了良好的效果,但其机制研究报道较少,推拿是否可以通过调控骨骼肌萎缩过程中miR-23a、Akt、MuRF1、MAFbx mRNA的表达进而延缓骨骼肌蛋白降解,尚未见报道。本实验拟通过建立大鼠失神经骨骼肌萎缩模型,观察失神经后不同时间点大鼠的腓肠肌湿重比、肌纤维截面积和直径的变化来判断推拿干预对失神经肌萎缩大鼠的治疗作用,并通过观察推拿对腓肠肌中miR-23a、Akt、MuRF1、MAFbx mRNA表达的影响,从蛋白质降解角度探讨推拿延缓失神经肌萎缩的可能作用机制。
1 材料与方法
1.1 实验动物
实验选取8周龄清洁级健康雄性SD大鼠48只,体质量250 ~280 g,由成都达硕实验动物有限公司提供,许可证号SCXK(川)2015-030。饲养于重庆医科大学动物实验中心IVC级动物房,按照每笼5只饲养,室温(22±2)℃,相对湿度50%~60%,明暗12 h交替,大鼠自由摄取饮食。
1.2 主要试剂与仪器
Trizol总RNA提取试剂(北京天根生化科技有限公司)、RR047A反转录试剂盒、SYBR Premix Ex Taq TMⅡ、Akt、MuRF1、MAFbx、β-Actin、miR-23a、U6引物合成(日本TAKARA公司)、AL204型电子天平(瑞士METTLER TOLEDO公司)、冰冻切片机(德国 LEICA公司)、BX 53普通正置显微镜、CellSens Standard图像采集软件(日本OLYMPUS公司)、Image Pro Plus 6.0图像分析软件、低温高速离心机(SIGMA 公司)、Thermo ND 2000超微量核酸蛋白测定仪(上海GENE公司)、T 100TMPCR仪(美国BIO RAD公司)、CFX ConnectTM荧光定量PCR检测系统(美国BIO RAD公司)。
1.3 实验分组及模型制备
大鼠适应性喂养1周后,按照随机数字表法分为模型组、推拿组,每组24只。每组大鼠用10%水合氯醛0.3 ml/100 g腹腔注射麻醉,俯卧位固定于手术台上,右股部手术区域常规备皮、消毒、铺巾。无菌条件下于右后肢股后外侧切口,沿臀大肌间隙钝性分离、暴露坐骨神经分岔处,找到胫神经切断,造成1 cm神经缺损。模型由同一人同手法操作以减少实验误差。
1.4 干预方法
除0 d推拿组以外,推拿组在术后第2日开始手法治疗。于每日14:00进行干预治疗,先用自制的头套将大鼠的头部套住,待其情绪稳定后,由专人沿着腓肠肌方向用拇指按揉法进行推拿干预。标准:推拿手法缓和,均匀持久,2 000次,120~140次/分,每天治疗1次,每次约15 min,推拿时以大鼠不乱动乱叫的安静状态为标准,并以此作为老鼠的最佳刺激量,如果推拿期间大鼠乱动可待其安静后继续推拿。模型组除不进行推拿外,其他同推拿组。
1.5 标本采集
模型组和推拿组分别于术后0 d(术后立即取材)、7 d、14 d、21 d随机抓取6只动物取材。大鼠10%水合氯醛0.3 ml/100 g腹腔注射麻醉,无菌条件下完整剥离双侧腓肠肌,PBS缓冲液冲洗后吸干肌肉表面残留液体。将术侧腓肠肌组织分为两份,一份迅速放入液氮罐中,-80℃冰箱储存待测;另一份4%多聚甲醛固定,用于形态学检测。
1.6 腓肠肌湿重比
取材时观察术侧腓肠肌萎缩情况,包括肌肉饱满度、色泽等。观察后完整取下双侧腓肠肌,用电子天平称取双侧腓肠肌湿重,以自身健侧作为对照,计算腓肠肌湿重比。
1.7 肌纤维截面积及直径
腓肠肌4%多聚甲醛固定24 h,蔗糖梯度脱水3 d后送至重庆医科大学基础医学院组织切片室完成HE染色,400倍光学显微镜观察,每张切片随机选取5个视野拍照,Image Pro Plus 6.0图像分析软件计算肌纤维截面积和直径。
1.8 实时荧光定量PCR检测腓肠肌Akt、MuRF1、MAFbx、miR-23a mRNA表达
-80℃冰箱取出冰冻保存的腓肠肌组织样本约50 mg,与Trizol液充分研磨,加氯仿萃取,提取组织上清后加入等体积异丙醇离心沉淀,75%酒精漂洗3次后晾干,加入DEPC水待检。检测总RNA浓度及纯度后按反转录试剂盒操作步骤配制反应体系,于T 100TMPCR仪中进行逆转录,按照SYBR Green法配制反应体系后上机进行qPCR反应。CFXmanager 3.1软件读取Ct值后计算2-△△Ct。上下游引物序列见表1。

Tab. 1 Primer sequences of RT-PCR
1.9 统计学处理
2 结果
2.1 肌湿重比
0 d的模型组和推拿组腓肠肌肌肉饱满红润。随着失神经支配时间的延长两组术侧腓肠肌均呈进行性萎缩且色泽欠佳,肌湿重比逐渐下降,均显著低于0 d(P<0.01)。失神经7 d,湿重比下降明显,随后减缓,除0 d外,推拿组的肌湿重比均显著高于模型组(P<0.05,表2)。
2.2 形态学观察
HE染色光镜下0 d模型组和推拿组骨骼肌横切面可见肌细胞较大,形态规则,细胞核紧贴于肌纤维的胞膜边缘,细胞间隙较小;随着失神经支配时间的延长,模型组与推拿组肌细胞大小与0 d相比明显缩小,细胞大小不一,形态不规则;推拿组与模型组比较,推拿组(除0 d外)细胞间隙明显比模型组小,细胞大小较为均一(图1 ,见彩图页Ⅰ)。切片后统计肌纤维截面积和直径可知,0 d模型组和推拿组之间肌纤维截面积和直径无统计学差异(P> 0.05),7 d、14 d、21 d推拿组肌纤维横截面积均显著高于模型组(P<0.05,P<0.01,表3),7 d、14 d、21 d推拿组肌纤维直径均显著高于模型组(P<0.05,P<0.01,表4)。
2.3 miR-23a、Akt、MuRF1、MAFbx基因相对表达量
腓肠肌中MuRF1、MAFbx、Akt、miR-23a mRNA表达在0 d时模型组与推拿组之间差异无统计学意义(P>0.05);与0 d比较,随着失神经支配时间的延长,模型组和推拿组 MuRF1、MAFbx、Akt mRNA表达均呈现先升后降的趋势,在第7日时达到高峰,随后有所下降,21 d时模型组Akt mRNA表达接近0 d水平;其中7 d、21 d推拿组MuRF1 mRNA表达均显著低于模型组(P<0.05,P<0.01,表5),7 d、14 d、21 d推拿组MAFbx mRNA表达均显著低于模型组(P<0.01,P<0.05,P<0.01,表6),7 d、14 d、21 d推拿组Akt mRNA表达均显著高于模型组(P< 0.05,P<0.01,表7);与0 d比较,模型组和推拿组21 d(由于失神经支配早期,肌肉中miRNA表达不显著,故未选取7 d、14 d做检测)时miR-23a mRNA表达升高,推拿组miR-23a mRNA表达显著高于模型组(P<0.05,表8)。
3 讨论
中医传统认为,失神经导致的骨骼肌萎缩属于传统医学中的“痿症”范畴,推拿手法作为中国的传统疗法,是延缓失神经肌萎缩的一种有效治疗手段[11]。其通过手法对人体体表的刺激及产生热效应,从而加速气血的运行,起到疏通经络、行气活血的作用[12]。研究发现,推拿可以提高坐骨神经损伤大鼠的痛觉敏感程度,有效抑制所出现的神经源性疼痛;能够提高患侧腓肠肌的肌力及肌肉恢复率,从而促进坐骨神经损伤大鼠运动功能和感觉功能的恢复[13]。推拿还可以通过影响胰岛素样生长因子-I(insulin-like growth factor receptor I, IGF-I)、碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)、生肌决定因子(MyoD)的表达,改变骨骼肌微环境,间接促进肌卫星细胞增殖、分化,从而延缓骨骼肌的萎缩[14]。

Tab. 2 The wet weight ratio of the model groups and the massage groups for 0 d,7 d,14 d,21 d n =6 )
*P<0.05,**P<0.01vsmodel group;##P<0.01vs0 d model group;△△P<0.01vs0 d massage group

Tab. 3 Cross-sectional area of the model groups and the massage groups for 0 d,7 d,14 d,21 d (μm2, n=6)
*P<0.05,**P<0.01vsmodel group;##P<0.01vs0 d model group;△△P<0.01vs0 d massage group

Tab. 4 Diameter of the muscle fiber of the model groups and the massage groups for 0 d,7 d,14 d,21 d (μm, n=6)
*P<0.05,**P<0.01vsmodel group;##P<0.01vs0 d model group;△△P<0.01vs0 d massage group
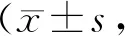
Tab. 5 The relative expression levels of MuRF1 in the gastrocnemius muscle of the model groups and the massage groups for 0 d,7 d,14 d,21 d n=6)
*P<0.05,**P<0.01vsmodel group;##P<0.01vs0 d model group;△△P<0.01vs0 d massage group
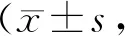
Tab. 6 The relative expression levels of MAFbx in the gastrocnemius muscle of the model groups and the massage groups for 0 d,7 d,14 d,21 d n=6)
*P<0.05,**P<0.01vsmodel group;##P<0.01vs0 d model group;△△P<0.01vs0 d massage group
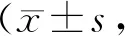
Tab. 7 The relative expression levels of Akt in the gastrocnemius muscle of the model groups and the massage groups for 0 d,7 d,14 d,21 d n=6)
*P<0.05,**P<0.01vsmodel group;##P<0.01vs0 d model group;△△P<0.01vs0 d massage group
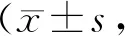

Group0 d7 dModel1.029±0.2571.850±0.829#Massage1.038±0.2892.770±0.698*△△
*P<0.05vsmodel group;#P<0.05vs0 d model group;△△P<0.01vs0 d massage group
骨骼肌一旦失神经支配后,肌肉收缩功能就会丧失,血液淤积于静脉系统内,有毒代谢产物增多,泛素蛋白酶体系统被启动,导致MAFbx、MuRF1的上调,从而引起肌肉蛋白降解[15-17],当蛋白降解大于合成,肌萎缩发生。研究发现[18-19],去神经支配、糖皮质激素、禁食、糖尿病和癌症引起肌肉萎缩时, 都能诱导MuRF1 和MAFbx的表达。敲除小鼠骨骼肌中MAFbx或MuRF1可以减轻由失神经支配诱导的骨骼肌萎缩程度,抑制肌肉重量的下降。这两种基因对加速肌肉蛋白质丢失以及通过蛋白质分解调节肌肉的大小至关重要。Sacheck[20]等研究表明, 在失神经早期,MAFbx、MuRF1 mRNA被大量诱导,且都出现在肌肉质量显著下降之前;王鹏飞[21]等在实验中发现,MAFbx的表达也在失神经早期迅速升高,2周之后开始下降,与骨骼肌湿重下降速率相平行,表明二者的基因表达与骨骼肌萎缩关系密切。Akt通过促进FoxO的磷酸化使其失活,阻止FoxO依赖性萎缩相关基因MAFbx和MuRF1的表达来抑制骨骼肌中蛋白质的降解[8、22-23]。研究发现,转基因鼠中肌肉特异性过表达Akt会抑制蛋白质降解,促使肌肉肥大且肌肉力量增加[24],而当Akt活性受到抑制时,下游的FoxO、MuRF1、MAFbx表达上升导致蛋白降解增加,骨骼肌萎缩[25]。本实验结果表明,骨骼肌失神经支配过程中,Akt mRNA表达量呈现先升后降的趋势,失神经支配7 d时,MuRF1、MAFbx mRNA表达量显著升高,随后有所下降,其表达趋势与文献报道相一致;与模型组比较,推拿干预后Akt mRNA表达水平显著升高,MuRF1、MAFbx mRNA表达水平显著降低,提示推拿手法可能通过抑制大鼠术侧腓肠肌中蛋白降解速率来延缓失神经肌萎缩。
目前,对骨骼肌中的 miRNA是miR-1、miR-133 和 miR-206研究相对较多,它们对控制骨骼肌细胞的增殖和分化具有重要作用[26-27],而对miR-23a研究相对较少。研究发现[28],在失神经支配肌肉中的miRNA诱导会出现延迟,失神经支配后3 d是肌肉尚未萎缩的时间,其特征在于萎缩相关基因诱导的高峰,而miRNA主要受抑制。在失神经支配7 d之后,肌肉已经萎缩并且诱导miRNA参与萎缩程序的微调。Ching-Hua Hsieh[29]等人在失神经支配4个月的大鼠比目鱼肌中发现大量miRNA普遍上调和大量转录产物的差异性下调,其中miR-23a呈现高表达。Shogo Wada[10]等人通过生物信息学的方法鉴定MAFbx和MuRF1是miR-23a潜在的靶标,并在实验中证明,miR-23a与MAFbx、 MuRF1的 3’-UTRs相互作用以抑制其翻译,从而抵抗肌肉的萎缩。本实验结果显示,失神经21 d时推拿组miR-23a mRNA表达量高于模型组,由于miR-23a可以对MuRF1、MAFbx的转录进行微调节,说明推拿可能通过促进miR-23a mRNA的表达,在一定程度上可以减少蛋白质的降解,从而延缓失神经肌萎缩。
综上所述,骨骼肌失神经支配后,MuRF1、MAFbx mRNA表达的增加会加速骨骼肌蛋白的降解,加剧肌肉萎缩的进程,推拿可通过上调miR-23a、Akt mRNA的表达,来抑制MuRF1、MAFbx mRNA的表达,减少骨骼肌蛋白的降解,这可能是推拿能有效延缓失神经骨骼肌萎缩的机制之一,其可为临床治疗提供理论依据,进而推广使用这一优秀传统疗法。
