消痰化瘀利窍方对慢性间歇性低氧大鼠肠系膜动脉损伤的改善作用*
2019-07-03于富洋杨胜昌郭亚净赵亚硕刘思文吉恩生
于富洋, 杨胜昌, 郭亚净, 赵亚硕, 刘思文, 吉恩生
(河北中医学院, 石家庄 050200)
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)表现为睡眠期间的反复发作的咽部阻塞,慢性间歇性低氧(chronic intermittent hypoxia,CIH)是其典型的病理生理特征[1, 2]。流行病学研究发现,OSA可以增加高血压、动脉粥样硬化、心肌缺血、脑卒中等疾病的患病风险[3-5]。包括肠系膜动脉在内的机体微血管对组织器官的血流供应及血压的维持具有至关重要的作用,微血管结构功能障碍是心脑血管疾病发生发展的病变基础,而CIH对微血管系统的影响尚不完全明确[6, 7]。CIH可以直接或间接的损伤血管内皮细胞,引起内皮细胞障碍[8]。这被认为是CIH诱导的一系列心脑血管疾病的重要致病因素,其机制主要与内皮细胞分泌的一氧化氮(nitric oxide,NO)生物利用度降低有关。本课题组先前的动物实验表明,35 d的CIH暴露可以引起大鼠主动脉内皮细胞损伤,舒张功能减弱[9]。临床研究中,OSA患者也表现出显著降低的乙酰胆碱及缓激肽诱导的血管舒张反应[10, 11]。本研究旨在观察CIH对大鼠肠系膜动脉结构功能的损伤并探究其可能的机制。
目前关于OSA患者的治疗方法主要有持续正压通气、口腔矫治器、手术治疗及并发症的针对治疗等,但都存在治疗反复及依从性差的问题。消痰化瘀利窍方是根据多年临床经验总结的经验方,能够有效改善OSA患者症状及并发症的发生发展。本研究通过建立CIH大鼠模型,探讨消痰化瘀利窍方对CIH诱导大鼠肠系膜动脉功能损伤的保护作用,为传统医学对OSA及其并发症的临床治疗提供进一步的实验依据。
1 材料与方法
1.1 实验动物、分组及处理
48只雄性SD大鼠,购自北京维通利华实验动物技术有限公司,体重(240±20)g,随机平均分成四组:常氧对照组(Normoxia),慢性间歇性低氧组(CIH)、慢性间歇性低氧中药干预组(Formula+CIH)、中药对照组(Formula)。
大鼠正常适应一周后,开始造模。在动物正常休息的白天进行造模,将CIH及Formula+CIH组暴露于动物慢性间歇性低氧装置,前1.5 min向舱内充入100%氮气使O2浓度降至9%,后1.5 min充入医用氧(>99.5%)使O2浓度升至21%,每一循环3 min,每天8:00 am~4:00 pm上舱8 h,共21 d。Normoxia及Formula组大鼠置于低氧舱内,但向舱内充入空气。同时,每天上舱前Formula+CIH与Formula组给予消痰化瘀利窍方灌胃(生药量24 g/kg,以中药药理研究方法学的大鼠与人药物剂量折算方法折算临床剂量),CIH与Normoxia组灌服同等体积生理盐水,直至造模结束。
1.2 主要试剂与仪器
消痰化瘀利窍方由丹参30 g,法半夏12 g,陈皮10 g,茯苓15 g,生黄芪15 g,炒白术12 g,石菖蒲12 g,郁金12 g,射干12 g,白芥子10 g,桔梗12 g,枳壳15 g,川芎12 g,赤芍15 g,地龙12 g组成,中药材购自于神威药业集团有限公司,以水煮醇沉法制备,制成含生药2.4 g/ml制剂,;苯肾上腺素(phenylephrine,PE)、乙酰胆碱(acetylcholine, ACh)、L-精氨酸(L-arginine, L-Arg)均购自Sigma;动物间歇性低氧装置(Oxycycler Model A84BioSpherix);DMT微血管张力测定装置( Danish Myo Technology A/S)、PowerLab数据采集分析系统。
1.3 肠系膜动脉舒张功能测定
各组大鼠用25%乌拉坦5 ml/kg腹腔注射麻醉,随后腹部切口,暴露并分离肠系膜二级动脉。截断动脉后,立即放入提前充氧预冷(4℃)的K-H液(mmol/L,NaCl 118.3, NaHCO325, KCl 4.7, KH2PO41.2, MgSO41.2, glucose 11.1,CaCl21.8)中。在体式显微镜下,将动脉截成约2 mm的血管环并用金属丝穿过,固定于充满K-H液的恒温浴槽中,充入95%O2和5%CO2的混合气,平衡45 min。
血管环进行标准化,调至最适前负荷,并用高钾溶液(mmol/L,NaCl 52.5, KCl 44.7, MgCl21.2, CaCl22.8, Glucose 20, HEPES 11.9, pH=7.40)激活血管环以检查其活性。PE(10-5mol/L)预收缩,再用Ach(10-5mol/L)舒张血管检查内皮完整性,认定舒张大于75%的血管环为内皮完整[12]。
在给予PE(10-5mol/L)预收缩后,分别累积加入终浓度为10-8mol/L、3×10-8mol/L、10-7mol/L、3×10-7mol/L、10-6mol/L、3×10-6mol/L、10-5mol/L的ACh及L-Arg,绘制量效曲线,观察舒张变化。
1.4 血清中NO水平测定
各组大鼠在造模前1 d与造模第21日,乙醚麻醉,目内眦取血。样本室温静置30 min后离心 (4 500 r/min,15 min,4℃),取上清,-80℃冰箱保存并按试剂盒说明书采用硝酸还原酶法测定NO含量。
1.5 组织病理学观察
分离肠系膜二级动脉并用4%多聚甲醛固定,脱水、石蜡包埋、切片,进行HE染色,光镜下观察组织病理学变化。
1.6 Western blot检测eNOS、p-eNOS的表达
取肠系膜动脉,按100 mg/ml加入蛋白裂解液,超声破碎后,离心(12 000 r/min,15 min,4℃)取上清,BCA测定蛋白浓度。50 μg蛋白加入2.5 μl的sample buffer,振荡均匀,100℃水浴5 min变形, -80℃保存待用。电泳(80 V,40 min;160 V,90 min)结束后,进行湿转(300 mA,90 min)。按Maker裁剪相应目的蛋白的条带,5%脱脂牛奶封闭90 min,TBST清洗三次,加入一抗(1∶1 000)4℃孵育过夜。次日,TBST清洗三次,加入相应二抗(1∶5 000)孵育90 min。TBST清洗三次后,应用ECL发光显色并拍照。采用Quantity One分析软件进行灰度分析,以p-eNOS/eNOS灰度值表示eNOS磷酸化水平。
1.7 统计学处理
2 结果
2.1 消痰化瘀利窍方对CIH大鼠肠系膜动脉组织病理学的影响
HE染色结果显示,Normoxia组大鼠的肠系膜动脉内皮细胞排列整齐,形状规则。与Normoxia组相比,CIH组肠系膜动脉内皮细胞水肿、脱落,中膜明显增厚。消痰化瘀利窍方干预能明显改善内皮细胞的病理改变及中膜增厚(图1)。与Normoxia组相比,单独给予消痰化瘀利窍方未引起大鼠肠系膜动脉明显的组织病理学的变化。
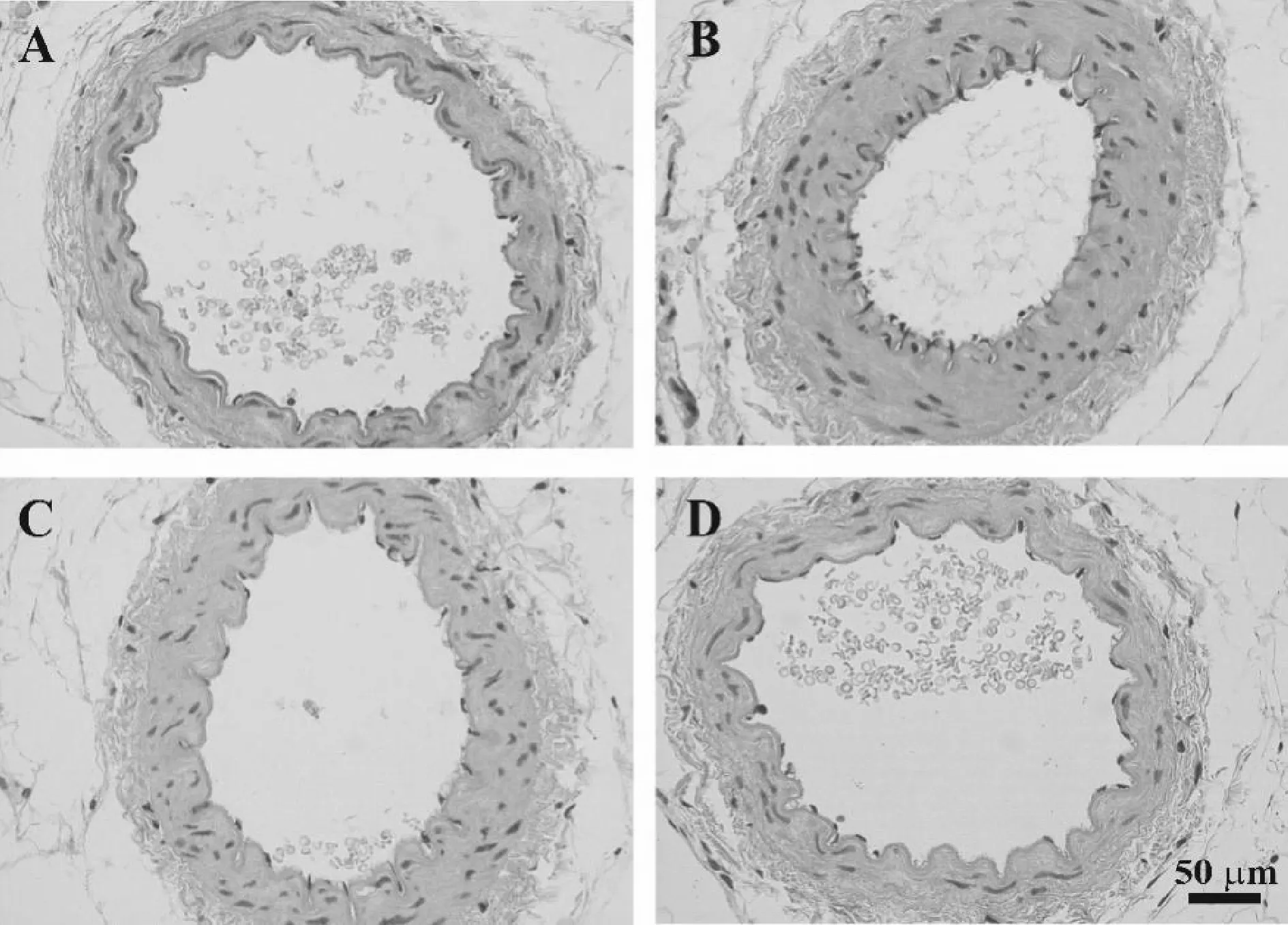
Fig.1CIH-induced pathological examination of mesenteric artery was detected by HE staining(×400)
A: Normoxia group; B: CIH group; C: Formula+CIH group; D: Formula group
2.2 消痰化瘀利窍方对Ach与L-Arg诱导的CIH大鼠肠系膜动脉舒张功能的影响
在10-5mol/L的PE诱发最大收缩程度后,分别按浓度梯度依次加入Ach、L-Arg,诱导出各组的最大舒张反应(表1)。与Normoxia组相比,CIH组大鼠肠系膜动脉舒张功能明显受损。与CIH组相比,消痰化瘀利窍方干预组大鼠的肠系膜动脉舒张功能得到改善。Formula组与Normoxia组比较,肠系膜舒张功能未表现出显著差异(图2)。
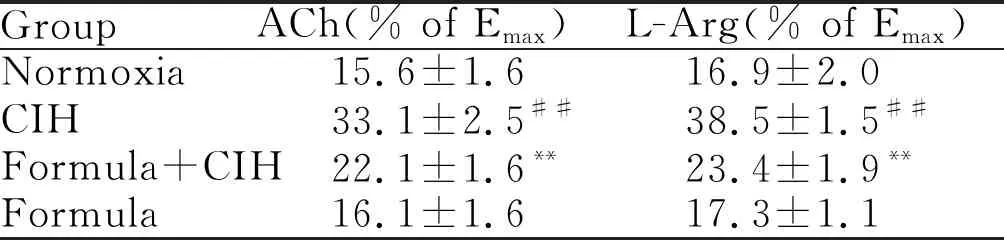
GroupACh(% of Emax)L-Arg(% of Emax)Normoxia15.6±1.616.9±2.0CIH33.1±2.5##38.5±1.5##Formula+CIH22.1±1.6**23.4±1.9**Formula16.1±1.617.3±1.1
Ach: Acetylcholine ; L-Arg: L-arginine;
Emax: Maximum responses
**P<0.01vsNormaxia group;##P<0.01vsCIH group

Fig.2Effect of Xiaotan Huayu Liqiao formula on relaxation of mesenteric arteryinduced by ACh and L-Arg in the rats exposed to CIH
*P<0.05,**P<0.01vsNormaxia group;#P<0.05,##P<0.01vsCIH group
2.3 消痰化瘀利窍方对血清中NO水平的影响
各组大鼠血清中NO水平按ΔNO(CIH暴露:21 d~0 d)做统计学比较显示,与Normoxia组相比,CIH组大鼠21 d血清NO的水平显著降低(P< 0.01)。消痰化瘀利窍方干预能够明显提高CIH引起的血清NO水平的下降,差异具有统计学意义(P<0.01,表2)。单独给予消痰化瘀利窍方大鼠血清中NO水平与Normoxia组没有表现出显著差异。
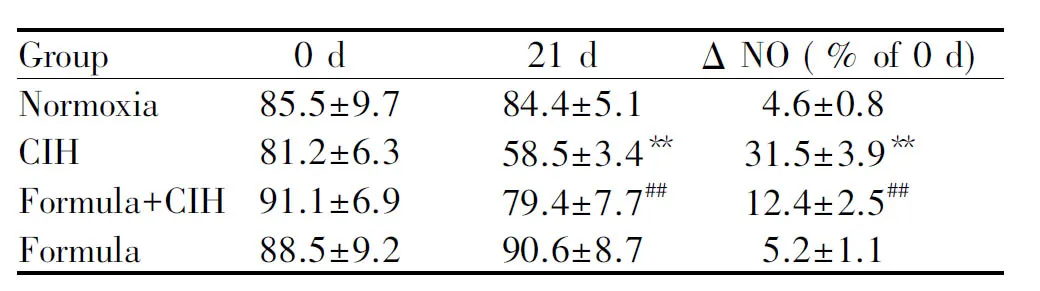
**P<0.01vsnormaxia group;##P<0.01vsCIH group
2.4 消痰化瘀利窍方对CIH大鼠肠系膜动脉eNOS磷酸化水平的影响
本研究以Western blot法测定各组eNOS、p-eNOS表达水平(图3),以p-eNOS/eNOS比值反映大鼠肠系膜动脉eNOS的磷酸化水平,Normoxia组p-eNOS/eNOS比值为(98.5±9.1)%。与Normoxia组相比,CIH组大鼠p-eNOS/eNOS比值显著降低为(60.5±5.5)%(P<0.01)。Formula+CIH组与CIH组大鼠相比,p-eNOS/eNOS比值明显升高为(86.8±9.6)%,差异具有统计学意义(P<0.01)。与Normoxia组相比,Formula组p-eNOS/eNOS比值无明显差异为(112.5±10.4)%。

Fig.3Effects of Xiaotan Huayu Liqiao formula on the ratio of p-eNOS/eNOS in mesenteric artery of rats
p-eNOS: Phosphorylated endothelial NO synthase; eNOS: Endothelial NO synthase
3 讨论
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)引起的慢性间歇性低氧(chronic intermittent hypoxia,CIH)被认为是高血压、动脉粥样硬化等心脑血管疾病的独立危险因素[4, 13],其致病因素与内皮功能障碍及血管重构密切相关[14]。研究证明,CIH可以直接损伤内皮细胞,引起血管舒张、收缩因子分泌紊乱,导致内皮功能障碍[15]。Saletu等发现,OSA患者表现出显著增加的颈动脉内膜与中膜厚度,且与疾病严重程度相关[16]。动物实验也显示,21 d的CIH暴露引起大鼠主动脉及冠状动脉内皮细胞明显的病理学损伤及中膜增厚[17, 18]。肠系膜动脉的分支属于微血管系统,对机体血压的维持与组织器官的血流供应具有至关重要的作用[7]。本研究通过建立CIH大鼠模型并观察其肠系膜动脉形态学及功能的改变,发现CIH引起大鼠肠系膜动脉内皮细胞的水肿、脱落以及平滑肌明显增厚,显著降低肠系膜动脉的舒张能力。微血管的损伤应属中医中的瘀血范畴。杨玉萍等认为气滞血瘀是OSA合并心脑血管疾病的关键病因病机,瘀血既为病理因素,也是致病因素[19]。消痰化瘀利窍方是多年临床经验总结而成的经验方,具有活血化瘀、豁痰通窍的功效。对于改善间歇性低氧引起的微血管的瘀血证可谓恰合病机。本研究结果表明,消痰化瘀利窍方能够显著改善CIH引起的大鼠肠系膜动脉内皮损伤、平滑肌细胞增殖以及降低的肠系膜动脉舒张能力,且单独应用消痰化瘀利窍方对常氧大鼠未产生明显影响。
NO作为最主要的内皮舒张因子通过调节血管张力与内皮功能在心脑血管系统中发挥重要作用[20]。内皮型一氧化氮合酶(endothelial NO synthase, eNOS)是内皮细胞中主要表达的NO同工酶,通过磷酸化调节NO的生成释放[21]。慢性低氧可使eNOS脱偶联减少NO的产生而降低NO的生物利用度,导致肺血管舒张功能障碍及平滑肌细胞增殖[22]。OSA引起的内皮功能障碍也与eNOS的活化水平密切相关[23]。本实验室早期研究发现CIH暴露显著降低大鼠血清中NO水平及Ach诱导的主动脉舒张反应[9]。Hong等的细胞实验表明,CIH暴露能够使人脐静脉内皮细胞eNOS的磷酸化水平显著降低[24]。Manuel等在CIH暴露14 d的大鼠门静脉中也观察到eNOS活性的降低[25]。本研究结果显示,消痰化瘀利窍方能够显著提高CIH大鼠肠系膜动脉对Ach诱导的舒张反应的损伤,提高血清NO含量,上调eNOS磷酸化水平。以上提示,消痰化瘀利窍方可以通过促进eNOS活化从而提高NO水平来改善肠系膜动脉的内皮功能障碍。
NO的底物L-精氨酸(L-arginine, L-Arg)可以在NOS的介导下生成NO,而精氨酸酶(L-arginase)能够将L-Arg水解为鸟氨酸与尿素,是内皮细胞中L-Arg的主要消耗途径[26, 27]。有研究提出,L-arginase水平的改变也参与到血管内皮功能障碍的形成当中。临床和动物实验结果表明,急性抑制L-arginase可以提高离体血管环NO依赖的舒张反应[28, 29]。Krause等的研究发现,CIH暴露21 d上调大鼠颈外动脉Arginase-1的表达[14]。本研究显示,消痰化瘀利窍方干预能改善CIH引起的大鼠肠系膜动脉L-Arg诱导的舒张反应下降,提示其改善肠系膜动脉内皮功能障碍的机制可能与降低L-arginase水平有关。
综上所述,本研究结果表明CIH能够损伤大鼠肠系膜动脉内皮细胞,引起舒张功能障碍,进而导致可能的心脑血管损伤。消痰化瘀利窍方可以通过激活肠系膜动脉eNOS,降低L-arginase水平,从而提高NO生物利用率,有效改善肠系膜动脉结构功能的损伤,为OSA诱导的心脑血管并发症的中医药防治提供新的思路与实验依据。
