缺氧诱导因子-1α与血管内皮生长因子及其受体2在大鼠3期压力性损伤皮肤组织中的表达及意义*
2019-07-03王晓慧陈孝萍王红萍潘莹莹姜丽萍
王晓慧, 陈孝萍, 王红萍, 潘莹莹, 姜丽萍△
(1. 上海交通大学医学院附属新华医院, 上海 200092; 2. 温州医科大学护理学院, 浙江 温州 325000)
压力性损伤(pressure injury,PI)是临床长期卧床、脊髓损伤等患者常见并发症,3期压力性损伤是其中一个重要分期,主要表现为全层皮肤缺损,常可见皮下脂肪组织、肉芽组织和伤口边缘内卷;无筋膜,肌肉,肌腱,韧带,软骨和骨头暴露;可有腐肉和或焦痂[1]。当前临床上针对3期PI仍缺乏有效的治疗手段,究其原因主要由于其形成机制尚未完全明确。目前认为,PI发生的本质是局部组织长期受压,引起局部组织缺血缺氧、血液循环障碍,最终导致组织坏死。因此,微循环障碍在PI发生、发展中具有重要作用,而促进局部组织血管再生是促进PI愈合的一种重要思路。作为一种核转录因子,缺氧诱导因子-1α( hypoxia inducible factor 1α,HIF-1α)可通过调控下游多种靶基因参与机体血管生成、细胞增殖和迁移、细胞凋亡等病理生理过程,在创面愈合过程中具有重要意义。HIF-1α-VEGF-KDR是一条调控局部组织血管再生的经典信号通路,但目前大部分研究主要关注其在糖尿病溃疡、下肢静脉溃疡等慢性难愈性创面中的作用[2-4],针对HIF-1α及下游靶基因在3期PI皮肤组织中的表达及促修复作用尚未见报道。因此,本实验通过分析HIF-1α、VEGF与KDR在大鼠局部受压皮肤组织中的表达,阐明缺氧和血管生成在3期PI形成中的作用及相互关系,初步探讨3期PI的难愈机制。
1 材料与方法
1.1 材料
40只清洁级成年雄性SD大鼠体重300~350 g,由上海斯莱克实验动物有限公司提供,许可证号:SOXK(沪)2007-0005。兔源性HIF-1α多克隆一抗购自NOVUS公司,鼠源性KDR单克隆一抗购自abcam公司,鼠源性VEGF多克隆一抗、鼠源性单克隆Actin一抗均购自Santa Cruz公司,山羊抗兔辣根过氧化物酶(HRP)二抗,山羊抗鼠-HRP二抗均购自美国Bioworld公司。Eclipse 80i型光学显微镜购自日本尼康公司,ChemiDoc XRS型凝胶成像仪、Mini-PROTEAN型电泳仪均购自美国Bio-Rad公司,F6/10型电动匀浆器购自德国FLUKO公司。
1.2 动物分组及处理
大鼠室温分笼饲养,自由饮水进食,实验前适应性喂养1周。将大鼠按随机数字表法分为正常对照组、受压3 d组、受压5 d组、受压7 d组、受压9 d组,每组8只。正常对照组大鼠不做任何处理,后4组大鼠参照文献[5]的方法,应用缺血/再灌注磁片循环压迫的方式,在大鼠两侧后肢股薄肌处建立深部组织损伤模型(受压3 d组)和压力性损伤模型(另3组),以体现3期压力性损伤形成及发展的过程。实验中选择表面磁通量为1.758×10-5wb的永久性圆片形磁铁,直径8 mm,厚度4 mm,质量2.4 g,购于浙江省东磁研究所。在压力检测显示(5.0 ±2.0)mm厚度的条件下,肌肉所受到的压强约40 kpa。受压3 d组大鼠仅受压3个循环(受压12 h、放松12 h为1个循环,每天实施1个循环);受压5 d组、受压7 d组、受压9 d组大鼠在受压3个循环后,使用无菌刀片,统一划破受压皮肤,深度至真皮层,后继续分别施压至5、7、9个循环。
1.3 标本采集
受压3 d组大鼠于受压3 d后(正常对照组大鼠于相同时间点),另3组大鼠分别于受压5、7、9 d后,腹腔注射100 g/L水合氯醛(300 mg/kg)麻醉。置于冰上迅速切取双侧股薄肌中心部位处的全层皮肤组织,大小为0.5 cm×0.5 cm。生理盐水洗净血液,40 g/L多聚甲醛固定、脱水,常规石蜡包埋、切片(厚度为0.5 μm)。另同前切取部分皮肤组织约1 g,生理盐水洗净血液,滤纸吸干水分并剪碎,于 -80℃冰箱中保存备用。取材完毕后腹腔注射过量100 g/L水合氯醛处死大鼠。
1.4 皮肤组织形态学观察
取大鼠皮肤组织石蜡切片,常规HE染色,200倍光学显微镜下观察皮肤组织形态学变化。
1.5 VEGF蛋白表达
采用免疫组织化学法检测。另取各组大鼠皮肤组织切片,常规脱蜡脱水,加入体积分数3%过氧化氢-甲醇溶液抑制内源性过氧化物酶,室温放置30 min。10 g/L牛血清白蛋白室温封闭30 min,滴加鼠源性VEGF多克隆一抗,湿盒4℃过夜。滴加山羊抗鼠-HRP二抗,湿盒37℃孵育2 h,PBS冲洗3次,每次5 min,二氨基联苯胺显色,苏木素复染,中性树胶封片。200倍光学显微镜下观察VEGF蛋白表达 (棕黄色)。采用Image.Pro Plus 6.0图像分析软件(美国Media Cy-bernetics公司)分析每平方毫米组织中的VEGF阳性蛋白表达量(以灰度值表示)。
1.6 HIF-1α、VEGF、KDR蛋白表达
采用蛋白质印迹法检测,以Actin作为内参照。将冻存的各组大鼠皮肤组织剪碎,加裂解液匀浆后,离心取上清液,应用考马斯亮蓝法测定提取的蛋白浓度。通过聚丙烯酰胺凝胶电泳分离蛋白后转印至聚偏二氟乙烯膜上。50 g/L脱脂奶粉室温封闭1 h,加入兔源性HIF-1α多克隆一抗、鼠源性VEGF多克隆一抗、鼠源性KDR单克隆一抗、鼠源性单克隆Actin一抗4℃过夜。洗涤后加入山羊抗兔-HRP二抗、山羊抗鼠-HRP二抗,室温孵育2 h。化学发光、显影,凝胶图像分析系统行灰度扫描分析,结果以HIF-1α与Actin灰度值、VEGF与Actin、KDR与Actin的比值表示。
1.7 统计学处理
2 结果
2.1 皮肤组织形态
正常对照组大鼠皮肤为复层鳞状上皮,皮肤结构清晰,血管数量丰富,胶原纤维排列整齐,无明显炎性细胞浸润;受压3 d组上皮层次清晰,血管数量较正常对照组减少,胶原纤维排列有序,炎症细胞开始浸润;受压5 d组大鼠上皮层次较清晰,血管数量较受压3 d组减少,胶原纤维排列紊乱,炎性细胞浸润增强;受压7 d组上皮增厚,血管数量较受压5 d组减少,胶原纤维排列紊乱,炎性细胞大量浸润;受压9 d组上皮厚度明显增加,血管数量少,胶原纤维排列紊乱,炎性细胞浸润明显(图1)。上述结果表明,皮肤组织损伤造模成功。
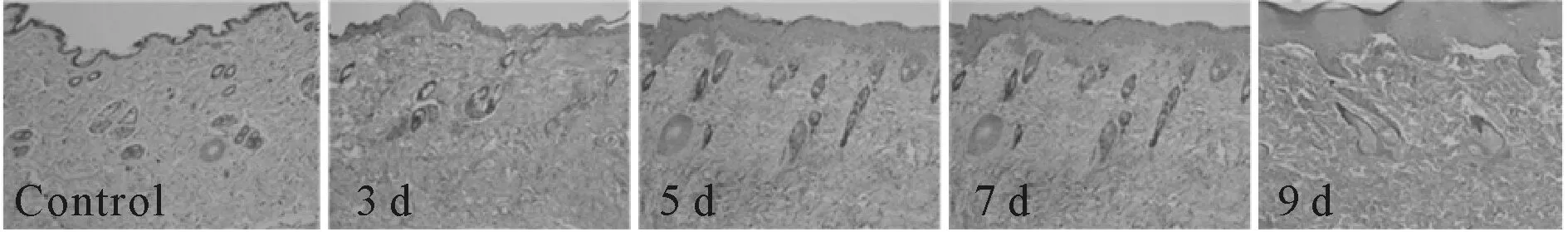
Fig.1Skin tissue morphology of the gracilis in each group of rats (HE ×200)
2.2 免疫组化检测VEGF蛋白表达
正常对照组、受压3 d组、受压5 d组、受压7 d组、受压9 d组大鼠皮肤组织中VEGF蛋白表达量分别为4.27±0.14、5.72±0.15、4.21±0.13、4.01±0.04、3.93±0.07。受压3 d组大鼠皮肤组织中VEGF蛋白表达较正常对照组明显增高(P<0.01),随着受压时间延长,VEGF蛋白表达逐渐减少,受压5 d组、受压7 d组和受压9 d组大鼠皮肤组织中VEGF蛋白表达量均明显低于正常对照组(P< 0.05)。
2.3 Western blot 检测HIF-1α蛋白表达
受压3 d组大鼠皮肤组织中HIF-1α蛋白表达量明显高于正常对照组(P<0.01),受压5 d组皮肤组织HIF-1α蛋白表达量较正常对照组明显增高(P<0.05),受压7 d组皮肤组织HIF-1α蛋白表达量较正常对照组增高(P>0.05),受压9 d组皮肤组织HIF-1α蛋白表达量与正常对照组相近,差异无统计学意义(P>0.05,图3,表1)。
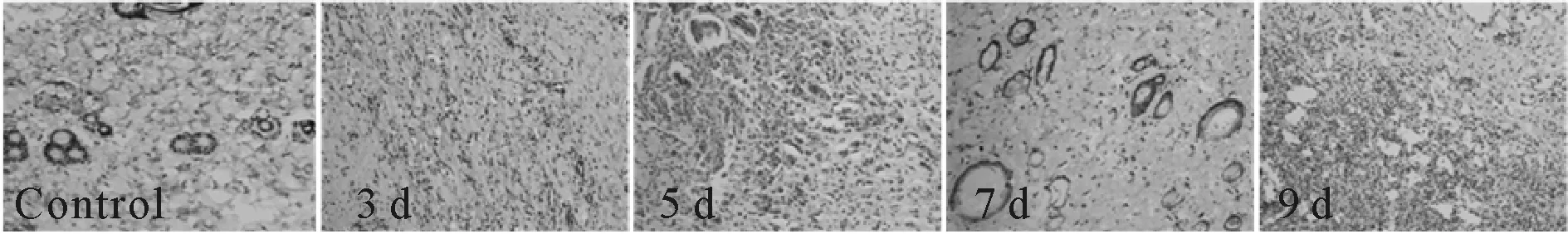
Fig.2Immunohistochemistry was used to detect the expression of vascular endothelial growth factor protein (VEGF) in the skin tissue of the gracilis of rats in each group (Diaminobenzidine-hematoxylin ×200)
2.4 Western blot 检测VEGF蛋白表达
受压3 d组大鼠皮肤组织中VEGF蛋白表达量较正常对照组明显增高(P<0.01);受压5 d组、受压7 d组大鼠皮肤组织中VEGF蛋白表达量与正常对照组相近,差异无统计学意义(P>0.05),受压9 d组大鼠皮肤组织中VEGF蛋白表达量低于正常对照组(P<0.05,图3,表1)。
2.5 Western blot 检测KDR蛋白表达
受压3 d组大鼠皮肤组织中KDR蛋白表达量较正常对照组明显降低(P<0.05);受压5 d组、受压7 d组和受压9 d组大鼠皮肤组织KDR蛋白表达量明显均低于正常对照组(P均<0.01,图3,表1)。

Fig.3The expressions of KDR, VEGF and HIF-1α in the gracilis in each group of rats were detected by Western blot
1: Normal control group; 2: 3 d group; 3: 5 d group; 4: 7 d group; 5: 9 d group

Group HIF-1α VEGF KDRControl0.92±0.131.23±0.161.86±1.483 d1.71±0.18** 1.68±0.16**1.33±1.09*5 d1.22±0.18*1.18±0.141.05±0.72**7 d1.12±0.071.02±0.050.79±0.28**9 d0.91±0.180.93±0.09*0.54±0.71**
HIF-1α: Hypoxia-inducible factor-1α; VEGF: Vascular endothelial growth factor; KDR: Kinase insert domain receptor
*P<0.05,**P<0.01vscontrol group
3 讨论
3期压力性损伤主要特点是形成开放性创面,病程长,愈合慢,且极易恶化,严重影响患者生活质量。研究表明[6],局部组织微循环障碍是导致创面愈合减慢的重要原因之一。HIF-1α是诱导细胞对低氧适应的重要转录因子,也是参与血管生成的重要调控因子。因此,分析HIF-1α、VEGF和KDR等血管生成调节因子在大鼠局部受压皮肤组织中的表达及变化,可为3期压力性损伤形成机制研究奠定坚实基础。
血管是组织细胞氧气和营养物质重要来源,局部组织缺血导致微环境中氧气和营养物质缺乏被认为是创面愈合减慢的重要原因[7]。血管内皮生长因子(vascular endothelial growth factor, VEGF)为一种可通过刺激血管内皮增殖和迁移,改变血管通透性,促进血管生成的重要调节因子,是血管生成的重要标记物[7]。本研究HE染色结果显示,随着受压时间延长,组织损伤程度逐渐加重,大鼠局部受压皮肤组织出现逐步退化病理现象,表现为表皮不断增厚,血管数量不断减少,和黄芳[8]等研究结果一致。组织形态学变化说明在相同压力下,组织损伤程度主要与受压时间密切相关。免疫组化结果显示,VEGF在受压3 d组表达增加,随着受压时间延长,表达逐渐降低,血管数量变化趋势和HE染色结果一致,提示及时解除压力及促进血管再生改善组织微循环是防止局部组织损伤进一步恶化的重要举措。
HIF-1α是参与缺氧应答反应的关键转录因子,也是缺氧环境下血管生成的核心调控因子,参与缺氧受损组织中血管生成的整个过程。研究显示[9],在正常有氧环境下,HIF-1α因降解增加和转录抑制处于低浓度状态;当组织细胞缺氧时,HIF-1α通过各种缺氧应答基因的刺激迅速激活并呈高度表达状态。Milad和Chang研究发现[2,10],在老年人缺血性伤口和糖尿病溃疡中,HIF-1α表达极少,引起新生血管数量减少,是导致伤口愈合减慢的重要原因。而目前国内关于HIF-1α在压力性损伤创面形成过程中表达变化的研究鲜有报道。本实验WB结果显示,正常对照组HIF-1α蛋白表达较少,受压3 d组蛋白表达明显增加,说明在外源性压力的作用下,局部组织出现缺血缺氧,局部低氧刺激HIF-1α蛋白表达,与冯帅南[11]和LIU[12]等研究结果一致。从受压5 d起,各组大鼠皮肤组织HIF-1α蛋白表达开始减少,且随受压时间延长,组织损伤程度越来越严重,而HIF-1α表达水平逐渐下降,提示HIF-1α蛋白表达减少可能是引起Ⅲ期压疮愈合减慢的重要因素之一。研究表明[13],在糖尿病伤口中,高血糖产生的糖基化产物可能是抑制HIF-1α表达的重要因素之一。而在3期压力性损伤中HIF-1α蛋白表达减少的机制目前尚不清楚,有待于进一步探讨。
VEGF是一种高度特异性的促血管内皮细胞生长因子,KDR是VEGF主要功能受体,两者结合后可上调环氧化酶和NO表达,加强内皮祖细胞向缺血部位迁移,促进内皮细胞的分裂、增殖,增加微血管通透性,促进血管再生[14]。
目前已知,VEGF的表达受多种因素的调控,缺氧、癌基因、细胞因子和炎症因子、硫酸肝素等均对其具有重要调节作用[15]。在长期受压引起的压力性损伤中,缺血缺氧是一种常见的状态[16]。研究表明[3],VEGF和KDR是HIF-1α下游重要的靶基因,在缺氧条件下HIF-1α可通过作用于VEGF和KDR编码基因调控区的缺氧反应元件结合位点,增加VEGF和KDR mRNA表达并增强mRNA稳定性。李庆勇[17]在颅脑损伤动物研究中发现,HIF-1α可诱导脑创伤后VEGF蛋白表达,使用HIF-1α特异性抑制剂2-ME-2 进行干预后,VEGF表达明显下降。本实验中,VEGF和HIF-1α表达趋势一致,受压3 d组VEGF表达较正常对照组表达增加,说明机体在早期局部低氧的刺激下启动自身保护机制,HIF-1α高表达后通过上调下游VEGF表达促进血管新生,诱导局部组织对低氧的适应,防止组织损伤进一步恶化。从受压5 d开始,随着受压时间延长,HIF-1α表达降低,相应引起下游VEGF和KDR蛋白含量逐渐下降,表明持续性压力引起局部组织缺血缺氧已超过机体自身代偿机制,低氧诱导的新生血管已不能满足组织自身修复的需要,对机体造成不可逆性损伤。本实验中,免疫组化显示VEGF蛋白表达部位,说明局部损伤皮肤组织血管调控蛋白的变化,其表达趋势和WB一致,同时使用两种方法论证3期PI形成、发展过程中VEGF的表达变化。
此外,本实验中KDR表达趋势与HIF-1α不完全一致,提示KDR表达不全受HIF-1α调控,可能还存在别的影响因素。研究显示[18],VEGF和受体完全结合后,才能发挥相应生物学效应。受压3 d时,组织形态学结果显示局部组织血管数量并未随HIF-1α和VEGF表达增高而增加,笔者推测可能与KDR蛋白低表达有关,受体数量减少限制VEGF促血管生成作用发挥。
综上所述,本实验初步验证血管生成相关调节因子HIF-1α、VEGF和KDR在3期压力性损伤形成中的作用,HIF-1α介导的VEGF和KDR蛋白表达减少引起组织血管生成减少,可能是3期压力性损伤愈合减慢的重要原因。从HIF-1α角度进行干预,可能是3期压力性损伤治疗的新靶点和新策略。此外,3期压力性损伤病因复杂,课题组接下去将以HIF-1α为切入点进一步深入探讨3期PI形成的具体机制,以期为临床上PI治疗靶点寻找提供更加有力的依据。
