多肽药物关键水解酶体外高通量分析方法的建立
2019-07-03姚文兵
张 凡,田 浤,姚文兵
(中国药科大学生命科学与技术学院 江苏省生物药物成药性研究重点实验室,南京 210009)
近年来,多肽药物受到广泛关注,在抗肿瘤、抗感染、糖尿病治疗等领域发挥着越来越重要的作用[1-2]。但是,多肽药物稳定性差、半衰期短、在体内易受到蛋白酶水解等缺点限制了其生物学活性的发挥,因而导致许多具有生物活性的多肽分子不能作为药物应用于临床[3-4]。
多肽药物的体内代谢途径包括蛋白酶水解、受体介导胞吞作用和肾小球滤过作用[5-6]。其中蛋白酶水解不仅是影响多肽药物半衰期的重要因素,也是影响多肽药物生物学活性的关键因素之一。如二肽基肽酶4对胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)具有极强的降解作用,可导致其迅速降解为无生物学活性的9~39片段,同时降解生成的9~39片段是GLP-1受体拮抗剂,使得GLP-1与受体的亲和力降至原来的1%,这种快速降解使天然GLP-1在人体内的半衰期仅有约3 min,无法直接应用于临床[7-9]。因此,寻找多肽类药物的关键水解酶,有助于阐明多肽药物体内分解代谢过程,对多肽药物的合理设计与改造具有重要意义。但是,由于蛋白酶的水解作用涉及范围广、蛋白酶种类繁杂、关键制约因素不明确,多肽药物关键水解酶的分析一直缺少有效的方法[10-13]。
本文选择体内分布广泛、酶解谱较广的8种血液蛋白酶作为研究对象,以高效液相色谱法为基础,经反应条件模块化优化,建立多肽药物关键水解酶体外分析方法。利用本文所建立的方法对已上市多肽药物普兰林肽的关键水解酶进行分析,并利用MST技术进行结果的验证。
1 材 料
1.1 试 剂
人血液8种蛋白酶(表1,美国R&D Systems公司);蛋白酶工具底物(南京金斯瑞生物科技有限公司);普兰林肽、脑钠肽(纯度>95%,北京药渡经纬信息科技有限公司);乙腈、三氟乙酸(美国Sigma公司);所有试剂均为分析纯且可由市售获得。
1.2 仪 器
高效液相色谱系统,色谱柱XBridge C18(美国Agilent公司);Monolith NT.115(德国NanoTemper公司)。
2 方 法
2.1 多肽药物关键水解酶体外分析方法的建立
本实验选择人体血液中酶解谱较广、底物较多、覆盖识别序列较广泛的8种蛋白酶,其中囊括内切酶与外切酶(见表1)。对8种蛋白酶反应体系的pH及缓冲液进行模块化优化。
Table1 Eight proteases in blood with a wide range of enzymatic hydrolysis property and corresponding tool substrates[14]

ECProteaseToolsubstrate3.4.11.2AminopeptidaseN(APN)Enkephalin3.4.17.2CarboxypeptidaseB(CPB)Cholecystokinin83.4.15.1PeptidyldipeptidaseA(ACE)Angiotensin13.4.14.5Dipeptidylpeptidase-4(DPP4)GLP-13.4.24.11Neprilysin(NEP)Enkephalin3.4.24.86Tumornecrosisfactorα-conver-tase(ADAM17)L-selectinprocessingsitepeptideS01.017Kallikrein-relatedpeptidase5(KLK5)S-2288syntheticpeptideS01.132Mannan-bindinglectin-associatedserineprotease3(MASP3)Syntheticpeptide
2.1.1 反应体系pH的优化 实验组按说明书中要求的pH及反应缓冲液将人源重组蛋白酶与对应的工具底物进行反应,反应条件为37 ℃,60 min,反应体系为200 μL,底物浓度为20 μmol/L,反应完成后,使用等比例1%三氟乙酸溶液终止反应,离心后取上清液进行HPLC检测,将柱子用流动相预平衡10 min,流动相A为含0.065% TFA的超纯水,流动相B为含0.05% TFA的乙腈,通过梯度洗脱进行分离,其中B相百分比在25 min内以1 mL/min的流速从5%线性增加至65%,检测波长为214 nm。对照组更换反应pH为7.8和9.0的对应缓冲体系,按上述条件反应后上样检测,实验重复3次。以0 min终止的样品残留率为100%,比较实验组与对照组中工具底物的残留率间是否具有显著性差异,以判断是否可以优化为统一的反应条件。
2.1.2 反应体系缓冲液的优化 将反应体系的pH变更为“2.1.1”项中优化后的pH,缓冲体系分别使用0.01 mol/L PBS溶液和50 mmol/L Tris溶液(含适当强度的金属离子),按“2.1.1”项反应与检测步骤进行实验,实验重复3次。
2.2 方法学验证
2.2.1 线性关系考察 以脑钠肽(brain natriuretic peptide,BNP)为例,在所建立的方法条件下对BNP进行不同浓度梯度线性考察,以峰面积为纵坐标,浓度为横坐标,绘制标准曲线。
2.2.2 精密度
批间精密度和准确度 按上述线性分析方法,改变溶液浓度(30,50,70 μmol/L),每一浓度测定3个样本,按本文所建立的方法与标准曲线同批测定。计算每一浓度测定的相对标准偏差(RSD)。根据标准曲线计算底物浓度,为c0,配置浓度为c1。准确度=c1/c0×100%。
中间精密度 按上述线性分析方法,每一浓度测定3个样本,按本文所建立的方法与标准曲线同批测定,连续测定3 d。按照“第1天A人用 A高效液相色谱仪,第2天B人用B高效液相色谱仪,第3天A人用B高效液相色谱仪”的方式进行测定。计算3种浓度3个批次样品的批间RSD。
2.2.3 耐用性 微小改变柱温(28,30,32 ℃)和流速(0.9,1,1.1 mL/min),按上述线性分析方法对样品进行分析,记录保留时间。每一浓度测定3个样本,分别测定每种条件下3个批次样品保留时间的批间RSD。
2.3 普兰林肽关键水解酶的检测
2.3.1 普兰林肽酶解残留率的测定 利用本实验所建立的方法进行普兰林肽血液酶解残留率的测定,通过比较酶解残留率的大小进行关键水解酶的分析。
2.3.2 普兰林肽与血液蛋白酶相互作用的检测 利用异硫氰酸荧光素对普兰林肽进行荧光标记,并与梯度浓度未标记的蛋白酶于37 ℃在黑暗条件下孵育10 min,吸入至Monolith NT.115标准玻璃毛细管中进行分析。在37 ℃下使用20% MST功率进行测量,激光开/关时间分别为5和20 s,所有实验重复3次,使用NanoTemper软件计算结果。
3 结果与讨论
3.1 多肽药物关键水解酶体外分析方法的建立
由于8种血液蛋白酶均为人源重组蛋白酶,对反应条件的精确度要求较高,而每种蛋白酶的反应条件如pH、反应缓冲体系各不相同,这不利于整套研究系统的建立,因此本实验对反应条件进行优化。
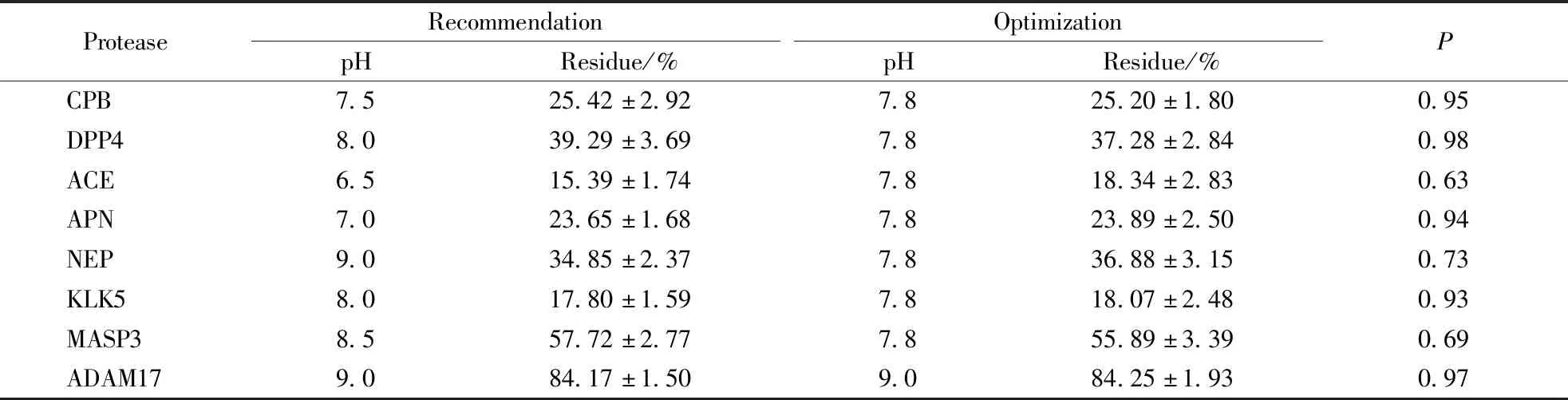
3.1.1 反应体系的pH优化 在多肽的酶促反应过程中,体系的pH不仅对酶促反应过程进行调控,同时也是影响多肽药物稳定性与活性的重要因素。通过比较不同pH条件下对应工具底物反应完成后的残留率,完成反应pH的优化。反应体系pH更换后,对ACE的酶促反应影响最大,优化前后工具底物残留率分别为(15.39±1.74)%和(18.34±2.83)%,但两组间差异不超过3%,且组间P=0.63,不具有显著性差异。差异最小的为DDP4,优化前后工具底物残留率分别为(39.29±3.69)%和(37.28±2.84)%,组间P=0.98。其余底物在不同pH条件下与对应蛋白酶反应后残留率如表2所示,组间均不具有显著性差异。综上,得到ADAM17最佳pH为9.0,其余7种蛋白酶的最佳pH均可为7.8的统一分析方法。

ProteaseRecommendationpHResidue/%OptimizationpHResidue/%PCPB7.525.42±2.927.825.20±1.800.95DPP48.039.29±3.697.837.28±2.840.98ACE6.515.39±1.747.818.34±2.830.63APN7.023.65±1.687.823.89±2.500.94NEP9.034.85±2.377.836.88±3.150.73KLK58.017.80±1.597.818.07±2.480.93MASP38.557.72±2.777.855.89±3.390.69ADAM179.084.17±1.509.084.25±1.930.97
3.1.2 反应体系缓冲液的优化 通过比较不同缓冲液中对应工具底物反应完成后的残留率,完成反应缓冲液的优化。不同缓冲液中工具底物与对应蛋白酶反应残留率的HPLC检测结果见表3,结果表明除ADAM17在0.01 mol/L PBS缓冲液[残留率为(26.31±2.33)%,n=3,P=1.47×10-4]中活性迅速降低以外,其余蛋白酶的反应缓冲液在更换为0.01 mol/L PBS后工具底物残留率均无显著降低。影响较大的CPB在优化前后底物残留率分别为(25.42±2.92)%和(28.20±1.99)%,两组间差异不超过3%,且P达到0.46,不具有显著性差异。差异最小的为ADAM17,优化前后工具底物残留率分别为(84.17±1.50)%和(83.91±0.96)%,组间P达到0.89。由此反应缓冲液可优化为两种:0.01 mol/L PBS缓冲液和50 mmol/L Tris缓冲液。


ProteaseRecommendationBufferResidue/%OptimizationBufferResidue/%PCPB25mmol/LTris25.42±2.920.01mol/LPBS28.20±1.990.46DPP425mmol/LTris39.29±3.690.01mol/LPBS41.30±2.390.66ACE50mmol/LTris15.39±1.740.01mol/LPBS13.36±1.600.41APN50mmol/LMES23.65±1.680.01mol/LPBS23.05±2.270.84NEP50mmol/LTris34.85±2.370.01mol/LPBS36.30±2.100.66KLK50.1mol/LNaH2PO417.80±1.590.01mol/LPBS19.68±1.900.47MASP350mmol/LTris57.72±2.770.01mol/LPBS56.45±2.670.75ADAM1750mmol/LTris84.17±1.5050mmol/LTris83.91±0.960.89
3.2 方法学验证
3.2.1 线性关系考察 以脑钠肽(BNP)浓度为横坐标(x,μmol/L),高效液相信号峰强度为纵坐标(y,mAU)线性回归,得BNP线性标准曲线方程为:y=56.31x-328(r=0.998 5),结果表明,BNP浓度在10~80 μmol/L范围内线性关系良好。
3.2.2 精密度和准确度 精密度和准确度通过分析已知浓度的参比溶液进行3次重复来确定,当样品浓度分别为30,50,70 μmol/L时,批间精密度分别为2.24%,0.77%和1.57%,中间精密度分别为6.68%,1.57%和3.62%,二者均在10%以下,结果表明该系统对BNP的定量分析精密度良好,说明该系统对BNP的定量分析准确。3种浓度BNP溶液测定的准确度在98%~100%,证明方法准确度良好,可进行后续检测。
3.2.3 耐用性 分别改变方法的温度与流速得到耐用性检测结果,30,50,70 μmol/L的3种浓度样品分别在28 ℃,30 ℃,32 ℃条件下进行结果检测,保留时间的RSD分别为0.23%,0.25%和0.24%,均在1%以下;3种浓度的样品分别在0.9,1.0,1.1 mL/min条件下检测,保留时间的RSD分别为2.33%,2.36%,2.38%,均在3%以下,表明方法的耐用性良好。
多肽药物的体外关键水解酶检测方法通过方法学验证精确高效,可以用于关键水解酶的测定。
3.3 普兰林肽关键水解酶的检测
3.3.1 普兰林肽酶解残留率的测定 利用前文建立的多肽药物关键水解酶体外分析方法对已上市多肽药物普兰林肽进行关键水解酶的检测(见表4),其中使普兰林肽残留率最低的两种蛋白酶分别是KLK5与DPP4,其残留率分别为(41.87±1.72)%及(92.00±0.66)%,低于另外6种蛋白酶,证明利用本研究建立的分析方法能够得到普兰林肽的关键水解酶为KLK5及DPP4。


ProteaseResidueofpramlintide/%ACE100.00±0.00APN95.37±0.99KLK541.87±1.72MASP3100.00±0.00NEP94.53±2.08DPP492.00±0.66CPB95.98±1.14ADAM1796.83±0.39
3.3.2 普兰林肽与血液蛋白酶相互作用的检测 本实验发现普兰林肽被KLK5及DPP4的水解目前尚未有相关文献报道,因此,通过MST进一步测定体系中多肽和蛋白酶之间的结合现象以验证上述结果。结果显示,普兰林肽与KLK5和DPP4结合的Kd小于其他蛋白酶,证明具有较高的亲和力(表5)。MST和HPLC测定结果一致,实验结果证实HPLC筛选获得的关键水解酶KLK5和DPP4的确对普兰林肽有较高亲和力。


ProteaseEquilibriumdissociationconstant(Kd,μmol/L)KLK50.04±0.00NEP1.26±0.43ACE7.96±0.68CPB2.29±0.11DPP40.01±0.00APN5.98±0.28MASP31.08±0.36ADAM171.02±0.14
4 结 论
多肽药物的酶解稳定性考察一直以来受到学者广泛关注,本实验基于8种酶解谱广、分布广泛的血液蛋白酶,利用高效液相的方法建立了统一的多肽药物体外关键水解酶分析方法,反应条件分别优化为pH 7.8或9.0及缓冲溶液为0.01 mol/L PBS或50 mmol/L Tris缓冲液,在不影响实验结果的前提下,统一复杂的血液酶酶解反应条件。利用此方法得到的普兰林肽关键水解酶同MST检测结果一致,均为KLK5和DPP4。普兰林肽是胰淀粉样类似物,能够调节血糖水平,通过静脉注射的体内消除半衰期为24~45 min,未来可基于关键水解酶寻找酶切位点指导普兰林肽的稳定性优化,从而延长其半衰期。因此,本研究所建立的方法能够为临床前多肽类药物的高通量稳定性筛选提供方法参考与指导。
