二甲双胍抑制JNK改善缝隙连接功能缓解骨癌痛的实验研究
2019-07-03谷宇峰潘秀秀刘文涛
谷宇峰,潘秀秀,宋 玲,杨 星,胡 亮,刘文涛
(南京医科大学江苏省神经退行性疾病重点实验室,南京 210029)
临床上大约64%以上的肿瘤晚期或者转移癌患者都会面临疼痛问题[1]。肿瘤细胞转移到骨组织,通过释放致痛物质引起骨内部神经纤维的敏化和激活,从而产生疼痛,称为骨癌痛(bone cancer pain,BCP)[2]。转移性乳腺、结肠或肺癌的患者中都容易出现骨癌痛,这种疼痛严重影响患者的生活质量,当前并没有令人满意的临床解决方案。
有文献指出[3-4],癌痛过程中胶质细胞包括小胶质和星形胶质细胞都会出现明显的活化。但与神经病理性疼痛有所差异:癌痛中,星形胶质细胞的活化相比于小胶质细胞更加强烈而持久。近来有报道[4-6]证明,抑制星型胶质细胞的活化能够有效地改善慢性痛和骨癌痛。星形胶质细胞的激活在肿瘤细胞植入(tumor cell implantation,TCI)引起的骨癌痛的维持中发挥了重要作用[7]。但是,要合理高效地抑制癌痛中星形胶质细胞的功能紊乱,目前并没有很好的治疗手段。
星形胶质细胞与小胶质细胞不同,除了促进炎症以外,另一个很重要的功能在于为周围的神经元提供营养和支持。而这一功能主要由缝隙连接(gap junction),即将相邻细胞的细胞质进行连接的细胞内通道所介导。许多报道都证明了缝隙连接在慢性疼痛中发挥重要作用,就此展开的研究不在少数[8-9]。然而,在癌痛尤其是骨癌痛模型中,星形胶质细胞缝隙连接的影响,迄今没有得到很好的研究和阐述。由此,本课题组提出设想,是否可以通过特定的手段来调控星形胶质细胞的缝隙连接即支持营养功能,并由此改善骨癌痛。
本课题组前期研究[10]发现,在TCI的骨癌痛模型中,激活AMP依赖的蛋白激酶[adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK]能抑制胶质细胞活化缓解神经炎症从而改善疼痛。本研究中,通过鞘内注射(i.t.)AMPK激动剂二甲双胍,评估对大鼠TCI引起的骨癌痛是否有良好镇痛作用,开发老药的新用途,并初步探索其中的相关作用机制。
1 材 料
1.1 药品与试剂
盐酸二甲双胍、缝隙连接抑制剂carbenoxolone(CBX)、AMPK抑制剂Compound C(CC)、Tris(德国Sigma公司);甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(美国Sigma公司);缝隙连接蛋白Connexin 43(Cx43)抗体(美国Santa Cruz公司);c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)抗体、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体(美国CST公司);钙离子绑定衔接分子1(ionized calcium-binding adaptor molecule 1,IBA-1)抗体(美国Abcam公司);JNK抑制剂SP600125(美国MCE公司);AMPK激动剂acadesine(5-aminoimidazole-4-carboxamide1-β-D-ribofuranoside,AICAR)、细胞裂解液(上海碧云天生物技术有限公司);30% Acrylamide/Bis(美国Bio Rad公司);十二烷基硫酸钠(sodium dodecyl sulfate,SDS)(南京生兴生物技术有限公司);磷酸缓冲盐溶液(PBS)、TBST缓冲液、甲醇(江苏汉邦科技有限公司);驴血清(美国Millipore公司);驴抗兔荧光二抗、驴抗鼠荧光二抗(美国Jackson实验室)。
1.2 仪 器
Kontes组织匀浆器(德国IKA公司);TE 124s电子分析天平(德国Sartorius公司);Multiskan FC酶标仪、Microcll7R冷冻离心机(美国Thermo公司);Mini Protean4电泳仪、Mini Protean4转膜仪、Quantity One 4.6.5分析软件(美国Bio Rad公司)。
1.3 动 物
雄性SD大鼠,清洁级,体重180~220 g[上海西普尔-必凯实验动物有限公司,合格证编号:20130016009092,使用许可证号:SCXK(苏)2013-0016]。实验动物饲养于12 h昼夜交替的独立环境中,室温维持在25±1 ℃,自由饮水和摄食,在适应环境1周后开始实验。对动物的所有处理均遵循国际疼痛研究协会伦理委员会的要求。
2 方 法
2.1 骨癌痛模型建立
将Walker256腹水肿瘤细胞悬液(每毫升5×106个细胞)0.5 mL腹腔注射到大鼠体内,接种7 d后,从动物腹腔中抽取单细胞悬液。参照文献[11]的方法建立骨癌痛模型。将实验动物随机分为以下几组:正常对照组;TCI组;TCI+SP600 125(10 μg,i.t.);TCI+SP600125(10 μg,i.t.)+CBX(10 μg,i.t.);TCI+二甲双胍治疗组(50,100 μg,i.t.);TCI+二甲双胍(100 μg,i.t.)+CBX(10 μg,i.t.)组。给药方式:造模14 d后,提前30 min 给予抑制剂(SP600125或CBX)再鞘内注射二甲双胍溶液。用戊巴比妥(50 mg/kg)腹腔注射麻醉大鼠,固定,消毒,大鼠的左膝关节用手术刀切开,将含肿瘤细胞(每毫升1×105个细胞)的PBS溶液5 μL直接注射到股骨远端的髓腔中。注射产生的小孔用银汞合金封住,防止肿瘤细胞从骨头中流出。
2.2 检测骨癌痛模型诱导的机械痛阈
采用足底测试仪来观测大鼠机械痛阈,具体如下:在温度为20~25 ℃的安静环境中,将大鼠置于透明的金属网格笼内,测量前使之预适应20 min,当探觅行为停止则开始测量。用足底测试仪的平钝针尖剌激大鼠足底,从无压力逐渐缓慢加压,直至动物产生缩足反应,每次测量间隔3 min,大鼠足爪抬起时对应的最小压力为其机械性剌激缩足反射阈值。每只大鼠至少平行测量3次。
2.3 Western blot法检测蛋白表达水平
取大鼠脊髓L4-L6节段,按一定比例加入细胞裂解液,处理样品,采用BCA蛋白浓度测定试剂盒测定蛋白浓度。经聚丙烯酰胺凝胶电泳分离蛋白,并转移至PDVF膜上,10%牛奶封闭液室温封闭2 h,加入p-JNK一抗(1∶1 000),4 ℃摇晃过夜,TBST洗3次,每次10 min,加入二抗,室温孵育2 h,TBST洗3次,每次10 min,显色。以GAPDH(1∶5 000)为内参。采用Quantity One软件进行数据分析。
2.4 免疫荧光法检测蛋白表达水平
动物深度麻醉后,先用PBS随后换成4%多聚甲醛心脏灌注,之后分离腰椎L4~L5节段,浸泡在4%多聚甲醛中固定4 d,40%蔗糖脱水7 d。冷冻切片时每片厚度设定为20 μm。每组的脊髓切片在4 ℃条件下孵育GFAP,IBA-1,p-Cx43对应一抗(均为1∶100)过夜,PBS清洗切片后,室温下避光孵育二抗2 h,再用PBS清洗3次,在荧光显微镜下观察。
2.5 数据统计

3 结 果
3.1 大鼠TCI骨癌痛模型脊髓星形胶质细胞活化且缝隙连接功能降低
TCI造模14 d后,Von Frey机械痛检测结果显示:大鼠的机械痛阈值明显下降,癌痛造模成功(图1-A)。大鼠脊髓L4-L6节段的免疫荧光结果显示,骨癌痛大鼠脊髓的星形胶质细胞(用GFAP标记)有明显激活,研究表明,CX43的磷酸化水平与缝隙连接功能呈负相关,免疫荧光结果(图1-C)提示,TCI造模后大鼠脊髓CX43的磷酸化水平明显增加(绿色荧光强度明显增加),提示缝隙连接功能降低。
3.2 JNK-缝隙连接功能在骨癌痛模型中的作用
Western blot检测发现骨癌痛大鼠脊髓中p-JNK水平显著上升(图2-A);JNK抑制剂SP600125(10 μg,i.t.)能缓解TCI大鼠的骨癌痛,且该作用能被缝隙连接阻断剂CBX(10 μg,i.t.)所取消(图2-B)。由此说明,JNK-缝隙连接功能在骨癌痛的形成中发挥重要作用,阻断其功能发挥能有效地缓解TCI引起的大鼠骨癌痛。
3.3 二甲双胍鞘内注射能够缓解TCI引起的骨癌痛
TCI造模14 d后,给予大鼠二甲双胍(50,100 μg,i.t.),有良好的镇痛效果,尤其100 μg剂量下镇痛作用明显(图3-A)。同时,大鼠脊髓切片免疫荧光检测显示,二甲双胍100 μg能够显著地抑制TCI造模后GFAP和IBA-1的活化(图3-B)。
3.4 二甲双胍对骨癌痛的镇痛作用依赖于缝隙连接功能
在TCI引起的骨癌痛模型上,二甲双胍(100 μg,i.t.)的镇痛效果被缝隙连接抑制剂CBX(10 μg,i.t.)和AMPK抑制剂CC(10 μg,i.t.)提前30 min预处理所抑制(图4-A)。大鼠脊髓样品Western blot检测表明,二甲双胍降低了脊髓p-JNK的表达水平,而AMPK抑制剂CC则减弱了二甲双胍对p-JNK的影响(图4-B)。

Figure1 Tumor cell implantation (TCI) bone cancer pain activated astrocytes and inhibited gap junction in the spine of rat
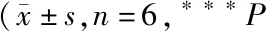

Figure2 Important role of JNK-gap junction pathway in TCI-induced bone cancer pain
A:TCI significantly increased the expression of p-JNK in the spine of TCI rat;B:JNK inhibition attenuated TCI-induced bone cancer pain,which was abolished by gap junction inhibitor in rats
***P<0.001vscontrol group;###P<0.001vsTCI group;&P<0.05,&&&P<0.001vsTCI+SP600125 group

Figure3 Metformin alleviated bone cancer pain caused by TCI in rats

***P<0.001vscontrol group;#P<0.05,##P<0.01,###P<0.001vsTCI group

Figure4 Analgesic effect of metformin on the bone cancer pain model is dependent on the AMPK-JNK-gap junction pathway

**P<0.01,***P<0.001vscontrol group;#P<0.05,###P<0.001vsTCI group;&P<0.05,&&&P<0.001vsTCI + Met group
4 讨 论
目前,疼痛已经成为继体温、脉搏、呼吸、血压之后的第5大生命体征[11],日益受到重视。骨癌痛是肿瘤患者较为常见且十分剧烈的一种伤害性疼痛。遗憾的是,临床上常用的药物都无法取得令人满意的治疗效果。因此,寻找新的潜在治疗靶点和药物对于提高骨癌痛患者的生活质量而言,是非常有必要的。
骨癌痛的形成机制较为复杂,目前,经过相关学者们的研究[12-13],中枢敏化被认为是重要机制之一。在中枢敏化机制中,许多报道都证明了脊髓星形胶质细胞在骨癌痛的产生和维持中发挥着重要的作用[14-15]。星形胶质细胞可通过缝隙链接为其他神经细胞提供营养并开展细胞间通讯。所谓缝隙连接,是指将相邻细胞的细胞质进行连接的细胞内通道,由相邻细胞膜上的两个连接子(connexon)互相锚定而构成,连接子则是由六个亚单位-连接蛋白(connexin/Cx)组成。大量研究[16-17]表明,星形胶质细胞的缝隙连接在慢性神经病理性疼痛中扮演着至关重要的角色。本研究发现,TCI引起的骨癌痛大鼠脊髓中,星形胶质细胞大量激活而缝隙连接功能(与p-Cx43水平成反比)却明显减弱,且缝隙连接阻断剂CBX对骨癌痛大鼠的机械痛觉的行为学表现有重要影响。本研究首次证明星形胶质细胞上的缝隙连接也参与了骨癌痛的形成,骨癌痛模型下缝隙连接功能明显受阻。
c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)是哺乳类细胞MAPK(mitogen-activated protein kinase,丝裂原活化蛋白激酶)信号通路的一个亚类。在慢性疼痛中,通常伴随着JNK信号通路的激活[18]。抑制JNK通路能缓解骨癌痛也在不少报道中被证明[19-20]。根据文献报道,在多种肿瘤模型中都发现JNK通路和缝隙连接存在着密切的相关关系[16]。因此,在本研究考察了骨癌痛模型下JNK通路和缝隙连接的相互关系。结果显示,骨癌痛造模成功的大鼠脊髓中p-JNK和p-Cx43的蛋白水平都明显升高;JNK抑制剂SP600125能够显著抑制TCI造成的骨癌痛,而这种镇痛效果几乎完全被缝隙连接阻断剂CBX所抑制。本研究结果说明,JNK-缝隙连接功能在骨癌痛中有重要作用,可能成为解决骨癌痛这一难题的新治疗靶标。
AMPK即AMP依赖的蛋白激酶,与胆固醇的生物合成密切相关,是重要的代谢调节蛋白[21]。本课题组之前的研究[22]证明,在脊髓胶质细胞中激活AMPK能够有效缓解TCI造成的骨癌痛。因此,本研究试图探索AMPK对于骨癌痛的治疗效果是否与上述的JNK-缝隙连接功能有关。实验结果表明,给予AMPK激动剂二甲双胍能有效缓解大鼠TCI引起的骨癌痛,这种明显的镇痛效果能被AMPK阻断剂CC以及缝隙连接阻断剂CBX所抑制。且Western blot和免疫荧光结果显示,二甲双胍给药后,大鼠脊髓JNK的激活则被抑制,这种抑制可被AMPK抑制剂CC所阻断。本研究首次发现,AMPK-JNK-缝隙连接功能在骨癌痛生成中具有重要作用,通过给予二甲双胍能有效地缓解骨癌痛,为临床攻克骨癌痛提供了重要的线索。
综上所述,二甲双胍通过抑制星形胶质细胞中JNK改善缝隙连接功能,显著缓解肿瘤细胞移植诱导的大鼠骨癌痛。本研究首次在骨癌痛模型下,发现星形胶质细胞中AMPK-JNK-缝隙连接功能的重要作用。本研究为临床骨癌痛的治疗提供了一种潜在的安全有效的药物,并提出了通过抑制脊髓星形胶质细胞JNK改善缝隙连接,进而改善骨癌痛的潜在治疗策略。
