硫化氢供体分子研究进展
2019-07-03申欣欣张奕华黄张建
申欣欣,张奕华,黄张建
(中国药科大学新药研究中心,南京 210009)
硫化氢(H2S)是一种具有臭鸡蛋味的难闻气体,几个世纪以来都被认为是有毒的空气污染物,直到1996年Abe和Kimura[1]报道了H2S的内源性生成和信号传导能力后,人们才发现它是继一氧化氮(NO)和一氧化碳(CO)之后的第3种内源性气体信使分子,对人类的健康具有极其重要的作用[2]。
内源性H2S主要由两种吡哆醛-5′-磷酸(PLP)依赖性酶:胱硫醚-β-合成酶(CBS)和胱硫醚-γ-裂解酶(CSE)催化底物半胱氨酸生成[3]。另外,也可以由PLP非依赖性的半胱氨酸氨基转移酶(CAT)催化半胱氨酸形成巯基丙酮酸,进一步在3-巯基丙酮酸硫转移酶(3-MST)的作用下释放生成[4-5](图1-A)。H2S主要在线粒体氧化代谢,其机制是其和硫化物醌还原酶(SQR)反应形成SQR-SSH中间体,然后在谷胱甘肽巯基转移酶(GST)介导下,将该中间体的硫原子转给谷胱甘肽(GSH),生成氧化型谷胱甘肽(GSSH),再经硫双加氧酶(SDO)氧化,形成硫代硫酸盐或硫酸盐[6](图1-B)。
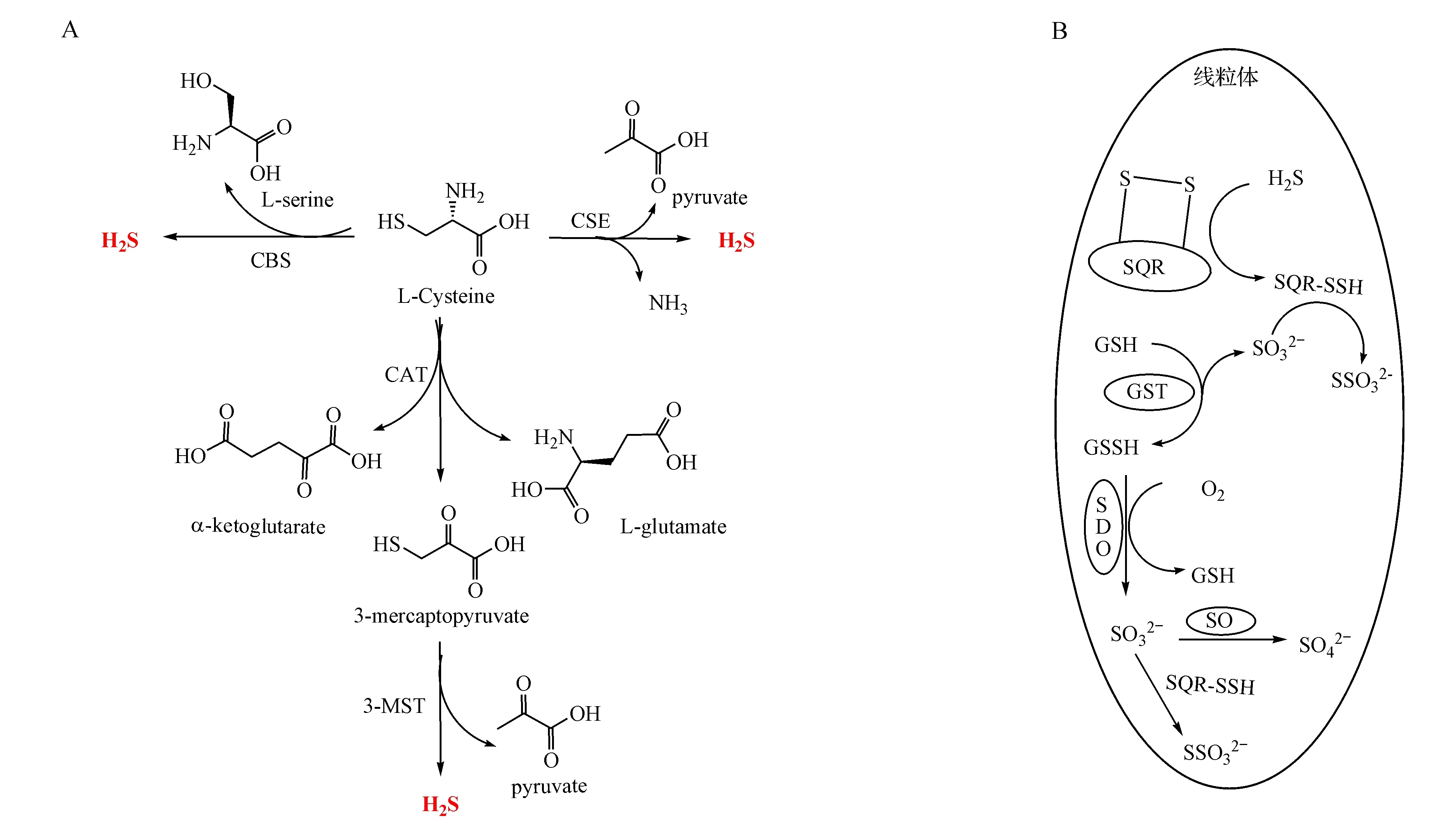
图1 (A)哺乳动物细胞内源性H2S产生的机制;(B)体内H2S代谢途径
H2S可以在短时间内迅速地跨越细胞膜内外,半衰期较短,但具有广泛的生物学作用,包括舒张血管[7]、保护心脏[8]、抗炎[9]、抗氧化[10]和抗肿瘤[11-12]等。H2S介导的生理作用主要通过以下3种途径产生。途径一是H2S对蛋白质半胱氨酸残基S-硫化作用,即将硫醇(-SH)转化为过硫化物(-SSH)。通过该途径,H2S可以改变包括受体、离子通道和酶等细胞蛋白质功能[13],比如舒张血管/肠道和气道的平滑肌细胞,调节离子通道的开放和关闭,促进或抑制炎症反应等。途径二是H2S与NO等有机亲电体的相互作用。例如,H2S与NO反应可生成相对分子质量最小的亚硝基硫醇(HSNO),它可以促进蛋白质的亚硝化[14];H2S也易与含过渡态金属的蛋白反应,生理环境中最主要的靶标即是血红蛋白,产生磺化血红蛋白[15]。
大量的研究表明,H2S具有广泛的生物学活性,且活性具有一定的剂量依赖关系,特别是在肿瘤生物学方面。已知内源性H2S或相对较低水平的外源性H2S通过诱导血管生成[16],调节线粒体生物能量[17],加速细胞周期进程[18]和抗凋亡[19]的机制来发挥促癌作用,而相对高浓度的外源H2S可通过诱导不可控的细胞内酸化,诱导细胞周期停滞和促进细胞凋亡来抑制肿瘤细胞的生长[20]。因此,H2S供体药物研究的关键科学问题在于如何使H2S供体分子选择性地在靶部位(一般为病变部位)释放一定浓度的H2S,而在正常组织器官中不释放或者仅释放少量的H2S,在发挥治疗作用的同时最大限度地避免H2S的不良反应。
本文综述了两大类H2S供体的结构及其释放H2S的机制,重点介绍近年来发展的具有可控释放潜力的H2S供体分子,旨在为H2S供体药物研究提供新的思路。
1 传统的H2S供体
1.1 硫化物无机盐
为了研究H2S的生理和病理活性,传统方法是制备H2S气体的水溶液。然而H2S气体的可控性不佳,难以精确控制体内有效浓度,而且制作过程有H2S中毒的危险,因此应用H2S水溶液受到限制[21]。于是人们便把目光转到了硫化物无机盐亚硫化钠(NaHS)和硫化钠(Na2S),但这些无机盐亦存在着一些缺点。例如,它们释放H2S速率相对较快且不可控,不能模拟体内缓慢而连续地产生H2S的过程;此外,NaHS在水溶液中会被O2快速氧化,导致浓度的不准确和生物效应的差异[22]。
1.2 有机多硫化物
有机多硫化物是一类含有多硫键的H2S供体型活性天然产物,包括大蒜中含量较高的二烯丙基三硫化物(DATS)及二烯丙基二硫化物(DADS),蘑菇中的lenthionine,芦笋中的asparagusic acid trisulfide,海鞘中的varacin等[23](图2)。2007年,Benavides等[24]报道了DATS和DADS可以在人类红细胞内或大鼠主动脉中释放H2S,舒张主动脉环。其释放机制研究表明,DATS可与GSH快速反应生成硫醇二硫化物同时释放H2S,而DADS可与GSH的α-碳发生亲核取代反应,缓慢释放出少量的H2S[25]。

图2 H2S供体型多硫化物类活性天然产物的结构
1.3 Lawesson试剂衍生物
Lawesson试剂(LR)是一种常用的硫代试剂,可将酮、酯、酰胺和醇硫化为相应的硫类似物。GYY4137是LR的水溶性衍生物,可经水解反应释放H2S[26](图3)。由于其可获得性和易于处理的特性,GYY4137是一种被广泛应用的H2S供体工具分子。Whiteman等[27]测试了GYY4137对脂多糖(LPS)处理的小鼠RAW 264.7巨噬细胞释放促炎或抗炎因子的影响,发现该化合物对炎症的影响不仅依赖于H2S的浓度,还取决于H2S的产生速率。但是,GYY4137也存在如下缺点:一方面,它通常被制备成二氯甲烷络合物,而二氯甲烷在体内会被代谢为多活性和高毒性的气体信使分子CO[28],因此,观测到的生物效应可能部分来自于CO;另一方面,尚没有合适的对照化合物可以用来排除GYY4137释放H2S之后产生的副产物所引起的生物活性[29]。

图3 GYY4137的结构
1.4 1,2-二硫杂-3-硫酮(DTT)
1,2-二硫杂-3-硫酮(DTT,图4)是一类水解触发释放的H2S供体,其类似物茴三硫(ADT)的脱甲基产物ADT-OH常用于已知药物分子的H2S供体衍生化[29]。如双氯芬酸羧基和ADT-OH成酯可得到相应的H2S供体衍生物s-diclofenac(图4),提高抗炎活性的同时降低了双氯芬酸的胃肠道不良反应[30]。此外,本课题组利用ADT-OH作为H2S供体,硝酸酯作为NO供体,合成了H2S/NO双供体型丁苯酞(NBP)衍生物(1)[31],该化合物在0.1 mmol/L浓度下对ADP诱导的家兔血小板聚集的抑制活性是丁苯酞的5.2倍;化合物1能够释放适量浓度的NO和H2S;化合物1能够显著改善缺血/再灌(I/R)大鼠的神经行为功能,降低脑梗死面积及脑含水量,其效果优于等物质的量的丁苯酞;作用机制研究发现,化合物1可通过提高I/R大鼠脑内GSH、超氧阴离子歧化酶(SOD)及谷胱甘肽过氧化物酶(GSH-Px)的水平,降低丙二醛(MDA)的含量,发挥抗氧化作用,从而对缺血性脑损伤产生保护作用(图4)。
传统的H2S供体虽然为H2S基础生物学研究方面提供了易得的工具分子,但缺乏H2S释放的选择性及释放速率的可控性,因此成药性较差。下面介绍近年来发展的几类新型H2S供体及其释放H2S的机制。
2 可控释放的H2S供体
2.1 硫醇触发的H2S供体
硫醇触发的H2S供体是一类常见的非水解触发的供体。哺乳动物体内含有较多游离的硫醇小分子,如半胱氨酸、GSH等,其作为亲核试剂与此类H2S供体亲核加成后发生硫醇交换,可实现H2S的选择性释放[29]。研究人员发现N-巯基化合物中的S-N键在生理条件下易受到硫醇的进攻而断裂,可作为潜在的H2S供体[32]。但由于N-SH衍生物不稳定,Zhao等[33]对SH基团保护后得到稳定的H2S供体N-(苯甲酰巯基)苯甲酰胺化合物NSHD-1(图5)。再将NSHD-1与半胱氨酸(10当量)反应,研究NSHD-1释放H2S的机制,得到了3种降解产物:N-苯甲酰基半胱氨酸,苯甲酰胺和胱氨酸。该法虽有一定的实用性,但由于体内小分子硫醇化合物分布广泛,所以此类硫醇触发的H2S供体的选择性有待进一步提高。
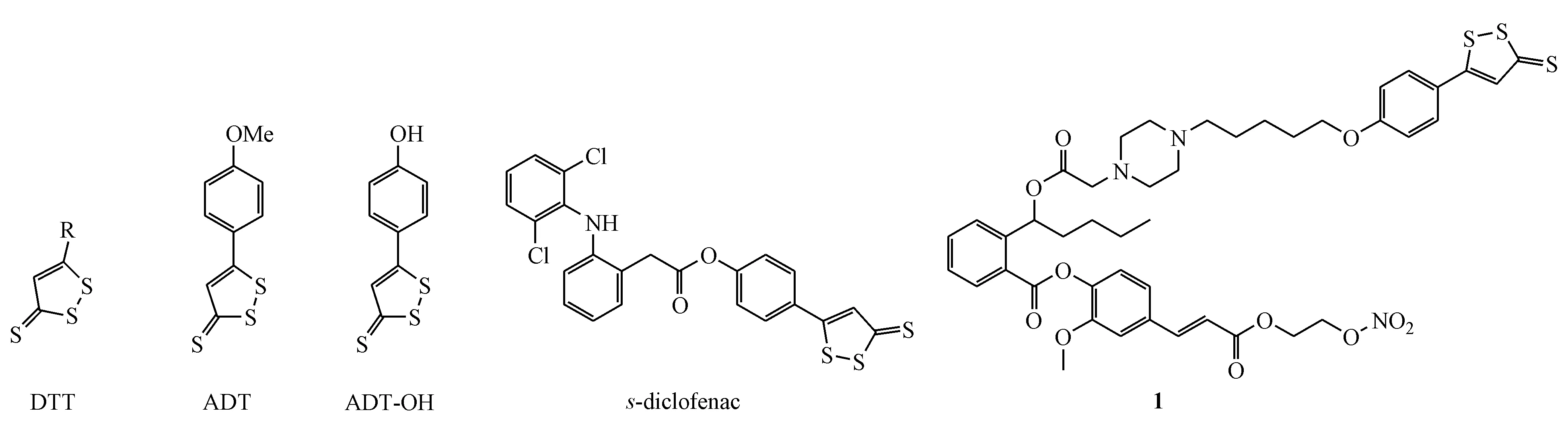
图4 1,2-二硫杂-3-硫酮(DTT)和茴三硫(ADT)及其衍生物的结构
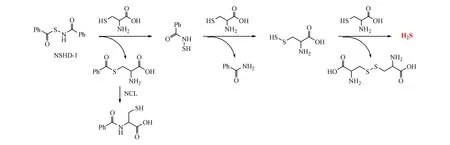
图5N-(苯甲酰巯基)苯甲酰胺化合物NSHD-1经硫醇触发释放H2S的机制
2.2 酶触发的H2S供体
理想的酶触发型H2S供体应在生理条件下稳定存在,但可在特定酶的作用下释放H2S,以实现选择性释放H2S的目的。Zheng等[34]利用内酯化前药思路,将原药结构中的酚羟基和乙酰基成酯,合成了一种酯酶敏感的H2S前药BW-HP-101(图6-A)。该化合物在生理条件下是稳定的,但在酯酶作用下,游离的酚羟基可和邻位的硫代丙酸形成内酯,从而释放出H2S。生物活性研究表明,BW-HP-101在LPS处理的小鼠RAW 264.7巨噬细胞模型中表现出一定的抗炎作用。其后,该课题组又报道了一类羟甲基二硫化合物(R1C(OH)HSSR1,3)为骨架的酯酶触发的H2S供体2[35]。化合物2表现出一定的稳定性,但可经酯酶水解为化合物3,后者结构中羟甲基二硫键为不稳定的半缩醛,能快速断裂形成有机过硫化物4,进而释放H2S(图6-B)。体内研究表明,化合物2在小鼠心肌缺血再灌注损伤模型中表现出较好的心脏保护作用。上述两类酯酶触发的H2S供体存在因酯酶分布广而导致H2S释放选择性差的缺陷。因此,如何基于上述策略,设计非酯酶触发的H2S供体分子是进一步研究的课题。
2.3 光触发的H2S供体
与上述硫醇和酯酶触发的H2S释放策略相比,光触发策略具有更好的选择性和可控性。迄今为止,已经开发了数种不同类型的紫外光活化的H2S供体,如利用光固化剂邻硝基苄基[36]和占吨酮基取代的叔丁酸基[37],分别得到了紫外光激活的H2S供体化合物5和6(图7-A)。最近,Venkatesh等[38]在紫外光照射和单线态氧光敏剂存在的条件下,研究了1,3-二苯基苯并[C]噻吩(DPET)将三线态氧(3O2)转化为单线态氧(1O2),再与噻吩环发生Diels-Alder反应,形成过氧化物,进一步降解成二酮化合物,释放H2S(图7-B)。此类紫外光触发的H2S供体的主要缺点是紫外光对细胞的毒性会干扰此类供体的生物活性,另外还需要外源的单线态氧光敏剂来催化释放H2S。
为了解决这些问题,他们又设计、合成了一种可见光(λ≥410 nm)触发的H2S供体[38](图7-C)。它应用了激发态分子内质子转移(ESIPT)效应作为光触发机制,其特点是:一方面,ESIPT效应有助于酚羟基的去质子化并快速光解、释放H2S分子[39];另一方面,无需借助外部试剂,光照后产生H2S的同时释放具有荧光的化合物,后者可检测、定位亚细胞水平H2S的释放。

图6 化合物BW-HP-101(A)和化合物2(B)经酯酶触发释放H2S的机制

图7 (A)紫外光激活的H2S供体5和6的结构;(B)DPET在紫外光和单线态氧光敏剂(PS)的作用下释放H2S的机制;(C)化合物7经紫外光激活释放H2S的机制
2.4 经COS介导的H2S供体
羰基硫化物(COS)是一种气体分子,在化学生物学中具有独特的作用。已知COS可在全身广泛分布的碳酸酐酶(CA)作用下水解为H2S[40],因此,通过采用选择性释放COS并进一步在CA的作用下转化为H2S的策略,可为选择性释放H2S提供新的途径。COS前体主要分为硫代氨基甲酸酯和N-硫代羰基酸酐(N-thiocarboxyanhydrides,NTAs)两类,下面分别加以介绍。
2.4.1 硫代氨基甲酸酯类H2S供体 Pluth课题组的Chauhan等[41]曾报道了一类COS前体分子,即硫代氨基甲酸-4-叠氮基苄酯(8),该化合物可在H2S的作用下将叠氮基转化为氨基,触发1,6-消除反应后释放COS,再经CA水解产生H2S(图8-A)。此类硫代氨基甲酸苄酯可以通过苄基对位结构修饰,以实现不同响应策略下的H2S释放[42]。该课题组的Steiger等[43]就利用特戊酸对硫代氨基甲酸苄酯中苯环的对位羟基进行成酯保护,得到稳定的H2S供体9,它可在酯酶作用下水解得到酚羟基中间体,再经1,6-消除反应,释放COS,后者可由CA水解产生H2S(图8-B)。体内研究表明,化合物9在LPS处理的小鼠RAW 264.7巨噬细胞炎症模型中表现出一定的抗炎作用。其后,又在硫代氨基甲酸苄酯的苯基对位引入硼酸酯基团得到一种选择性更高的ROS响应型H2S供体10[44],它在体内ROS(如H2O2)含量高的组织器官中被氧化,对位的硼酸酯转化为酚羟基,再经1,6-消除反应后释放H2S(图8-C)。
为了实现更高选择性的H2S释放,该课题组想到了生物正交化学中经典的键断裂反应。生物正交化学是指一类可以在活细胞或者体内发生的化学反应,但反应物和产物并不影响细胞或者体内进程。按照反应类型分为键形成和键断裂两种,前者最为经典的反应为点击化学反应,已广泛应用于化学生物学的研究[45]。利用键断裂反应中的反式环辛烯(TCO)和四嗪之间的inverse-electron demand Diels-Alder(IEDDA)反应作为激活策略,Steiger等[46]设计、合成了含硫代氨基甲酸酯和TCO片段的化合物11,它在四嗪衍生物的触发下发生IEDDA反应,再由互变异构化的消除反应,释放COS,进而释放H2S(图8-D)。

图8 (A)化合物8经H2S触发释放H2S的机制;(B)化合物9经酯酶触发释放H2S的机制;(C)化合物10经ROS触发释放H2S的机制;(D)化合物11经四嗪衍生物触发释放H2S的机制
Zhao和Pluth等[47]进一步将光激活策略和COS结合起来,设计、合成了紫外光激活的H2S供体分子PhotoTCM(图9-A)。PhotoTCM在紫外光照射下首先产生游离的硫代氨基甲酸中间体12,后者分解产生4-氟苯胺和COS,从而释放H2S。在此基础上,Sharma等[48]进一步设计合成了BDP-H2S(图9-B),它是一个基于氟硼二吡咯(BODIPY)的氨基甲酸硫酯类化合物,在可见光(470 nm)下,B-O键断裂产生中间体13,后者不稳定,产生COS,从而释放H2S。BDP-H2S与PhotoTCM相比具有明显的优势,虽然前者可在细胞中引起一定的氧化应激,但是H2S释放所需的光照射时间短且强度低,因此不会损害细胞活力。

图9 化合物PhotoTCM (A)和BDP-H2S (B)经光激活释放H2S的机制
2.4.2N-硫代羰基酸酐类H2S供体 1971年,Hirschmann等[49]首次报道N-硫代羰基酸酐类可作为N-羧酸酐(NCAs)的替代物,用于寡肽的溶液相合成。最近,Powell和他的同事根据NTAs设计、合成了基于亲核试剂激活的H2S供体14[50]。化合物14容易附着于聚合物支架上,与亲核试剂如硫醇等反应,释放COS,并产生对生物无害的副产物15(图10)。尽管该化合物可以缓慢释放H2S,但依旧存在类似于硫醇激活的H2S供体选择性差的缺点,有待进一步研究。

图10 化合物14经亲核试剂激活释放H2S的机制
3 结 语
作为气体分子,H2S的活性与其释放的部位、浓度和持续时间密切相关。传统的H2S供体如硫化物无机盐广泛用于工具分子研究H2S的相关生物活性,但缺泛H2S释放部位的选择性。ADT-OH较多地被用于H2S供体药物的设计、合成,其H2S释放的选择性仍有待提高。具有选择性释放潜力的H2S供体分子如硫醇、酯酶触发的H2S供体分子已引起人们广泛兴趣,但由于硫醇和酯酶在体内广泛存在,H2S体内释放的选择性也不十分理想。类似地,经COS介导释放H2S所需的碳酸酐酶也几乎遍布全身且各处浓度不同,故无法保证在激活的原位释放一定量的H2S。而光激活的H2S供体分子受光穿透能力的限制,实现动物体内选择性的释放也有一定难度。近年来,基于纳米医学的H2S递送平台充分利用上述小分子选择性释放H2S的策略,也已取得一定进展[51-52],由于本文篇幅有限,将另文报道。
相信随着H2S相关生理、病理学研究的深入,更多H2S分子的释放机制将被揭示出来;随着不同学科之间的交叉合作,高选择性H2S供体分子以及基于这些分子的药物研究将会取得越来越大的进展。
