us3基因的缺失对单纯疱疹病毒1型毒力和抗凋亡功能的影响
2019-07-03吴化叶牟唐维徐兴丽冯骁王丽春范胜涛李琦涵
吴化叶,牟唐维,徐兴丽,冯骁,王丽春,范胜涛,李琦涵
中国医学科学院/北京协和医学院医学生物学研究所, 云南省重大传染病疫苗研发重点实验室, 云南 昆明 650118
单纯疱疹病毒1型(herpes simplex virus type 1,HSV-1)是双链DNA病毒。作为具有复杂基因结构及其相关转录调控机制的双链DNA病毒,其能编码多种具有不同生物学功能的分子[1]。这些分子大多数可能不被病毒复制所需,但在病毒感染过程及与宿主细胞相互作用中为病毒增殖建立系统、有效的微环境具有十分重要的意义[2-4]。从HSV-1引起的急性感染、潜伏感染及其相关临床表征来看,认识病毒编码分子与宿主细胞及机体的相互作用,对HSV-1相关疾病的监控及预防具有重要意义[5]。
目前,基于HSV-1编码的多种分子的作用对感染组织的病理机制进行探讨,常用的方法是利用基因修饰突变制备相关毒株,并针对这类毒株的生物学特性分析相关病毒编码分子与特定病理机制的关系[6]。本课题组前期工作已对HSV-1编码衣壳蛋白进行综合探索,制备了具有明确减毒表型的M3减毒株(M3株),包括病毒基因转录调控因子UL7、病毒毒力因子Vhs及潜伏相关LAT基因的修饰突变[7]。分析M3株的生物学特性及感染能力,发现与野生型毒株(McKrae株)相比,其具有极低增殖能力和低致病能力[8]。同时,通过建立小鼠及恒河猴感染模型,发现M3株可引起相应的保护性免疫反应[4,8],但这一免疫保护效应尚不能完全控制小鼠或恒河猴在McKrae株攻击时病毒在神经系统(尤其是在三叉神经节)中的增殖。基于这些结果,本研究针对以往确定的具有抑制细胞凋亡的病毒编码基因us3[9],对M3减毒株进行进一步的修饰突变,使us3基因发生146 bp缺失,获得M4突变株(M4株)。假设病毒感染所表现的宿主细胞凋亡是机体天然免疫反应中的一部分,对抑制病毒在机体中的扩散和增殖具有重要作用,那么HSV-1编码抑制细胞凋亡分子是病毒免疫逃逸机制之一[10],而抑制HSV-1抗细胞凋亡能力有可能促进机体免疫反应增强,从而降低病毒感染率。为此,本研究系统观察了M4株在BALB/c小鼠中的感染特征、致病能力及细胞凋亡情况,证明抑制us3基因可使HSV-1的减毒特征明显增强并促进宿主细胞凋亡。
1 材料与方法
1.1 实验动物
100只无特定病原体(specific pathogen free,SPF)级BALB/c雌性小鼠(4周龄)购自北京维通利华实验动物技术有限公司[动物合格证号:SCXK(京)2016-0006],小鼠的饲养和管理均遵循《实验动物饲养管理和使用指南》。本动物实验操作在生物安全2级(biosafety level 2,BSL-2)实验室完成。
1.2 毒株及细胞
病毒滴度以细胞培养半数感染量(50% cell culture infective dose,CCID50)表示。HSV-1毒株如下:McKrae株,106.25CCID50/mL;M3株,105CCID50/mL;M4株,利用CRISPR/Cas9系统在M3减毒株[11]的基础上使us3基因146 bp的序列(CCTGGGGGACTTTGGCGCCGCGTGCTTCG-T G C A G G G T T C C C G A T C A A G C C C C T T C C C C T-ACGGA A T C G C C G G A A C C A T C G A C A C C A A C-GCCCCCGAGGTCCTGGCCGGGGATCCGTAT-ACCACGACCGTCGACATTTGGAGCGCCG)缺失制备而成,106.3CCID50/mL。以上HSV-1毒株和Vero、KMB-17细胞由中国医学科学院/北京协和医学院医学生物学研究所病毒免疫室提供,人急性T细胞淋巴瘤细胞(Jurkat细胞)购自中国科学院昆明细胞库。
1.3 主要试剂
1%胰酶、4%乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、400 U/mL青霉素/链霉素、MEM培养基、3%谷氨酰胺、6.6% 碳酸氢钠、小牛血清均由中国医学科学院医学生物学研究所提供,酶联免疫斑点实验(enzyme-linked immunospot assay,ELISpot)相关试剂盒购自瑞典MabTech公司,小鼠淋巴细胞分离液、ELISpot专用培养基、PHA购自深圳达科为生物技术有限公司,TRIzol RNA提取试剂购自天根生化科技(北京)有限公司,组织核酸提取试剂盒购自美国Axygen公司,聚合酶链反应(polymerase chain reaction,PCR)相关试剂盒购自日本TaKaRa 公司,4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)和凋亡检测试剂盒购自美国BD公司,所用探针、引物和抗原肽由生工生物工程(上海)股份有限公司合成(表1)。
表1 q-PCR引物
Tab.1 Oligonucleotides used for q-PCR

NameSequence (5'-3')GAPDHF:AGGTCGGTGTGAACGGATTTGR:TGTAGACCATGTAGTTGAGGTCATNF-αF:GACGTGGAACTGGCAGAAGAGR:TTGGTGGTTTGTGAGTGTGAGIL-1βF:GCAACTGTTCCTGAACTCAACTR:ATCTTTTGGGGTCCGTCAACTIL-12βF:TGGTTTGCCATCGTTTTGCTGR:ACAGGTGAGGTTCACTGTTTCTIL-23F:AATAATGTGCCCCGTATCCAGTR:GCTCCCCTTTGAAGATGTCAG
1.4 增殖动力学实验
将已知滴度的病毒液以感染复数(multiplicity of infection,MOI)=0.1 接种至KMB-17单层T12.5密封培养瓶中,37 ℃恒温培养。每隔8 h收一次样,共5个时间点。-80 ℃冻融后,3次生物学重复。按Reed-Muench法统计病毒滴定结果并绘制增殖动力曲线[12]。
1.5 HSV-1感染小鼠及各项指标检测
1.5.1 分组将小鼠随机分为3个感染组(McKrae、M3、M4组),每只攻毒剂量为1×104CCID50,每组共设8个时间点(12 h、24 h、48 h、72 h、7 d、28 d、56 d、84 d);另设M3、M4组(每组10只),分别在初次免疫后第45 天再次进行1×104CCID50McKrae株感染,攻毒后第3、7天处死;以磷酸盐缓冲液(phosphate buffered saline,PBS)为对照组。以上感染方式均为喷鼻,每组在每个时间点处死3只。
1.5.2 临床症状观察感染后观察小鼠是否出现弓背、倒毛、单侧眼视力丧失、四肢瘫痪、濒死或死亡等临床症状。连续10 d记录各组小鼠存活状况和体重变化。
1.5.3 组织病理检测各组在12 h、24 h、48 h、72 h、7 d取小鼠脑和脊髓组织, 10%中性甲醛溶液固定、脱水、石蜡包埋、切片,进行H-E染色和封固,显微镜下观察病变。
1.5.4 组织病毒载量检测采集病毒感染后(12 h、24 h、48 h、72 h、7 d、28 d)的小鼠脑、三叉神经、脊髓、气管组织,称重后匀浆研磨,按AxyPrepTMBody Fluid Viral DNA/RNA Miniprep Kit操作说明书提取病毒核酸,按Premix Ex TaqTM试剂盒说明书配制反应体系进行绝对定量PCR。以HSV-1基因组高度保守区gG基因设计引物和探针[13]。上游引物:5′-TCCTSGTTCCTMACKGCCTCCC-3′;下游引物:5′-GCAGICAYACGTAACGCACGCT-3′;探针:6FAM-CGTCTGGACCAACCGCCACA-CAGGTTAMRA。
1.5.5 细胞因子表达分析使用TRIzol试剂从肺、口、鼻、淋巴组织提取RNA,按One Step SYBR®PrimeScriptTMPLUS RT-PCR Kit 试剂盒说明书配制反应体系,进行PCR(20 μL体系)。反应条件:42 ℃ 5 min,95 ℃ 10 s;95 ℃ 5 s,60 ℃ 30 s,共39个循环。以GAPDH为内参,使用2-ΔΔCT方法计算基因相对表达量。
1.5.6 T细胞功能分析颈椎脱臼处死小鼠,无菌操作取小鼠脾脏,分离单核细胞。用Mouse IFN-γ ELISpotPLUS(HRP)、Mouse IL-4 ELISpotPLUS(HRP)试剂盒,以HSV-1抗原肽gB499-506:SSIEFARL和RR822-829:QTFDFGRL为刺激物(10 μg/mL),检测分泌γ干扰素(interferon γ,IFN-γ)和白细胞介素4(interleukin 4,IL-4)的特异性T细胞增殖状况。
1.5.7 中和抗体效价检测采集小鼠血清(28 d、56 d、84 d),从1∶4开始进行倍比稀释(1∶4、1∶8、1∶16……1∶512)。将稀释血清以50 μL/孔加入96孔板,加入已知滴度为2×103CCID50/mL的病毒样品50 μL,在37 ℃中和2 h,加入消化的Vero细胞悬液,7 d后观察细胞病变。
1.5.8 细胞凋亡测定将McKrae、M3、M4株以MOI=1接种于Jurkat细胞,24 h后收集细胞,按凋亡检测试剂盒说明书进行流式细胞术分析。同时将细胞固定,进行DAPI染色,显微镜下观察凋亡小体。
1.6 统计分析
使用GraphPad Prism 7.0软件进行图表绘制,SPSS 17.0软件进行数据分析,Log-Rank检验进行小鼠存活率分析,其余数据采用双独立样本均数t检验,P<0.05为差异有统计学意义。
2 结果
2.1 M4株的鉴定及 M3、M4株细胞水平的增殖动力学分析
利用CRISPR/Cas9系统制备基于M3株us3基因缺失的M4株,且经电泳和测序验证构建成功。在人二倍体细胞KMB-17细胞中,将M3、M4株以 MOI=0.1进行接种,每8 h间隔收样,进行病毒增殖动力学分析。结果显示,M4株在细胞水平的增殖能力与M3株基本一致,表明us3基因缺失并不影响M4株的体外增殖(图1)。
2.2 M3和M4株感染BALB/c小鼠均无临床症状
BALB/c小鼠常作为研究HSV-1致病性的动物模型,小鼠临床表现与毒株致病性有关,强致病性毒株可导致小鼠死亡。本研究以每只1×104CCID50的剂量对BALB/c小鼠分别进行McKrae、M3和M4株感染,逐日观察小鼠临床症状,对体重、生存率进行统计分析。McKrae组小鼠从第3天开始出现精神不振、食欲下降、弓背、倒毛、单侧眼失明、体重下降并逐渐死亡,至第6天全部死亡。但M3和M4组小鼠无明显临床表现,体重稳定增加,未出现死亡现象。结果提示,作为缺失特定基因的M3、M4株,其生物学性状已发生改变,与McKrae株相比对小鼠的致病性明显降低(图2)。
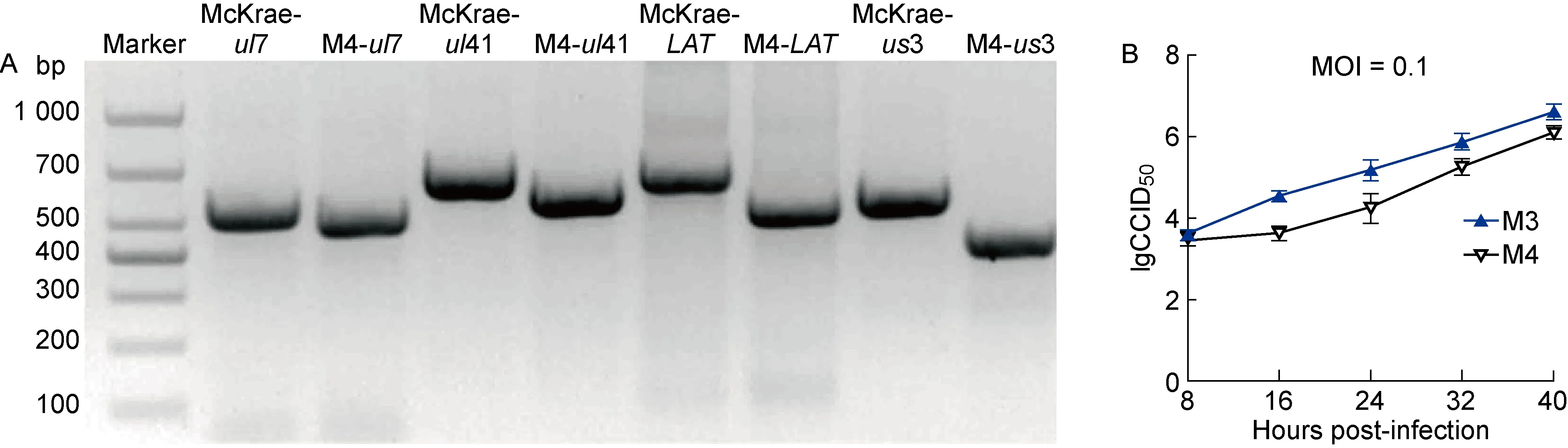
图1 M4株的缺失验证及与M3株增殖动力学的比较
Fig.1 Deletion verification of M4 mutant strains and proliferation kinetics compared with M3 strains
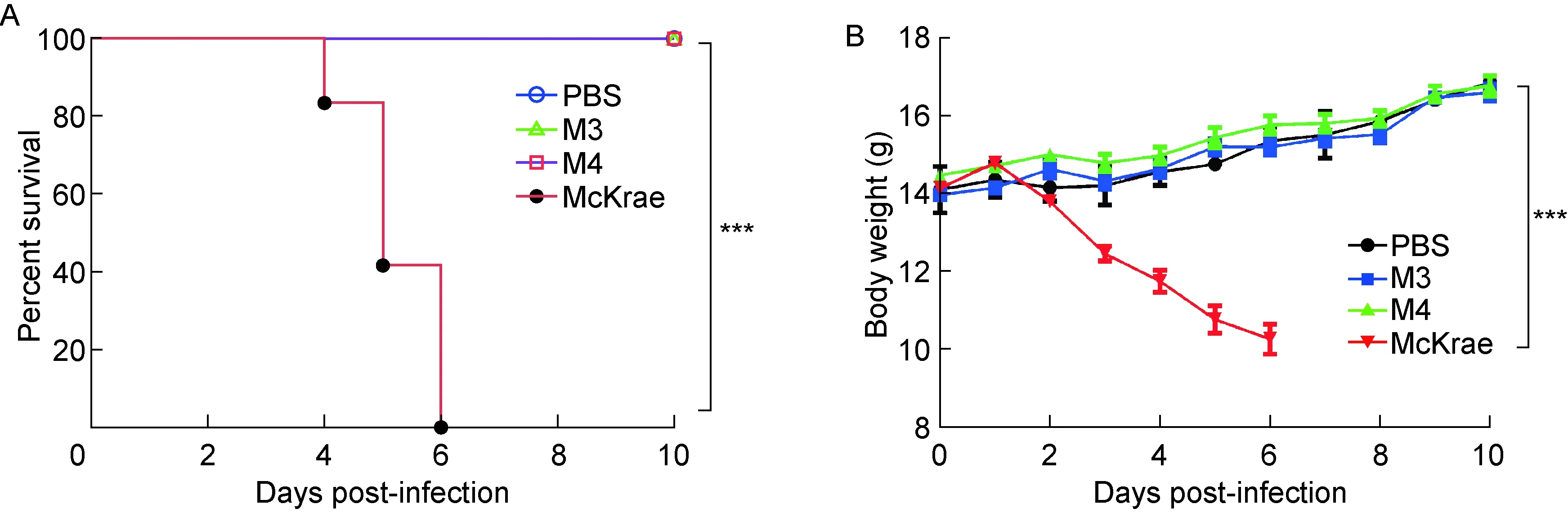
A: Survival rates. B: Weight change.
图2 小鼠感染McKrae、M3和M4株后生存率和体重的变化
Fig.2 Survival rates and weight change in McKrae, M3 and M4 groups
2.3 us3基因突变可下调M4株在小鼠主要器官中的增殖
基于对临床症状的观察,且M4株在细胞水平的增殖未有改变,为了解其在小鼠体内的增殖能力是否改变,本研究采用定量PCR检测病毒感染后急性期和潜伏期神经组织(包括脑、脊髓、三叉神经)及气管组织中的病毒载量。结果表明,M3和M4组小鼠神经和气管组织中病毒载量明显低于McKrae组,且M4组低于M3组;特别是在潜伏期(28 d),病毒在组织中的增殖能力显著低于McKrae组(图3)。
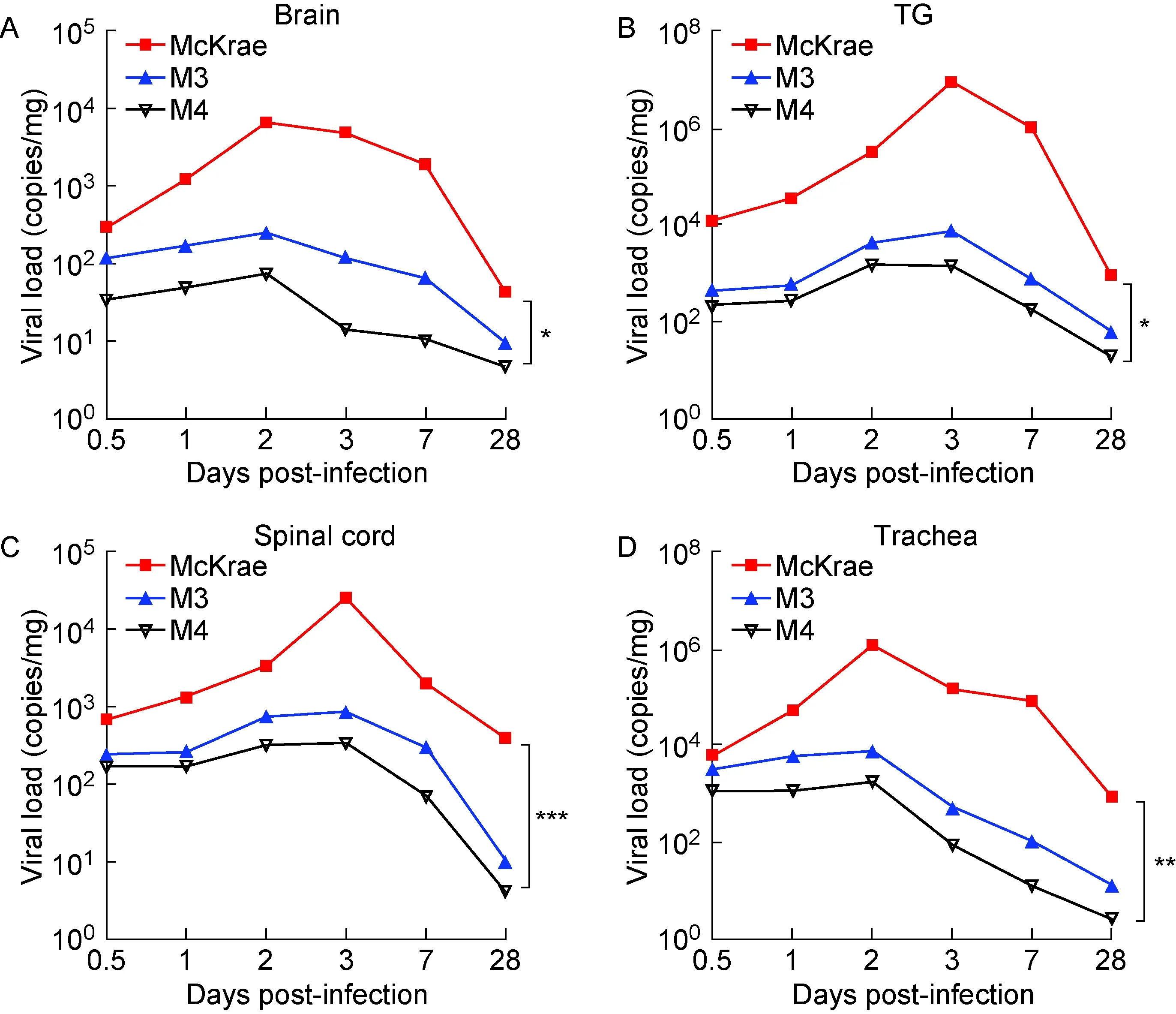
A: Brain. B: TG. C: Spinal cord. D: Trachea.
图3 McKrae、M3、M4株感染小鼠后神经组织及气管中的病毒载量
Fig.3 Viral loads in neural and trachea tissues in McKrae, M3 and M4 groups
2.4 us3基因突变保持了M3株的减毒特征
病毒在感染过程中首先经破损的皮肤或黏膜途径进入机体,然后在上皮细胞内复制,沿神经轴索逆向移动,导致中枢神经系统发生病理损伤。为进一步了解病毒增殖与病理损伤程度之间的关系,本研究对小鼠神经组织(包括脑、脊髓)进行组织石蜡切片及H-E染色。McKrae组小鼠在感染后均出现明显的组织损伤,可观察到脑组织蛛网膜充血,脊髓中见大量胶质小结。M3、M4组小鼠未见明显病理损伤(图4),与病毒在组织中的低增殖一致,提示us3基因的缺失并不影响M3株的减毒特征。
2.5 us3基因突变下调机体炎症反应
病毒侵入机体后,在不同组织中表现出不同的增殖能力并引发炎症反应,其中重要的炎性因子和促炎因子包括肿瘤坏死因子(tumor necrosis factor α,TNF-α)、IL-1β、IL-23和IL-12β。本研究检测小鼠感染48 h后肺、口、鼻、淋巴组织中以上因子的表达情况,发现M4组肺中的TNF-α、口中的IL-1β、鼻中的IL-12β、淋巴结中的IL-23细胞因子表达较McKrae组、M3组显著下降,这与M4株的复制增殖能力降低和病理损伤表现一致,推测us3基因的功能性抑制可下调机体炎症反应(图5)。
2.6 M3、M4株诱导的免疫反应
在M4株诱导炎症反应水平较低的基础上,为进一步了解病毒诱导的特异性细胞免疫,本研究于免疫后28 d、56 d、84 d采集并分离小鼠血清和脾淋巴细胞,检测中和抗体效价及分泌IFN-γ和IL-4的特异性T细胞增殖情况。结果显示,M3、M4株均可诱导小鼠产生阳性血清中和抗体,56 d时效价最高, 且M4株诱导的中和抗体水平较M3株显著升高。28 d、56 d时M4株引起的特异性T细胞反应显著高于M3株,与中和抗体效价趋势表现一致(图6)。以上结果提示,us3基因突变提高了机体的体液免疫和细胞免疫。
2.7 M4株有更强的抑制体内病毒增殖的能力
HSV-1感染具有潜伏性,在适宜条件下可被重新激活,造成机体反复感染。为模拟这一过程,本研究在小鼠初次免疫M3、M4株后第45天再次行McKrae株鼻腔感染,以验证M3、M4株是否具有抑制体内病毒增殖的能力。在感染后的第3天和第7天,取小鼠脏器(如肺、鼻、肝、肾)进行病毒载量检测。结果显示,M3、M4组较对照组病毒载量明显降低,且M4组明显低于M3组。这些结果表明,us3基因突变可能促进对病毒的有效清除及控制能力(图7)。
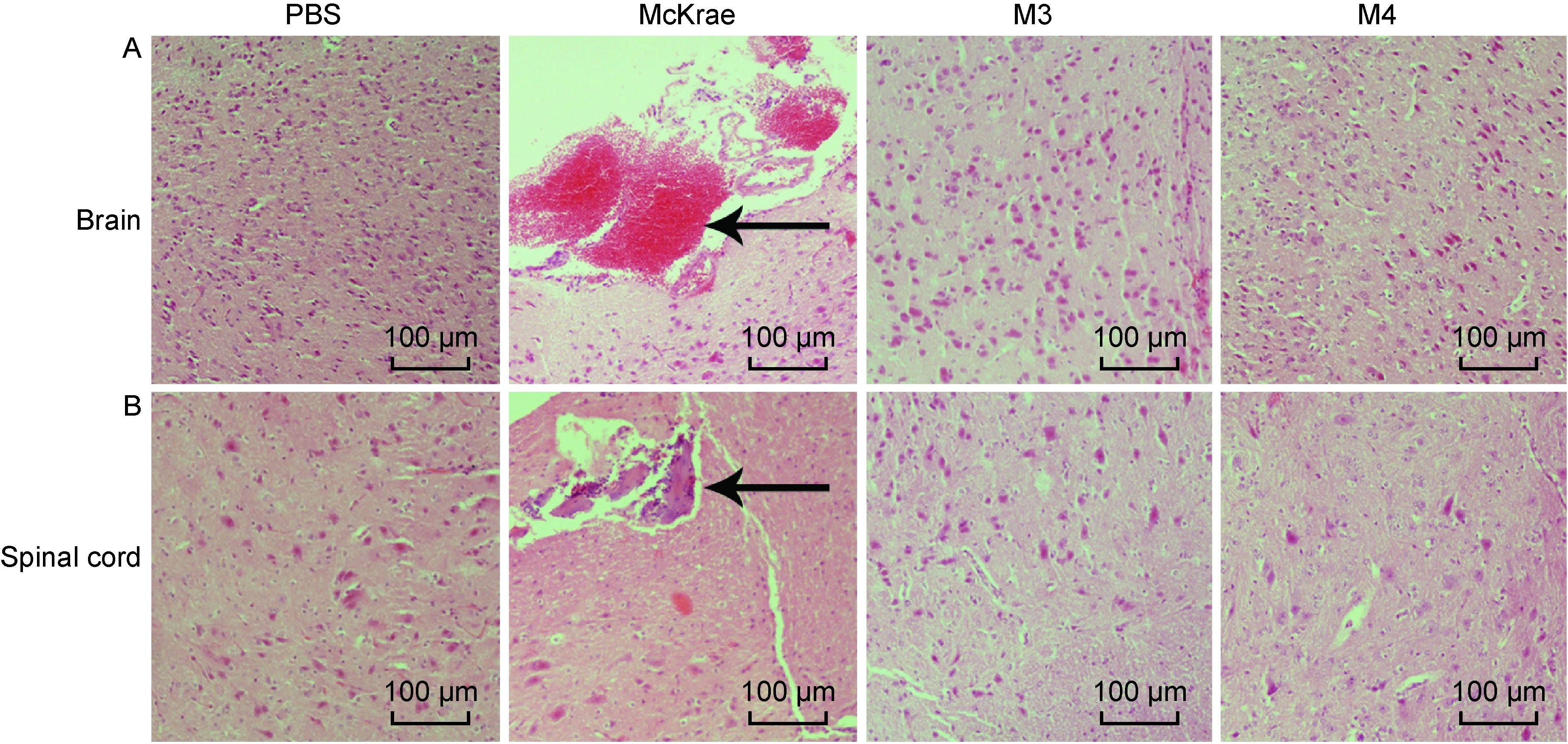
A:Brain. B: Spinal cord.
图4 McKrae、M3、M4株感染小鼠后脑和脊髓的病理检测
Fig.4 Histopathological examinations of the brain and spinal cord in McKrae, M3 and M4 groups

A:TNF-α in Lung. B: IL-1β in Mouth. C: IL-12β in Nose. D: IL-23 in Lymph nodes.
图5 各毒株感染小鼠48 h后肺、口、鼻、淋巴结组织中炎性细胞因子的比较
Fig.5 Comparison of inflammatory cytokines in lung, mouth, nose and lymph node tissues in mice after 48 h of infection
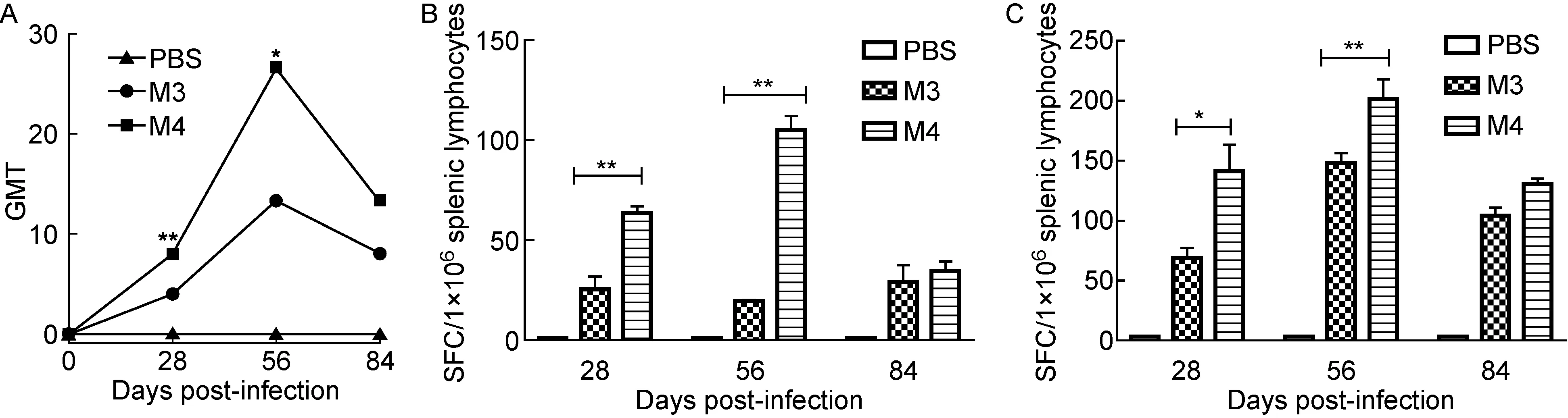
A:Serum neutralizing antibody. B: IFN-γ secretion from spleen T cells. C: IL-4 secretion from spleen T cells.
图6 免疫后小鼠血清中和抗体和脾细胞免疫反应
Fig.6 Serum neutralizing antibodies and spleen cell immune response in mice
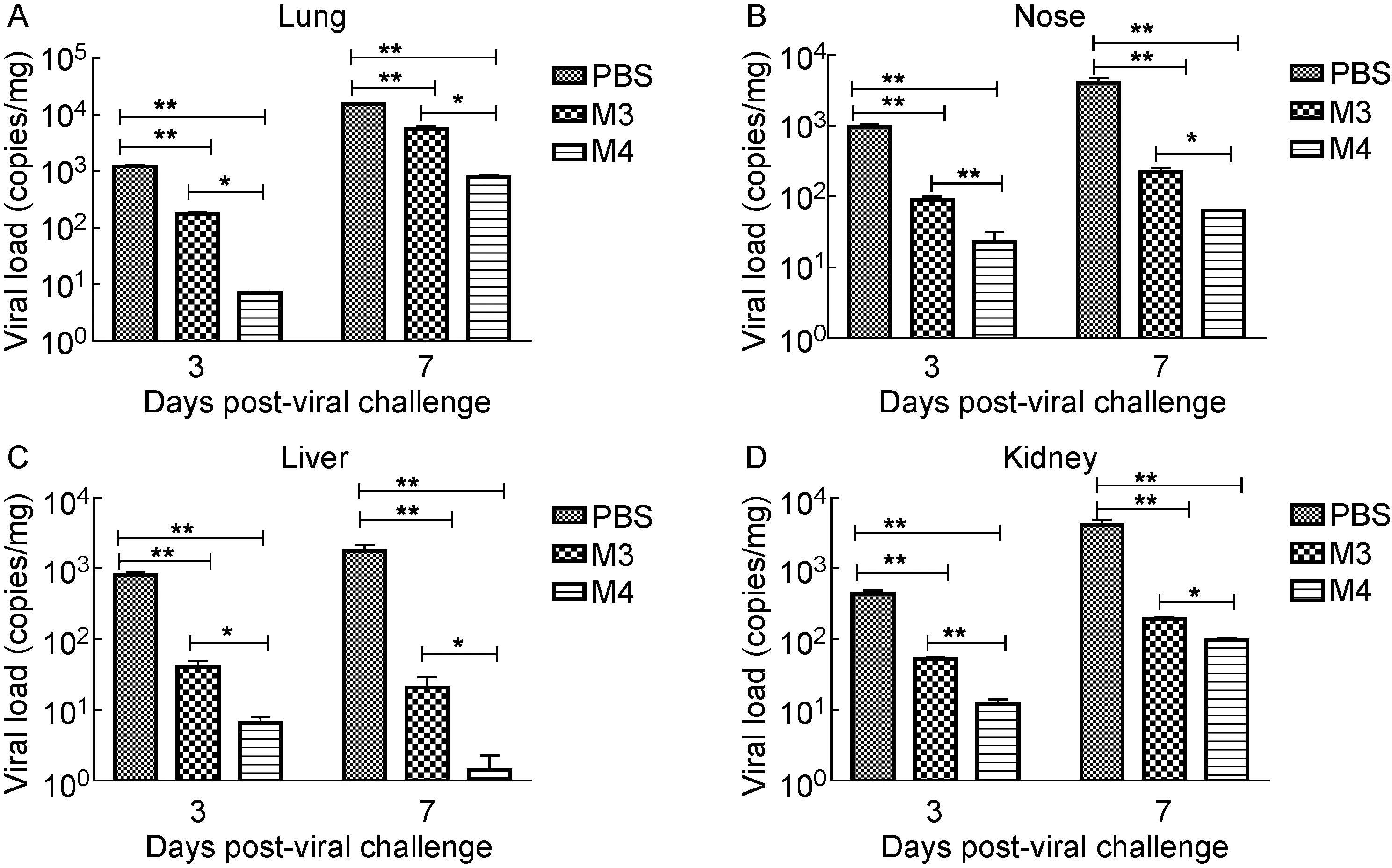
A:Lung. B: Nose. C: Liver. D: Kidney.
图7 免疫小鼠再次感染McKrae株后各组织中病毒载量
Fig.7 Viral loads in tissues of immunized mice reinfected with McKrae strains
2.8 us3基因功能性抑制可增强M4株诱导的体外细胞凋亡
us3基因可通过影响细胞凋亡途径相关因子活性而介导HSV抗宿主细胞凋亡,参与病毒免疫逃逸,且M4株在动物体内表现为低增殖能力。那么缺失us3基因的M4株在体外是否能够诱导细胞凋亡?本研究以MOI=1的HSV-1感染Jurkat细胞,24 h后进行流式细胞术和形态学检测分析。结果显示,与McKrae和M3株相比,M4株引起的凋亡比例显著增高,有统计学意义(图8)。由此推测,us3基因缺失可促进HSV-1对宿主细胞凋亡的抑制作用下降,从而有效控制HSV-1的增殖和扩散。
3 讨论
由于疱疹病毒的复杂性和潜伏性,到目前为止,尚无有效疫苗来预防和治疗单纯疱疹[14]。HSV感染宿主具有两个明显特征:嗜神经性及潜伏感染。神经毒性是指HSV可感染中枢神经系统,在神经细胞中复制而影响神经细胞功能;潜伏感染是指HSV侵犯机体后,可在神经细胞以潜伏状态存在,不能被完全清除,在适当因素刺激后HSV被重新激活而引发疱疹等症状[15]。在深入探讨这些复杂机制及其相互作用关系的过程中,本研究构建了一系列减毒株,包含M3和M4株,M3株的致病性和潜伏能力与McKrae株相比大幅下降[4,8],但改变us3基因对其减毒表型的影响尚需进一步结合其功能加以分析。

A:Stained Jurkat cells. B: Flow cytometry detection of Jurkat cells. C: Comparison of apoptosis in M3, M4 and M groups.
图8 McKrae、M3、M4株感染Jurkat细胞24 h后的凋亡检测
Fig.8 Apoptosis detection after infection of Jurkat cells by McKrae, M3 and M4 strains for 24 h
众所周知,HSV在与宿主的长期进化过程中,能随环境的变化而表现出不同的感染特点。一方面,病毒充分利用宿主的合成系统来实现自我迅速增殖,另一方面能影响和控制宿主细胞凋亡能力,延迟或抑制细胞凋亡,从而维护病毒赖以生存的环境。us3为HSV-1体外增殖的非必需基因,其产物US3蛋白激酶具有多种功能,如抗细胞凋亡、调节宿主免疫反应等[16]。还有研究表明,us3可通过影响细胞凋亡内部途径相关因子的活性而调控细胞凋亡[17]。基于上述分析,本研究在M3株改造的基础上使部分us3基因缺失突变,进一步了解抑制细胞凋亡机制与病毒免疫逃逸特征的相互关系。
用BALB/c小鼠模型系统分析比较McKrae、M3和M4株的致病性、病理及炎性因子,结果显示,M3、M4株的毒力明显低于McKrae株,且M4株比M3株更具有减毒优越性。本课题组前期研究表明,用M3株接种小鼠和恒河猴后,主要组织中病毒均出现一定程度的增殖,尤其是在三叉神经节中保持潜伏状态。本研究中,无论是直接接种还是接种后再次感染McKrae株,M4组在各组织中病毒载量均明显低于M3组。推测us3基因突变后,受感染的细胞可正常进入细胞凋亡程序,增加了病毒被机体免疫系统清除的可能,所以M4组病毒增殖下降,但仍需更多的实验数据来验证。
有研究表明,HSV-1us3基因可通过影响细胞凋亡途径相关因子的活性而介导抗宿主细胞凋亡。此过程中Bax、Bid、Bad是关键调节蛋白,它们均属Bcl家族成员。已有研究报道,US3蛋白激酶可阻断Bad、Bid过表达引起的细胞凋亡,可能与Bad 蛋白的112-Ser、136-Ser磷酸化及Bid过表达有关[18-19]。本研究中,与M3和McKrae株相比,M4株在小鼠体内表现为低水平增殖,推测可能是由于M4株缺失us3基因,其对宿主细胞凋亡的抑制作用下降,使受感染的细胞出现正常凋亡的比例增加,从而导致病毒增殖能力受限。
IFN-α/β作为天然免疫反应中的重要调节者,在病毒感染过程中起非常重要的作用。HSV能在多个环节破坏这一信号通路。体外研究表明,HSV-1us3能限制IFN产生。在IFN处理过的人喉癌上皮细胞HEp-2中,与野生株相比,us3缺陷型HSV-1增殖被显著抑制,且抑制程度与IFN剂量呈正相关。本研究ELISpot实验中,M4株与M3、McKrae株相比,IFN-γ抗原特异性T细胞明显升高,原因可能是M4株缺失us3,导致小鼠体内 IFN-α/β 信号通路得以维持。
综上所述,对编码抑制细胞凋亡分子的HSV-1us3基因进行修饰突变而获得的M4株与M3株相比,表现出更好的减毒表型。虽然本研究仅采用了小鼠模型进行分析,所得结果尚需探讨,但为进一步认识HSV-1us3基因在病毒减毒特征中的作用提供了线索。
