作用于种属差异性表位的细菌α-半乳糖苷酶(EmGalase)的鉴定和研究
2019-07-03郭雅萌侯琳琳沈旦枫邹琳王蕾李天胜孙桂芹陈力
郭雅萌,侯琳琳,沈旦枫,邹琳,王蕾,李天胜,孙桂芹,陈力
1. 复旦大学上海医学院基础医学院教育部、卫健委、医科院医学分子病毒学重点实验室, 上海 200032; 2. 浙江中医药大学医学技术学院, 杭州 310053
异种输血可以有效缓解人源血紧张的现状,是生物医学工程研究追求的方向。研究发现,人体IgG中有1%为抗异种(猪、鼠等)Galα1-3Gal表位的抗体,该抗体仅在人、猿和旧世界猴中发现[1]。由于异种表位的存在,人在接受异种来源血液时,会产生独特的抗Galα1-3Gal反应,这是导致人异种输血超急性免疫排斥反应的主因。针对这一技术难题,目前的解决办法有两种:一是利用基因敲除技术获得缺失Galα1-3Gal表位的工程猪[2-3],二是用α-半乳糖苷酶清除成熟猪红细胞表面的Galα1-3Gal,以缓解抗原抗体反应[4]。
α-半乳糖苷酶是一种常见糖苷水解酶,广泛存在于动物、植物和微生物中,能够水解糖脂和糖蛋白α连接的半乳糖残基,可用于制备Galα1-3Gal阴性猪红细胞。在碳水化合物活性酶数据库(Carbohydrate-Active enZYmes Database, CAZy)中[5],α-半乳糖苷酶属于糖苷水解酶类(glycoside hydrolases, GHs)。目前已知的α-半乳糖苷酶主要分布于GH4、27、36、57、97和110家族。不同家族α-半乳糖苷酶在酶学性质等方面存在差异[6]。虽然α-半乳糖苷酶在医疗、食品与饲料等行业中已有较为广泛的应用,但是目前已见报道的能够修饰猪红细胞表面异种抗原的α-半乳糖苷酶主要有两个:一个来自咖啡豆,属于GH27家族[7];另一个来自脆弱类杆菌,属于GH110家族[4]。来自细菌GH27家族能够修饰猪红细胞表面异种抗原Galα1-3Gal的α-半乳糖苷酶目前未见报道。
脑膜炎败血伊丽莎白金菌(Elizabethkingiameningoseptica,Em)是一种广泛分布于自然界中的革兰阴性菌,可能引起新生儿早产和不发达国家重症监护病房内新生儿脑膜炎[8],以及免疫缺陷成人院内感染(肺炎、心内膜炎、脑膜炎及术后菌血症)[9-10]。2015年末美国威斯康星州暴发了该菌的感染[11]。2011年本实验室从一位收治于重症监护病房的T细胞非霍奇金淋巴瘤的 15岁病人中分离到一株Em,命名为FMS-007。对其完成了完整基因组测序,建立了Em的国际标准基因组序列,该序列可作为Em基因组研究的理想模板[12]。在此基础上,我们对Em展开糖苷酶功能基因组系统分析[13],已发现并报道了糖苷酶有PNGase F-II[14]、cFase I[15]、cXase I等。
本研究的主要内容是对FMS-007中作用于种属差异性表位的α-半乳糖苷酶进行基因克隆、表达和分析。研究发现,该酶属于GH27家族,可用于制备Galα1-3Gal阴性的猪红细胞,为应急状况下的异种输血提供一种可能的工具。该酶被命名为EmGalase。
1 材料与方法
1.1 材料
1.1.1 菌株和细胞FMS-007由本实验室保存,猪红细胞由中国农业科学院上海兽医研究所提供。
1.1.2 仪器和试剂PrimeSTAR®Max DNA Polymerase和DNA Marker DL2000购自TaKaRa公司;isoglobotriose和globoside Gb4购自青岛曙格生物技术有限公司,Pkantigen购自ELICITYLC公司,显色pNP底物购置于英国Carbosynth公司,isolectin B4 (BSI-B4-FITC)购自Sigma-Aldrich公司,1000 Touch梯度PCR仪和Sub-Cell GT水平电泳槽、Mini PROTEAN Tetra垂直电泳槽为美国Bio-Rad公司产品,光学显微镜ECLIPSE为尼康显微公司产品,Legend Micro 17微量台式离心机和NanoDrop 2000微量分光光度计购自Thermo公司。
1.2 方法
1.2.1EmGalase基因的克隆、表达和纯化模板基因组来源于实验室前期工作,即对FMS-007的完整基因组测序,得到一个总大小为 3 938 967 bp的完整图谱。在CAZy数据库的基础上,通过糖苷酶功能基因组学分析发现FMS-007中存在一个GH27家族的α-半乳糖苷酶。以卡那霉素(kanamycin,Kana)抗性的pET28a(+)为载体,选择NdeⅠ和XhoⅠ两个酶切位点,设计上游引物 5′ -TCCATATGATGTTGTTTTCTCAAAAAGC-CAAAC-3′,下游引物5′-CGCTCGAGCTAAT-AAGTCTTCAGAACAATGATA-3′,6×His标签位于蛋白C端,重组质粒命名为pET28a-EmGalase,由金唯智公司对克隆基因进行序列分析。
将测序正确的重组质粒pET28a-EmGalase转化入表达载体——大肠埃希菌感受态细胞BL21(DE3),得到BL21(DE3)-pET28a-EmGalase表达菌,28 ℃ 160 rpm 小量诱导14 h,将诱导后的细胞破碎,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)检测上清液中的蛋白,目的蛋白相对分子质量为 41 600。
将表达菌转接至1 L LB培养基,37 ℃ 200 rpm培养至OD6000.6~0.8,用1 mL 1 mol异丙基硫代半乳糖苷大量诱导表达。以 7 500 rpm转速离心5 min后收获细胞,重悬于60 mL 10 mM的咪唑中。将悬浮的大肠埃希菌细胞高压破碎处理,在4 ℃条件下以 12 000 rpm转速离心25 min,收集上清液中的细胞提取物,将上清液与提前准备好的镍柱在4 ℃条件下充分结合2 h后以400 rpm转速离心2 min。将填料加至空柱中,期间用25 mmol咪唑冲洗2~3次,用1 mL不同浓度(50 mmol、100 mmol、200 mmol、500 mmol)咪唑缓冲液洗脱,并分别收集洗脱液。利用SDS-PAGE选择拥有较纯净目的蛋白的洗脱液,用pH7.4 PBS作为透析液进行透析。每隔6 h换1次透析液,一共4次,收集透析袋中的液体。使用Pierce BCA蛋白定量分析试剂盒测定蛋白浓度。
1.2.2 EmGalase的底物特异性以及酶学性质利用人工合成的14种pNP底物探究EmGalase的α-半乳糖苷酶活性及底物特异性,底物包括pNP-α-D-Gal、pNP-β-D-Lac、pNP-Xylosel、pNP-N-acetyl-α-D-Glc、pNP-β-D-Fuc、pNP-N-acetyl-β-D-Glc、pNP-N-acetyl-β-D-Gal、pNP-α-D-Glc、pNP-α-D-Man、pNP-β-D-Man、pNP-β-D-Gal、pNP-β-L-Fuc、pNP-β-D-Glc、pNP-N-acetyl-α-D-Gal,每种底物的浓度均为10 mmol。反应在96孔板中进行,对照组分别加入5 μL底物和45 μL PBS,实验组分别加入5 μL底物、43 μL PBS和2 μL EmGalase。在37 ℃反应30 min后,分别加入75 μL 1 mol的Na2CO3终止反应,测量OD405用于判断EmGalase与不同底物的反应能力。
按表1制作EmGalase标准曲线,每个体系为60 μL,在pH 7.4 PBS中进行。在37 ℃反应30 min,用75 μL 1 mol的Na2CO3终止反应,酶标仪测量OD405并制作关于OD405和pNP浓度的回归直线。EmGalase的最适pH值实验:每孔加入53 μL pH 7.4 PBS、5 μL 10 mmol的pNP-Gal、2 μL EmGalase,用HCl和NaOH调节pH分别至1、2、3、4、5、6、7、8、9、10、11、12,在37 ℃反应30 min,用 75 μL 1 mol Na2CO3终止反应,测量OD405用于判断EmGalase在不同pH值条件下的反应能力。
表1 pNP浓度梯度
Tab.1 Different gradient concentrations of pNP

ABCDEFGHConcentrations of pNP(mmol)00.015 6250.031 250.062 50.1250.250.51
EmGalase的最适温度实验:每孔加入54 μL pH 7.4 PBS、5 μL 10 mmol pNP-Gal、1 μL EmGalase,分别置不同温度条件下(4、20、30、37、45、55、65、75、85 ℃)反应15 min,用75 μL 1 mol Na2CO3终止反应,测量OD405用于判断EmGalase在不同温度条件下的反应能力。
不同金属离子及化合物对EmGalase的影响:选取96孔板中10个孔,每孔加入1 μL EmGalase、5 μL pNP-Gal、43.5 μL pH6.8 CH3COONH4,1~10孔分别加入0.5 μL浓度为1 mol的 Zn2+、Mn2+、Ni2+、Mg2+、K+、Ca2+、Cu2+、Fe2+及化合物EDTA、SDS,使不同离子或化合物在每孔50 μL反应体系中的终浓度为10 mmol。在37 ℃反应30 min,用75 μL 1 mol的Na2CO3终止反应,测量OD405用于判断EmGalase在金属离子及试剂影响下的反应能力。
EmGalase米氏常数曲线:每孔添加49 μL用PBS稀释的不同浓度(0、0.2、0.4、0.8、1、2、3、4 mmol)的pNP-α-Gal及1 μL 0.25 mg/mL 的EmGalase,在37 ℃反应15 min,用75 μL 1 mol Na2CO3终止反应,测量OD405用于判断EmGalase释放Gal的能力大小。
EmGalase酶切不同寡糖底物的质谱检测: 取10 mmol寡糖底物各1 μL,分别加入1 μL 0.25 mg/mL的EmGalase及9 μL pH4 CH3COOH,37 ℃反应3 h。每个反应产物加200 μL去离子水稀释后,用LTQ Orbitrap XL高分辨串联多级质谱进行检测。
EmGalase酶切不同寡糖底物的D-Galactose kit检测:按照试剂盒的要求准备样品,即每个体系含有2 μL EmGalase,3.11 μL 10 mmol寡糖底物和8.89 μL pH7.4 PBS,37 ℃反应2 h。
按照表2配制检测体系,加样于96孔板,轻混匀。30 ℃作用3 min后,检测OD340,记为A1。之后每孔加入2 μL β-GalDH/GalM后,轻混匀,30 ℃放置6 min后读取OD340,并记为A2。随后每隔 1 min读取OD340至读数稳定。样品μg=ΔAsample/ΔAstandard × 4 μg standard。
表2 试剂盒检测体系
Tab.2 Kit detection system
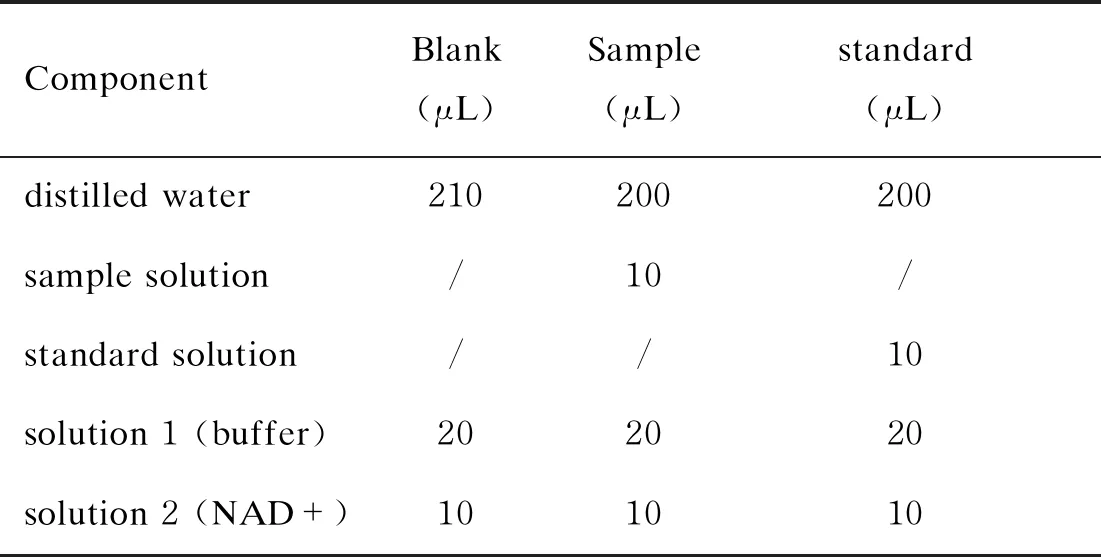
ComponentBlank (μL)Sample (μL)standard (μL)distilled water210200200sample solution/10/standard solution//10solution 1 (buffer)202020solution 2 (NAD+)101010
1.2.3 EmGalase对猪红细胞Galα1-3Gal表位的作用将采集的猪血与CPDA-1血液保存液按照10∶1.5比例混合。4 000 rpm离心7 min并去除上清液和白细胞层,余下红细胞与CPDA-1按照 10∶1.5比例混合,重悬红细胞。取1 mL 10%的红细胞悬液,1 500 rpm离心2 min,用PCBS(60 mmol NaH2PO4, 25 mmol NaCitrate, 75 mmol NaCl)洗涤2次,并调至40%压积备用。
显微镜镜检:EmGalase酶切猪红细胞的镜下观察实验按照表3加样。
表3 猪红细胞的酶切体系(镜检)
Tab.3 Enzyme digestion system of porcine erythrocytes (Microscopic examination)

Component1240% porcine erythrocytes (μL)4040PCBS(μL)40/EmGalase(μL)/40
室温反应1 h后,将红细胞 1 500 rpm离心2 min,pH7.4 PBS洗涤2次,并调至10%压积。取10 μL红细胞与2 μL BSI-B4混合于载玻片上,显微镜(10×40)下观察。
流式细胞仪检测:按照表4设置不同的组别进行酶切实验。
表4 猪红细胞的酶切体系(流式检测)
Tab.4 Enzyme digestion system of porcine erythrocytes (flow cytometry)

Component12340% porcine erythrocytes (μL)404040PCBS(μL)4040/EmGalase(μL)//40
室温反应1 h,期间液体保持混匀状,无沉降。反应后每管加200 μL pH7.4 PBS,1 500 rpm离心2 min,洗涤2~3次,200 μL pH 7.4 PBS重悬,取30 μL重悬液,加500 μL 0.1%戊二醛固定不超过15 min,pH 7.2 PBS洗涤2~3次,200 μL pH 7.2 PBS重悬。BSI-B4-FITC按表5进行分组添加。
表5 各组别的凝集素处理
Tab.5 BSI-B4-FITC treatment in each group
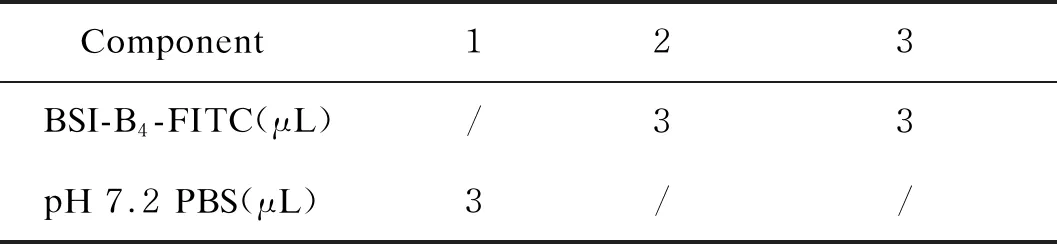
Component123BSI-B4-FITC(μL)/33pH 7.2 PBS(μL)3//
避光反应1 h,期间液体保持混匀状,无沉降。反应后用pH 7.2 PBS洗2~3次,稀释到一定细胞数后,用FACSCalibur流式细胞仪(美国BD公司生产)进行荧光检测。
1.2.4 EmGalase对人B型红细胞Galα1-3(Fucα1-2)Gal表位的作用取1 mL 10%的B型红细胞悬液置1.5 mL EP管中,1 500 rpm离心 2 min,去上清液,PCBS洗涤2次,调至40%压积。EmGalase对B型红细胞修饰的实验按表6配制反应体系。室温反应1h后,将红细胞用pH7.4 PBS以 1 500 rpm转速离心2 min,洗涤2次后,将红细胞调至10%压积。取10 μL红细胞与2 μL 抗B型抗原抗体混合于载玻片上,显微镜(10×40)下观察。
表6 人B型红细胞的酶切体系
Tab.6 Enzyme digestion system of human B blood group red blood cells

Component1240% B-type red blood cell (μL)4040PCBS(μL)40/EmGalase(μL)/40
2 结果
2.1 EmGalase基因的克隆、表达和纯化
借助CAZy数据库对FMS-007糖苷酶进行分析,发现了一个GH27家族的α-半乳糖苷酶EmGalase。进化树分析发现,EmGalase与已报道的两个可以修饰猪红细胞的酶(Coffea arabica GH27和 Bacteroides fragilis NCTC 9343 GH110)有显著差异(图1)。EmGalase基因序列长为 1 104 bp,测序鉴定重组质粒构建成功后,将重组质粒pET-28a+-EmGalase转化至BL21(DE3)中诱导表达。纯化后的EmGalase相对分子质量为 41 600,在SDS-PAGE中显示为单一条带,纯度在95%以上(图2)。纯化的蛋白浓度为1~2 mg/mL(Pierce BCA蛋白定量分析试剂盒测定)。
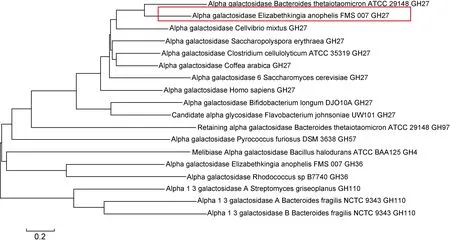
图1 EmGalase与代表性α-半乳糖苷酶的系统发生树分析
Fig.1 Phylogenetic tree of EmGalase in representative alpha galactosidase
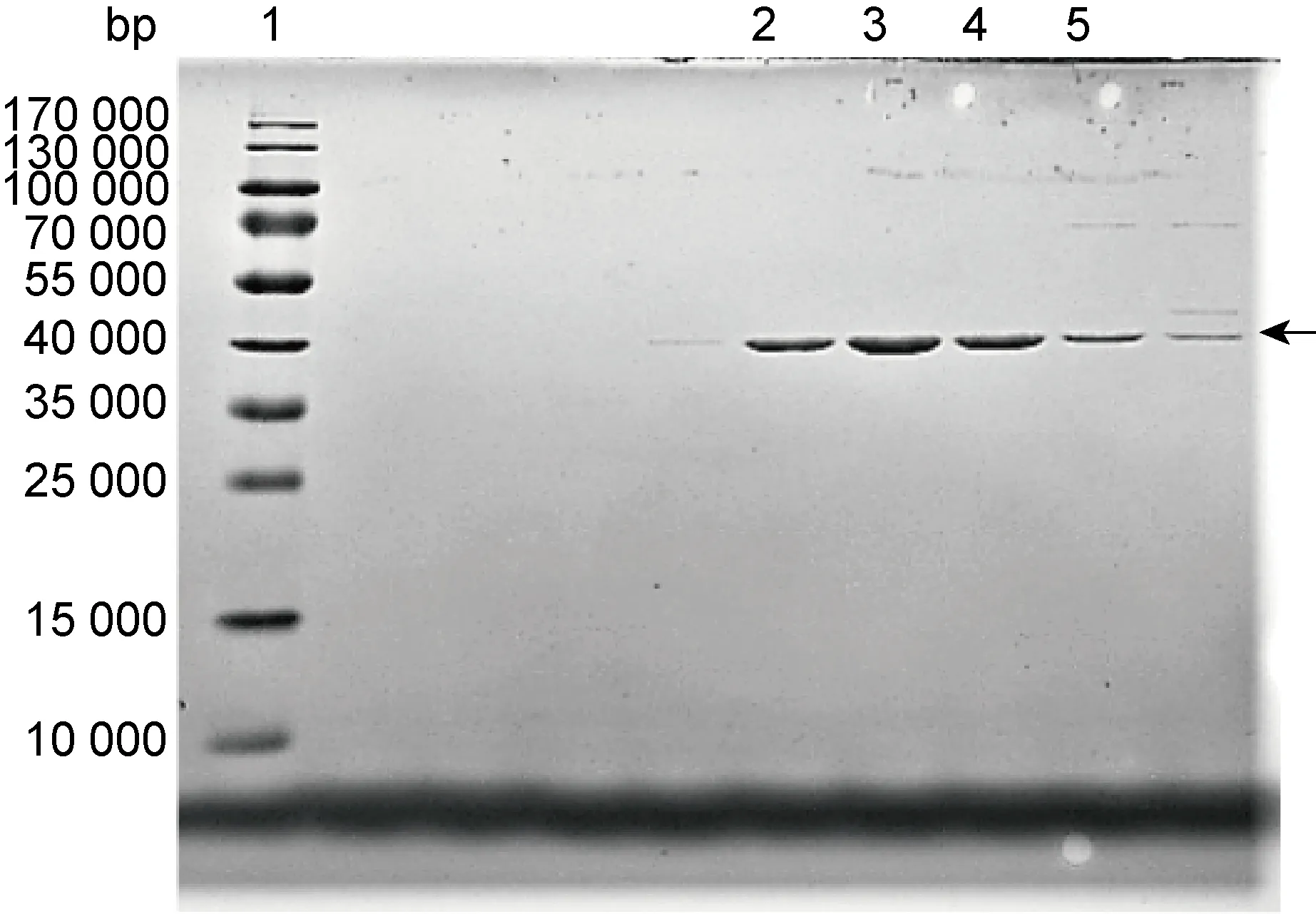
Lane 1: PageRuler Prestained Protein Ladder. Lanes 2, 3, 4 and 5: EmGalase eluted with different concentrations of imidazole.
图2 EmGalase纯化及SDS-PAGE分析
Fig.2 SDS-PAGE analysis of purified EmGalase
2.2 EmGalase的酶学性质
为验证EmGalase是否具有α-半乳糖苷酶活性,我们用纯化的EmGalase处理人工合成的pNP单糖底物。结果显示EmGalase可水解pNP-α-Gal,但对其他底物无反应性,提示EmGalase是具有α-Gal特异性的糖苷水解酶(图3)。EmGalase的催化常数Kcat为2.17 s-1,米氏常数Km为0.22mmol,Kcat/Km为9.86 L/s·mmol,Vmax为0.19 μmol/s(图4)。
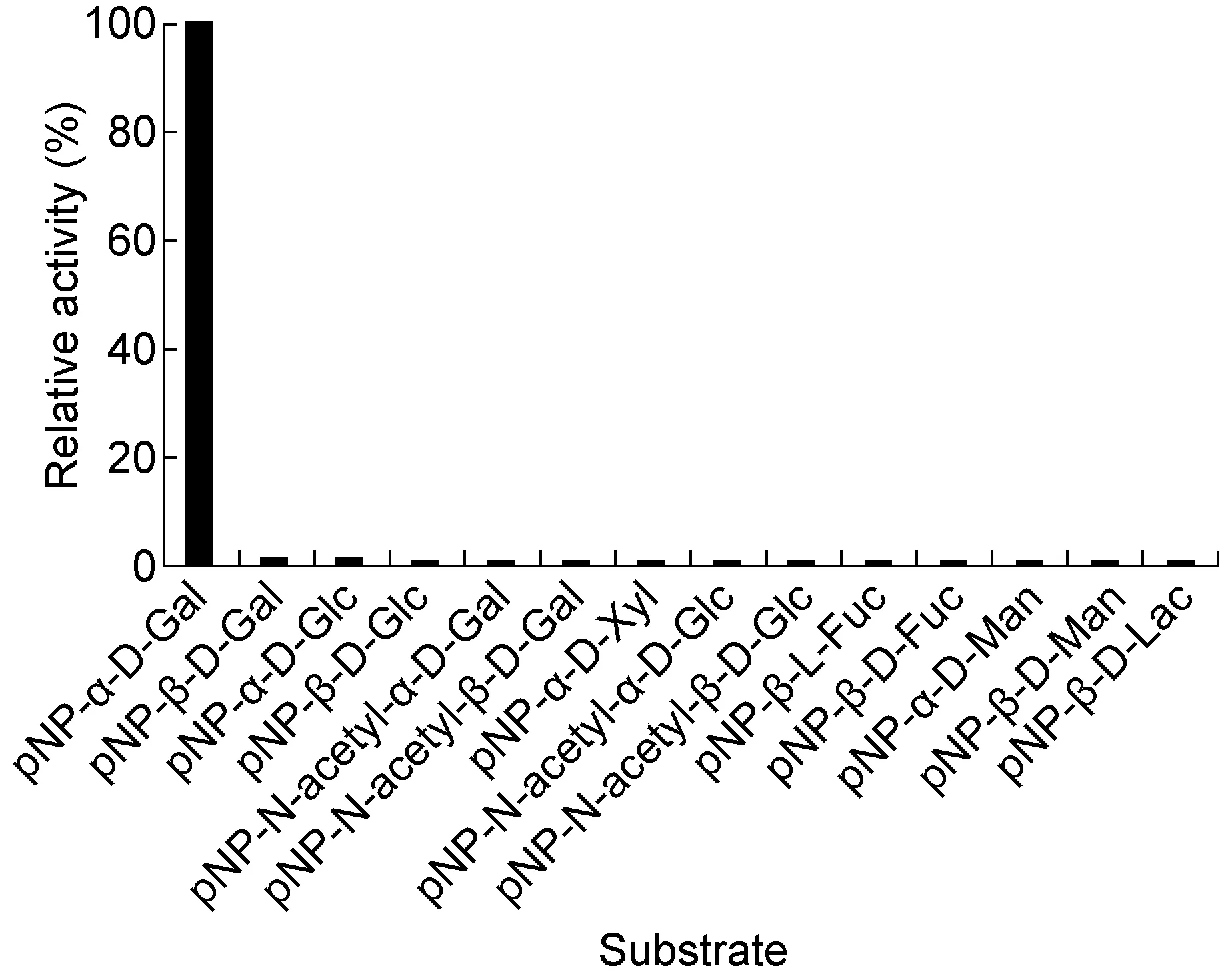
图3 EmGalase与pNP底物的反应
Fig.3 The reaction between EmGalase and pNP substrate
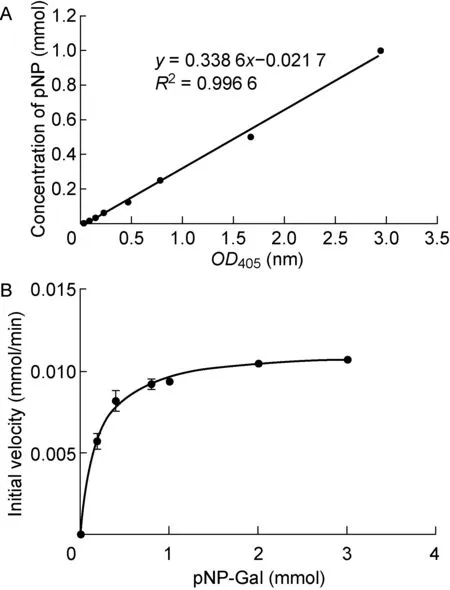
A:Standard curve. B: Michaelis constant curve.
图4 EmGalase反应的标准曲线与米氏常数曲线
Fig.4 Standard curve and Michaelis constant curve related to EmGalase
EmGalase在pH3.0~8.0均表现出较高的反应活性(图5A),活性反应的适宜温度区间为4~45 ℃(图5B)。与对照相比,在相同反应条件下另外加入10 mmol浓度的金属离子时,Zn2+、Mn2+、Ni2+、Mg2+、K+和Ca2+对EmGalase的半乳糖苷酶活性无明显影响,而Cu2+和Fe2+对酶活性有一定程度的抑制作用(表7)。
表7 金属离子和化合物对EmGalase反应活性的影响
Tab.7 Effect of ions and compounds on EmGalase
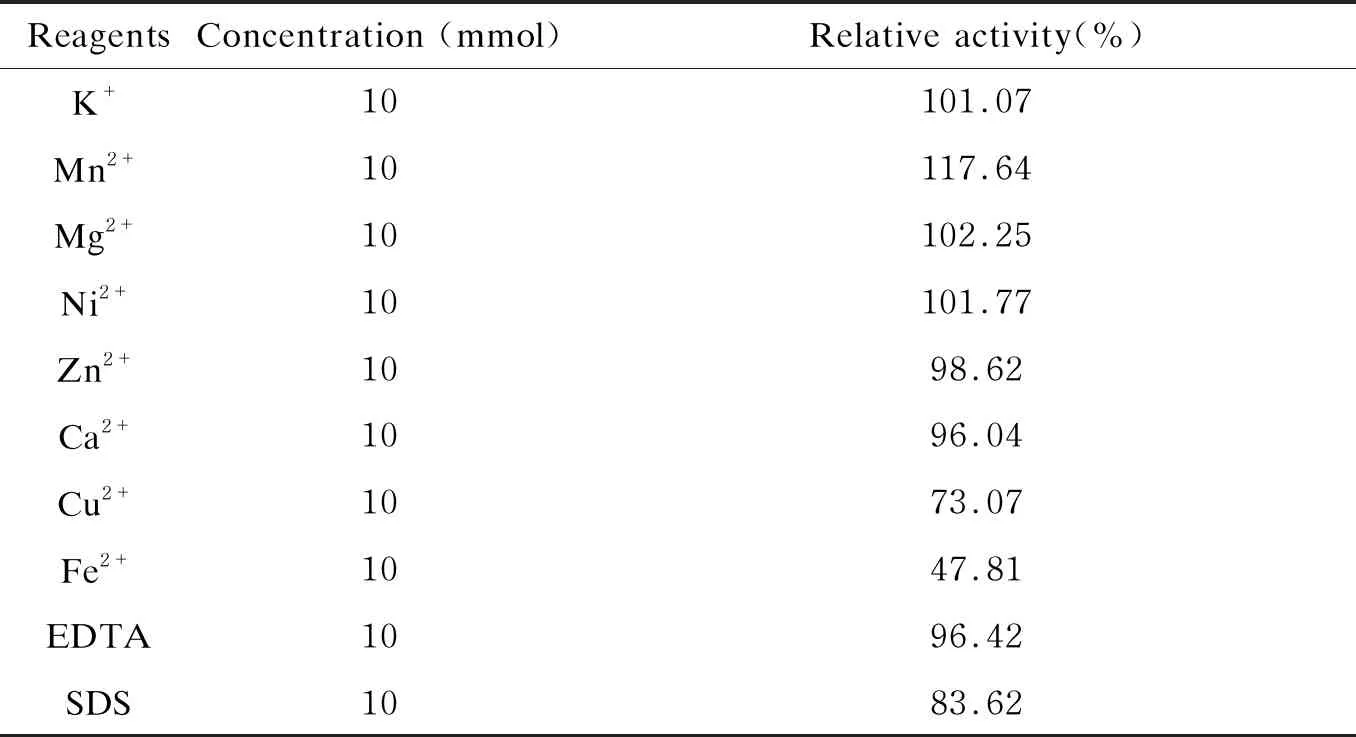
ReagentsConcentration (mmol)Relative activity(%)K+10101.07Mn2+10117.64Mg2+10102.25Ni2+10101.77Zn2+1098.62Ca2+1096.04Cu2+1073.07Fe2+1047.81EDTA1096.42SDS1083.62
为了确认EmGalase所酶切的α-糖苷键特性,我们用该酶处理不同连接方式的寡糖,利用质谱和试剂盒分析反应产物。
质谱结果显示,EmGalase能够酶切直链末端α-1,3、1,4、1,6连接的半乳糖。在酶切Galα1-3Galβ1-4Glc三糖的实验中,对照组使用高温失活EmGalase,检测到m/z 527.16处的分子离子峰,其表示该三糖的钠加合物。通过EmGalase处理后该峰消失,在m/z 365.11和203.05处出现两个强质量离子峰,表示有Galβ1-4Glc二糖的钠加合物和单糖Gal的钠加合物(图6A)。在对Galα1-4Galβ1-4Glc三糖进行处理时也得到了类似的结果,EmGalase使得三糖的m/z 527.16峰转变为二糖的m/z 365.11和单糖的m/z 203.05(图6B)。在使用蜜二糖Galα1-6Glc作为底物并用高温失活EmGalase进行对照实验时,可以观察到m/z 365.11的钠加合物;当用EmGalase处理之后,二糖峰消失,转变为m/z 203.05 Gal和Glc混合的单糖峰(图6C)。上述结果提示,EmGalase既能酶切直链末端α-1, 3连接的半乳糖,又能酶切α-1,4和α-1,6连接的半乳糖(图6)。
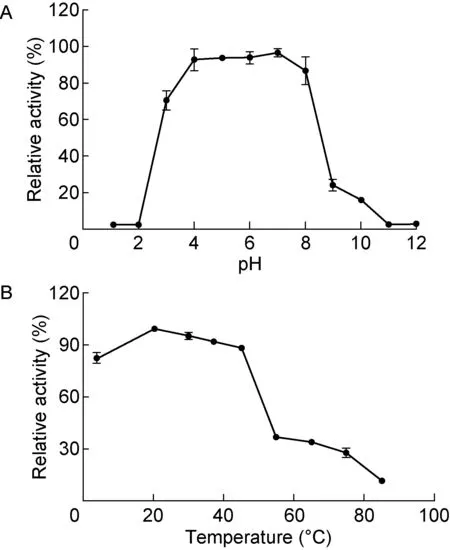
A:EmGalase optimum pH. B: EmGalase optimum temperature.
图5 EmGalase最适pH和最适温度
Fig.5 EmGalase’s optimum pH and optimum temperature
对水解后的单糖底物进行分析(D-Galactose kit)发现,在相同反应条件下,EmGalase能够不同程度地水解直链末端α-1,3、1,4、1,6Gal,实验中未检测到EmGalase对 α-1,4连接的半乳糖寡糖的酶切活性(表8)。
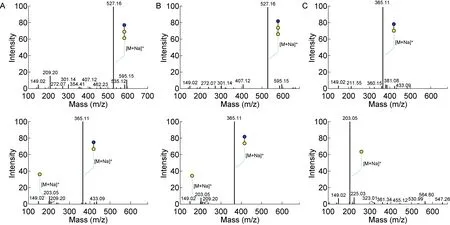
A:Before and after EmGalase digestion of Galα1-3Galβ1-4Glc(isoglobotriose). B: Before and after EmGalase digestion of Galα1-4Galβ1-4Glc(Pkantigen). C: Before and after EmGalase digestion of Galα1-6Glc(melibiose).
图6 EmGalase处理寡糖底物后产物的质谱检测
Fig.6 Mass Spectrometric Detection of Oligosaccharide Substrate digested by EmGalase
表8 EmGalase对不同寡糖底物的反应性
Tab.8 EmGalase reactivity to oligosaccharide substrates

SubstrateRelative activity(%)Gal-α-pNP96.67Galα1-3Galβ1-4Glc(isoglobotriose)48.56Galα1-4Galβ1-4Glc(Pk antigen)58.85Galα1-6Glc(melibiose)81.85GalNAcβ1-3Galα1-4Galβ1-4Glc (globoside Gb4)ND
ND: means not detectable.
2.3 EmGalase对猪红细胞Galα1-3Gal表位的作用
在PCBS溶液中,用EmGalase处理猪红细胞表面Galα1-3Gal表位,并用特异性结合末端α-Gal的凝集素BSI-B4进行检测。结果显示,未经酶解处理的猪红细胞与BSI-B4发生强凝集反应,产生大小不一的团块;而经EmGalase处理后的猪红细胞与BSI-B4混合后,多个视野观察下未见任何凝集现象。结果提示EmGalase能够有效清除猪红细胞表面异种Galα1-3Gal表位。
为了进一步证实EmGalase的清除是否彻底,我们用BSI-B4-FITC进行检测。结果显示,在经过酶切处理前,由于猪红细胞表面存在大量的末端Galα1-3Gal,因此会与BSI-B4-FITC结合并检测到很强的荧光信号。而经EmGalase酶切处理后,猪红细胞与BSI-B4-FITC失去结合作用,其信号与无荧光的细胞对照信号基本一致,表明在实验条件下EmGalase能以95%以上的效率清除猪红细胞表面Galα1-3Gal表位(图8)。
2.4 EmGalase对人B型红细胞Galα1-3(Fucα1-2)Gal表位的作用
B型红细胞表面B抗原糖链末端存在Galα1-3(Fucα1-2)Gal表位[16],该表位上的末端α-Gal可被已报道的两个α-半乳糖苷酶清除。在PCBS溶液中,用EmGalase酶切处理人B型红细胞后,再用抗B血型抗原的单克隆抗体进行检测。结果显示,没有EmGalase处理的B型红细胞与抗B抗原抗体发生强凝集反应,产生大小不一的团块;而经EmGalase处理后的人B型红细胞与抗B抗原抗体混合后,在多个视野下仍然可观察到凝集现象(图9)。提示EmGalase对人B型红细胞上的Galα1-3(Fucα1-2)Gal表位无作用(不同酶用量及反应条件下均无效果,结果未显示)。
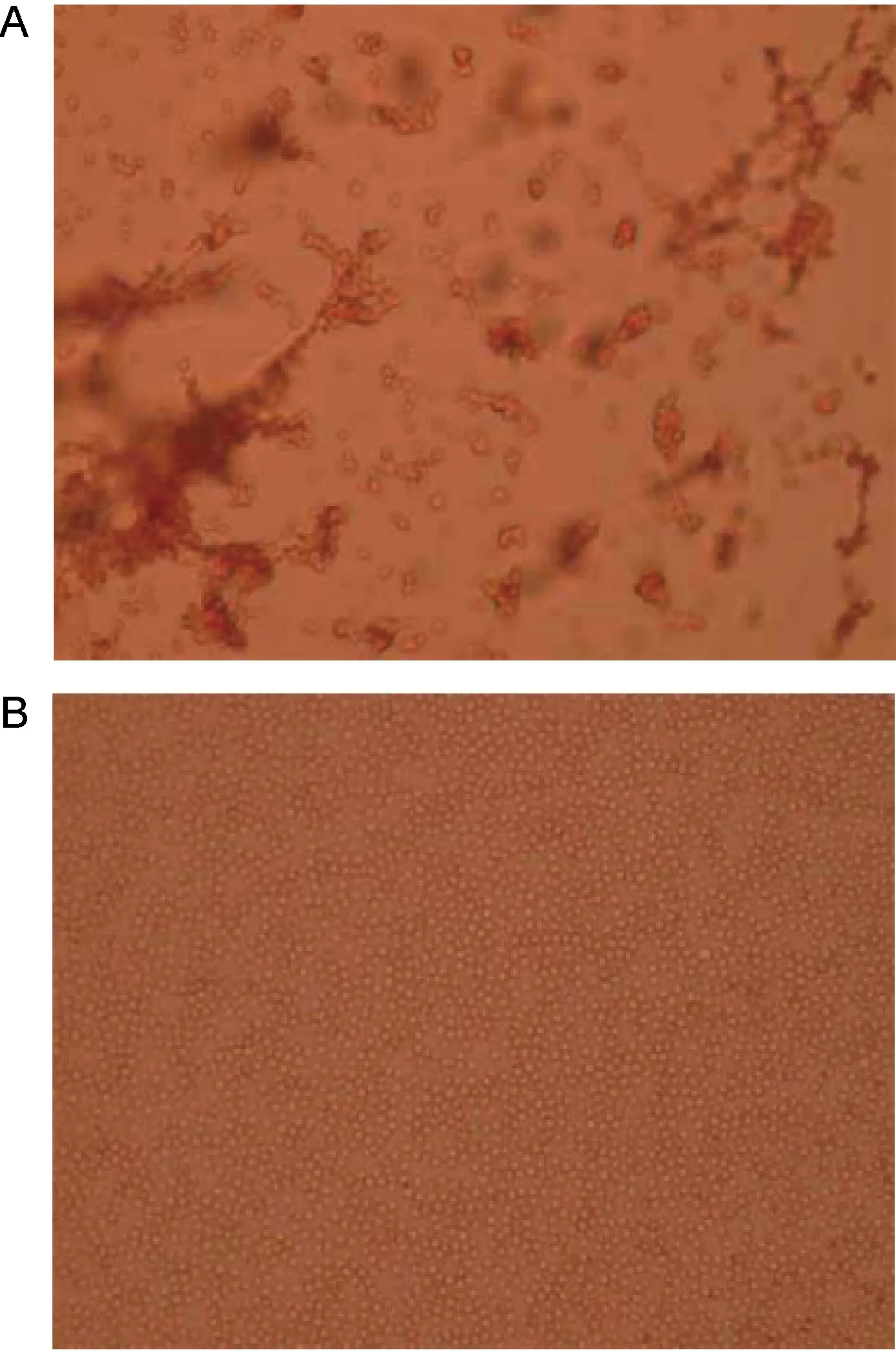
A:Untreated porcine red blood cells together with BSI-B4. B: EmGalase-treated porcine erythrocytes are associated with BSI-B4.
图7 EmGalase对猪红细胞Galα1-3Gal介导凝集反应的影响(10×40)
Fig.7 Effect of EmGalase treatment on porcine erythrocytes Galα1-3Gal mediated agglutination (10×40)
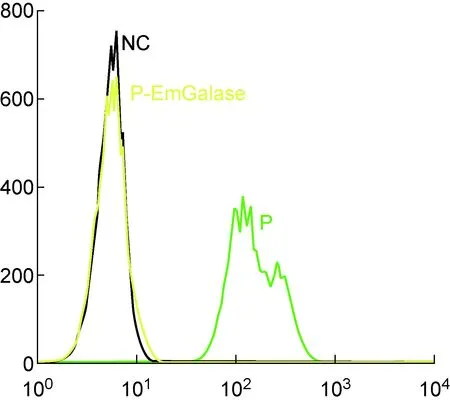
NC: non-specific control. P: Untreated porcine red blood cells together with BSI-B4. P-EmGalase: EmGalase-treated porcine erythrocytes are associated with BSI-B4.
图8 流式细胞术检测EmGalase对猪红细胞Galα1-3Gal的酶切活性
Fig.8 Flow cytometry to detect EmGalase activity on porcine erythrocytes Galα1-3Gal
3 讨论
α-半乳糖苷酶常见于植物、动物和微生物中,而 此前未有关于Em的α-半乳糖苷酶报道。
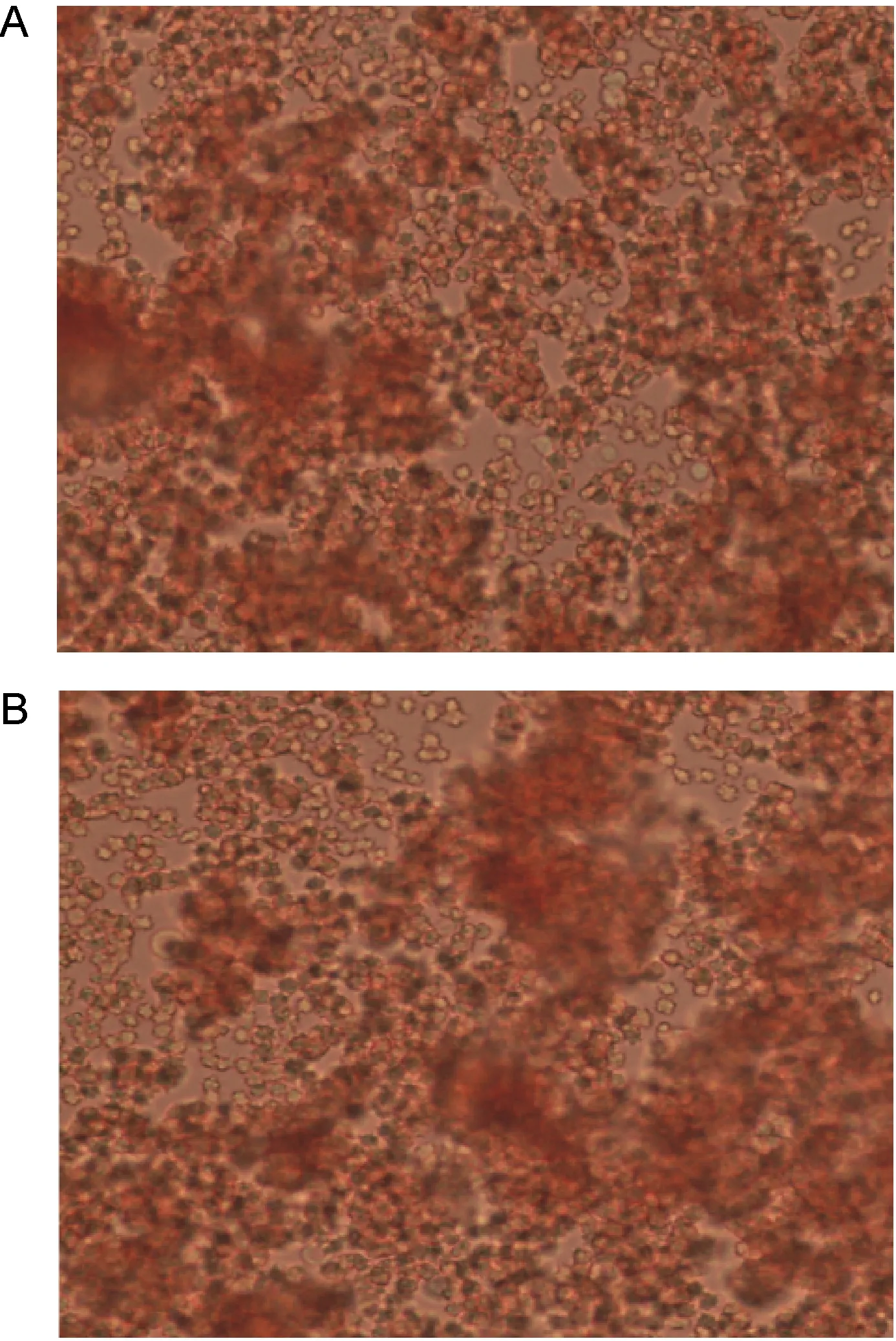
A:Untreated B-type red blood cells together with B antibody. B: EmGalase-treated B-type red blood cells together with B antibody.
图9 EmGalase对人B型红细胞Galα1-3(Fucα1-2)Gal介导的凝集反应的影响(10×40)
Fig.9 Effect of EmGalase treatment on human B red blood cell Galα1-3(Fucα1-2)Gal mediated agglutination (10×40)
EmGalase属于GH27家族,与GH4、GH36、GH57、GH97和GH110家族的α-半乳糖苷酶在进化上有着明显的差异。以pNP-α-Gal为底物,该酶在pH3.0~8.0之间都有较高的活性,尤以pH7.0时最优;反应温度在4~45 ℃,以20 ℃时的反应效果更好。EmGalase的反应pH值和温度范围较其他来源的同族半乳糖苷酶更广泛[6],最适反应条件温和,可以适应不同处理条件的要求。除铜离子和亚铁离子之外,其他常见金属离子的存在并不会影响EmGalase的活性。
在实验条件下,EmGalase能够以>95%的效率清除猪红细胞表面Galα1-3Gal表位,但对B型红细胞表面相似的Galα1-3(Fucα1-2)Gal抗原不起作用。EmGalase是第1个细菌来源可以作用于猪红细胞表面Galα1-3Gal表位的GH27家族α-半乳糖苷酶。2003年,Wang等用植物咖啡豆来源的GH27家族α-半乳糖苷酶修饰猪红细胞表面Galα1-3Gal表位[17]。2012年,Liu等报道脆弱类杆菌中α-半乳糖苷酶也能够作用于猪红细胞,属GH110家族。这两个酶存在共同的隐患是它们也能够清除存在于人类红细胞上B抗原Galα1-3(Fucα1-2)Gal的末端α-Gal[18-20]。与之相比,EmGalase专一性处理猪红细胞表面的异种抗原,将会降低在应急情况下异种输血中可能存在的不确定性。
事实上,末端半乳糖基化不仅是一种常见的免疫原,它在细菌的感染过程中也起着重要作用。革兰阴性菌脂多糖(lipopolysaccharides, LPS)由脂质A、核心多糖和O抗原组成[21]。研究表明,在以肺炎克雷伯菌为代表的一些细菌中,LPS的O抗原上存在末端α-1,3Gal结构[22-23]。这一结构在细菌感染过程中所起的作用有待进一步探究,EmGalase的酶切活性将为研究该过程提供一种工具。研究表明,在肾脏和肠道中存在末端α-1,4Gal,该结构可能成为志贺菌所产生的志贺毒素特异性黏附作用的靶点[24],由此进入细胞产生毒素作用。EmGalase处理靶细胞是否能够阻断病原体的感染也是一个可能的研究方向。
综上所述,本研究克隆并表达了Em中GH27家族的α-半乳糖苷酶,发现其反应条件温和,可作为工具酶有效清除猪红细胞表面半乳糖相关的异种抗原,为应急情况下的异种输血提供一种新的途径。该酶在外源细胞与宿主相互作用中的应用值得进一步关注和研究。
