Ras/Raf/MEK/Erk通路在慢性高原病骨髓红系细胞中的作用及SAHA对其抑制效果的研究
2019-07-02冯萍珍冀林华
冯萍珍 冀林华
(青海大学附属医院检验科,青海 西宁 810001)
慢性高原病(CMS)是一种高原环境下机体长期慢性缺氧继发的红细胞增多和细胞缺氧为特点的疾病。该病的病理生理机制尚不明确,有研究[1-3]认为,因机体的长期慢性缺氧诱发的低氧诱导因子(HIFs)表达的增加,可促进促红细胞生成素(EPO)和血管内皮生长因子(VEGF)等细胞因子的表达,最终导致CMS的发生。然而,有学者[4]认为,EPO等细胞因子的上升水平与CMS发病之间缺乏有效的直接证据,这表明CMS的发病可能还有其他因素参与其中。Ras/Raf/MEK/Erk通路是真核细胞生物体内重要的信号通路之一,该通路可将细胞外刺激信号转导至细胞及其核内,并引起细胞生物学反应[5-7]。目前该通路是否参与CMS发病过程尚无定论,笔者拟通过对CMS患者骨髓红系细胞内的节点基因及蛋白的定量分析予以明确。此外,有研究[8]发现,组蛋白乙酰化状态对细胞的增殖存在显著相关,组蛋白去乙酰化酶抑制剂可有效降低细胞内的组蛋白乙酰化水平,从而降低细胞的增殖程度。SAHA是第二代组蛋白去乙酰化酶抑制剂,具有更高的去乙酰化活性[9]。笔者采用SAHA干预CMS患者骨髓红系细胞,以明确其对红系细胞过度增殖的抑制情况。
1 资料与方法
1.1一般资料 选择2016年12月至2017年12月我院血液科收治的明确诊断为CMS患者23例为观察组,其中男15例,女8例,年龄31~48岁,平均(37.21±5.03)岁。另选择同期年龄匹配的健康体检者10名为对照组。纳入标准:符合2004年版国际青海标准有关CMS的诊断标准。受试者均征得本人知情同意,本研究获我院医学伦理委员会批准。排除标准:原发性红细胞增多症;慢性肺源性心脏病;慢性阻塞性肺病;其他原因导致的慢性缺氧性疾病等。两组受试者一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2试剂与仪器 试剂:IMDM培养基(购自美国HyClone公司),CD71、CD235a抗体(购自德国MiltenyiBiotec公司),Trizol试剂(购自美国Invitrogen公司),RNA提取试剂盒(购自德国MiltenyiBiotec公司),人Ras-GTP ELISA试剂盒(购自美国RB公司),鼠抗人p-ERK1/2单克隆抗体(购自德国MiltenyiBiotec公司),鼠抗人p-BRaf单克隆抗体(购自德国MiltenyiBiotec公司),鼠抗人p-MEK单克隆抗体(购自德国MiltenyiBiotec公司),鼠抗人GAPDH单克隆抗体(购自德国MiltenyiBiotec公司),HRP标记的羊抗鼠IgG(购自江苏碧云天公司),引物合成(上海生工公司)。仪器:ABI 7300型实时荧光PCR仪(购自美国ABI公司),流式细胞仪(购自美国Beckman Coulter公司),SYSMEX XS-500i全自动五分类血球计数仪(购自日本SYSMEX公司)。
1.3方法
1.3.1骨髓有核红细胞的采集、分离与培养 征得受试者同意后,于髂后上嵴抽取患者骨髓液10 mL,采用淋巴细胞分离液分离骨髓单个核细胞。采用CD71及CD235a抗体磁珠分离骨髓有核红细胞。将分选的有核红细胞富集至1×106个/L并培养于IMDM体系中,于37 ℃、5% CO2、3% O2的低氧环境下培养72 h。将观察组患者所培养细胞分为5组,取对数生长期细胞以2×104个/mL的密度接种于 96 孔板 ,每孔100 μL细胞悬液。SAHA 处理浓度分别为0.5、1、2、3、5 μmol/L。每一个药物浓度设3个复孔,分别处理12、24、48 h,每个时相点结束后加0.5% MTT,4 h后加入细胞裂解液。次日于540 nm波长下读取各孔OD值。按下列公式计算细胞生存率。细胞存活率 =(加药组细胞 OD平均值/正常细胞 OD平均值) ×100%。
1.3.2骨髓有核红细胞分泌Ras-GTP水平的测定 收集有核红细胞培养液上清(800 r/min离心),采用ELISA法绘制标准曲线并量化Ras-GTP分泌水平,具体操作步骤参照试剂盒说明书进行。
1.3.3骨髓有核红细胞中BRaf、MEK、ERK1、ERK2Mrna水平的检测 收集培养后的有核红细胞,采用TRIZOL试剂分解细胞并提取总RNA。采用逆转录试剂盒合成Cdna。以β-catin为内参基因,采用ABI 7300型PCR仪将转录成的cDNA在50 ℃、2 min,95 ℃、15 min,95 ℃、15 s,60 ℃、1 min,共40个循环条件下扩增。每次循环均设空白对照,计算目的基因 mRNA的相对表达量,每组重复 3 次取均值。PCR产物采用2%琼脂糖凝胶电泳分析并鉴定。基因相对表达量采用△△Ct法进行计算,△△Ct=(Ct目的基因-Ctβ-catin)观察组-(Ct目的基因-Ctβ-catin)对照组,观察组标本相对表达量为2-△△Ct。引物序列见表1。

表1 引物序列
注:F为正义链;R为反义链。
1.3.4骨髓有核红细胞中BRaf、MEK、ERK1、ERK2蛋白水平的检测 采用Western blot法检测,各组培养的有核红细胞加细胞裂解液后取总蛋白50 μL样本进行变性SDS-聚丙烯酰胺凝胶电泳。电泳结束后转移至NC膜上过夜;漂洗后,4 ℃下于NC膜上加入一抗,结合4 h;再漂洗,分别与各自二抗结合,4 ℃,2 h。结束后采用ECL显影试剂盒显影。预染Marker显示蛋白质分子量,利用Quantity One软件等高线测量法检测,不同时点各组实验重复3次,取平均值。
1.3.5外周血血红蛋白(Hb)、红细胞比容(HCT)及血氧饱和度检测 采用SYSMEX XS-500i全自动五分类血球计数仪检测受试者外周血Hb、HCT水平。采用指套式电传感器检测受试者血氧饱和度。
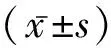
2 结 果
2.1两组骨髓有核红细胞Ras-GTP、BRafmRNA、MEK mRNA及ERK1/2 mRNA表达水平间差异 骨髓有核红细胞Ras-GTP的表达水平采用ELISA方法检测结果显示,观察组患者骨髓有核红细胞Ras-GTP水平(22.21±4.31) pg/mL较对照组(18.35±5.08) pg/mL显著增高(t=5.973,P<0.01)。骨髓有核红细胞BRafmRNA、MEK mRNA及ERK1/2 mRNA表达水平采用qRT-PCR方法进行检测,统计发现,观察组患者骨髓有核红细胞BRafmRNA、MEK mRNA及ERK1/2 mRNA表达水平均显著高于对照组(P<0.01)。见表2。

表2 两组患者骨髓有核红细胞BRafmRNA、MEK mRNA及ERK1/2 mRNA表达水平间比较
2.2SAHA对CMS患者骨髓有核红细胞生长的抑制作用 与未经药物处理的CMS患者骨髓有核红细胞相比,经不同浓度的SAHA处理后,CMS患者骨髓有核红细胞增殖受到了明显抑制(见图1);且SAHA对细胞的杀伤作用呈时间和剂量依赖性(见图2);而SAHA对细胞的最佳杀伤浓度为2 μmol/L,作用时间为48 h,故后续实验采用此条件下进行。

图2 不同时间及剂量下CMS患者骨髓有核红细胞对SAHA敏感性实验
2.3SAHA对CMS患者骨髓有核红细胞信号通路蛋白表达的影响 在SAHA浓度为2 μmol/L时,细胞杀灭作用最为明显。故采用ELISA法检测在SAHA为该浓度下不同时点CMS患者骨髓有核红细胞Ras-GTP浓度,结果显示为0 h(19.03±3.36) pg/mL、12 h(18.86±4.29) pg/mL、24 h(19.29±3.64) pg/mL、48 h(19.11±2.58) pg/mL。各时点间Ras-GTP浓度未见显著差异(F=0.339,P>0.05)。采用Western Blot法检测BRaf、MEK及ERK1/2等蛋白表达水平,统计发现,MEK蛋白在不同时点间未见明显差异(P>0.05);而BRaf及ERK1/2蛋白在不同时点间存在明显差异(P<0.05)。见表3。

表3 SAHA为2 μmol/L浓度下不同时点ERK通路相关蛋白表达水平
3 讨 论
Ras/Raf/MEK/Erk信号通路是有核细胞内经典的信号通路之一,对细胞的增殖、分化、凋亡等多种生理功能均有明显的调节作用[10]。研究结果发现,Ras/Raf/MEK/Erk信号通路中各重要节点蛋白/基因在CMS患者骨髓有核红细胞中均显著表达,这是因为Ras/Raf/MEK/Erk信号通路在CMS发病过程,通过三级激酶级联反应实现异常活化,即上游激活蛋白激活MAPK激酶的激酶(MAPKKK),此后继续激活MAPK激酶(MAP-KK),最终活化MAPK。在ERK通路中,Ras扮演上游激活蛋白的角色,Raf作为MAPKKK可激活MAPK/ERK激酶(MEK),在此过程中,MEK相当于作为MAPKK,而ERK即MAPK[11-14]。本研究通过SAHA干预CMS患者骨髓有核红细胞结果显示,在2 μg/mL浓度下作用的抑制效应最为明显,而且Raf及ERK相关蛋白随着作用时间的延长,其表达水平明显降低,这提示SAHA对CMS患者骨髓中红系细胞具有显著的抑制作用,而这一作用可能是通过调节Ras/Raf/MEK/Erk信号通路中相关蛋白下调实现的。除ERK通路介导的细胞增殖之外,组蛋白去乙酰化水平目前也认为与细胞的增殖存在密切相关,组蛋白的乙酰化水平对基因的表达起到了显著的干预作用,当组蛋白处于乙酰化状态时,由DNA双链与组蛋白构成的核小体其结构逐渐松散,大大提高了各种转录因子与目的基因的结合概率,从而导致相关蛋白表达水平的增加。而当组蛋白去乙酰化后,核小体结构发生改变,使得DNA的转录水平受到抑制。这一发现已在多种肿瘤性疾病中得以验证,通过采用组蛋白去乙酰化酶抑制剂干预组蛋白去乙酰化过程可有效地抑制肿瘤细胞的增殖[15-16]。SAHA是第二代组蛋白去乙酰化抑制剂,与第一代相比,其具有更高的抑制去乙酰化效果。
综上所述,Ras/Raf/MEK/Erk通路的异常激活可能参与了CMS的发病过程,SAHA可有效抑制CMS患者骨髓有核红细胞的增殖,其机制可能与下调BRaf及ERK1/2蛋白表达水平有关。然而,由于受到样本量等客观因素的限制,数据偏倚在所难免,后续需进一步深入研究。
