温度对大口黑鲈幼鱼不同组织抗氧化能力及免疫相关蛋白表达的影响
2019-07-02孙永旭董宏标王文豪曹明段亚飞李华刘青松张家松
孙永旭,董宏标,王文豪,曹明,段亚飞,李华,刘青松,张家松,4,*
1.中国水产科学研究院南海水产研究所,农业农村部南海渔业资源开发利用重点实验室,广州 510300
2.上海海洋大学水产与生命学院,上海 201306
3.广东省渔业种质保护中心,广州 511453
4.中国水产科学研究院南海水产研究所深圳试验基地,深圳 518121
0 前言
大口黑鲈(Micropterus salmoides)属于鲈形目(Perciformes)、太阳鱼科(Centrarchidae)、黑鲈属(Micropterus),又称加州鲈,因其生长速度快、抗逆性强、市场潜力大等优点,已在广东、江苏、浙江等地大规模养殖,成为中国南方地区淡水人工养殖的主养高档品种之一[1]。据统计,2016年我国大口黑鲈养殖产量达37 万吨[2]。而在鱼类生长发育过程中,幼鱼阶段正值其免疫力薄弱、组织器官发育及增产增重的关键时期,过度的环境应激不仅会导致鱼类免疫力下降,生长速度减慢,甚至会造成鱼类死亡。
在自然界中,季节更替[3]、洋流运动[4]、及全球变暖效应[5]等均会导致水体温度的改变。温度是影响鱼类生长发育的重要环境因素之一,在鱼类生长、繁殖、新陈代谢及渗透调节等方面均有显著影响[6]。生物对不同生态因子都有一个由最高耐受点和最低耐受点构成的耐受范围,这个范围被称为生态幅[7]。当外界温度处于鱼类温度生态幅之外时,将对鱼体造成胁迫,使得机体氧自由基(Reactive oxygen species,ROS)代谢紊乱,并在组织器官内大量积累,过多的ROS 会攻击生物膜,生成脂质过氧化物(lipid peroxidation,LPO),并最终分解为丙二醛(malondialdehyde,MDA)[8]。谷胱甘肽(glutathione,GSH)一方面作为抗氧化酶(GPX)的底物来清除过多的ROS,另一方面可直接和部分ROS反应,参与ROS的代谢过程[9]。此外,ROS 的积累常常还伴随着机体免疫防御机制的紊乱[10]。热休克蛋白(heat shock proteins,HSPs)和金属硫蛋白(metallothionein,MT)广泛存在于人体、动植物和微生物体内,在机体应激时大量合成,是机体应激时大量合成的保护蛋白[11-12]。因此,机体应激胁迫常常表现出抗氧化酶和免疫相关蛋白等指标的变化[13-14]。如Madeira 等[11]研究发现,高温胁迫诱导多种水生动物热休克蛋白70(HSP70)的表达;低温胁迫使得黄姑鱼(Nibea albiflora)抗氧化酶活性和HSP70 蛋白含量显著升高[15];高温胁迫同样诱导金鱼抗氧化酶活性的升高[16]。目前,国内外关于急性温度胁迫对草鱼[17],银鲳[18]等鱼类生理机能的影响已见相关报道,而关于长期驯养温度对鱼类生理机能的影响研究较少。本实验探究了大口黑鲈幼鱼在不同驯养温度下肌肉、肝脏、鳃和肠道组织中抗氧化能力及免疫相关蛋白的变化,以期为研究大口黑鲈幼鱼对环境温度的适应机制和健康养殖提供参考依据。
1 材料与方法
1.1 材料
实验用大口黑鲈幼鱼购自广东省珠海市白蕉镇某养殖场,先在室内圆形养殖池中(直径:4.5 m,高0.8 m)暂养2 周。暂养期间每天08:00 饱食投喂一次(海皇鲈鱼专用配合饲料),并及时捞出残饵。每天16:00 底部吸污排水,换水量为15%左右。暂养期间养殖用水为曝气24 h 后的自来水,水温(29±1) ℃,pH 7.5±0.2,溶氧≥6.0 mg·L-1,自然光周期。
1.2 实验设计
暂养结束后随机选取规格相近、体表无伤的大口黑鲈幼鱼72 尾,体质量均值为(110±5) g。实验设置21 ℃、25 ℃、29 ℃和33 4℃ 个温度梯度组,每组3 个重复,每个重复6 尾。实验鱼养殖于100L 圆形PVC 养殖桶,室温(29±0.5) ℃稳定3 d 后,用冷水机(中国,海利HC-150A)和自动控温加热系统(中国,威诺WN-15E)以1 ℃·d-1的速率将各组温度降/升温到预定温度,并保持不变,实验周期为2 周[13-14]。日常换水之前将曝气后的自来水预冷或预热到与养殖桶水温一致。养殖实验期间其他日常管理同暂养期间一致。
1.3 样品采集与分析
取样前24 h 停止喂食。于每个实验组随机抽取6 尾,200 mg·L-1MS-222 迅速麻醉,冰盘上解剖,取其肌肉、肝脏、鳃和肠道组织,在预冷的生理盐水中漂洗后,滤纸拭干,放入提前标记好的1.5 mL 无菌离心管中,-80 ℃冰箱保存。
样品测定前在4 ℃冰箱中解冻,用预冷的生理盐水洗涤,滤纸吸去表面水分,称重后按照质量体积比加入9 倍预冷生理盐水,冰水浴中均质机匀浆,匀浆液经低温离心(4 ℃,3500 r·min-1,10 min)后,取上清液于预冷的无菌离心管中,-20 ℃保存。超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)、微量还原型谷胱甘肽(glutathione,GSH)、总抗氧化能力(total antioxidant capacity,T-AOC)、热休克蛋白70(heat shock protein70,HSP70)和金属硫蛋白(metallothionein,MT)均采用试剂盒法(购自南京建成生物工程研究所)测定,并进行结果分析。
组织中每毫克蛋白在0.24 mL 反应液中,抑制率达50%时所对应的酶量定为一个SOD 活力单位(U)。组织中每毫克蛋白在每秒钟分解1 μmol 的H2O2的量为一个CAT 活力单位(U)。MDA 含量测定采用TBA 法。GSH 测定采用微量酶标法。T-AOC测定采用FRAP 法。HSP70 和MT 均采用干粉法测定。总蛋白测定采用考马斯亮蓝法。
1.4 数据处理分析
应用SPSS 20.0 和origin 9.0 软件进行统计分析和作图。采用单因素方差分析(one-way ANOVA),LSD 多重比较检验,P<0.05 为显著水平,结果用平均值±标准误差(Mean±SE)表示。
2 结果与分析
2.1 温度对大口黑鲈幼鱼抗氧化能力的影响
2.1.1 温度对大口黑鲈幼鱼SOD 活性的影响
如图1所示,在同一温度组中,各组织中SOD活性存在较大差异,由高到低分别为鳃、肠、肝脏和肌肉。不同温度组之间,实验鱼肌肉中SOD 活性在25 ℃时最低但与其他组差异不显著(P>0.05)。肝脏中SOD 活性随温度升高而先降低后升高,29 ℃和25 ℃组显著(P<0.05)低于21 ℃和33 ℃组。鳃和肠组织中SOD 活性同样随温度升高呈倒抛物线趋势,在29℃组中其活性显著低于其他三组(P<0.05)。
2.1.2 温度对大口黑鲈幼鱼CAT 活性的影响
如图2所示。在同一温度组中,肌肉和肠中CAT活性较低,而肝脏和鳃中CAT 活性较高。不同温度组之间,实验鱼肌肉中CAT 活性随着温度升高而变化,在25 ℃时最低,但与其他组相比,差异不显著(P>0.05)。肝脏中CAT 活性随温度升高同样呈现波动性,在水温为29 ℃时最低,且显著低于其他温度组。鳃和肠组织中CAT 活性随温度升高而呈现先降低后升高的趋势,分别在29 ℃和25 ℃时达到最低,其中,29 ℃组鳃中CAT 活性显著(P<0.05)低于其他三个温度组,25 ℃组肠组织中CAT 活性与29 ℃组差异不显著(P>0.05),但与低温组(21 )℃和高温组(33 )℃差异显著(P<0.05)。
2.1.3 温度对大口黑鲈幼鱼MDA 含量的影响
如图3所示:同一温度组中,组织中MDA 含量由高到低分别为鳃、肠、肌肉和肝脏。不同温度组间,肌肉和肠组织中MDA 含量随温度升高呈波动性变化,最高出现在21 ℃组,且显著高于其他温度组(P<0.05)。 肝脏中MDA 含量在21 ℃组反而最低,显著低于25 ℃和33 ℃组(P<0.05)。四个温度组实验鱼的鳃组织中MDA 含量较高但差异不显著(P> 0.05)。
2.1.4 温度对大口黑鲈幼鱼GSH 含量的影响
如图4所示:同一温度组中,肌肉中GSH 含量较低,肝脏、鳃和肠组织中GSH 含量较高。不同温度组间,肌肉和肠组织中GSH 显著低于其他组(P<0.05)。肝脏中GSH 含量随温度变化而波动,在29 ℃组最低,33 ℃组最高。鳃和肠组织中GSH 含量随温度升高而先降低后升高,分别在25 ℃和29 ℃组最低,但两组之间差异不显著(P>0.05)。
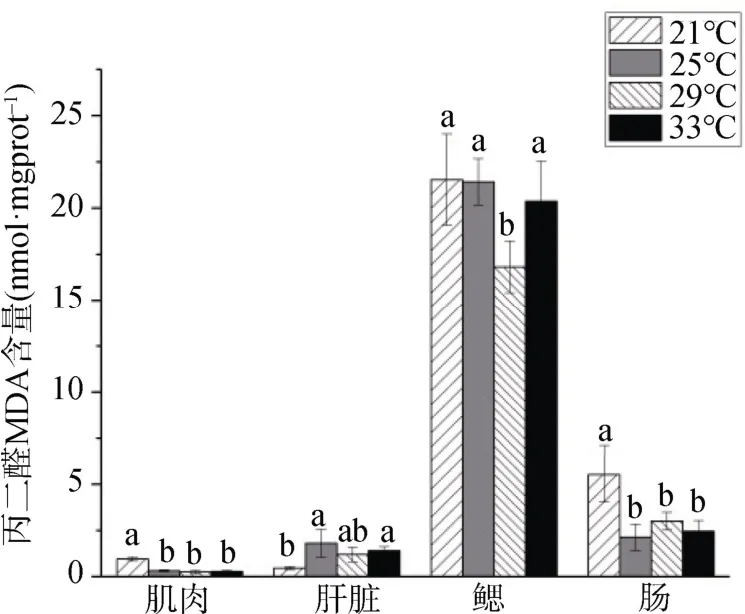
图3 温度对MDA 含量的影响 Figure3 Effects of temperature on MDA content

图4 温度对GSH 含量的影响 Figure4 Effects of temperature on CAT content
2.1.5 温度对大口黑鲈幼鱼T-AOC 的影响
如图5所示,同一温度组中,各组织中T-AOC存在差异,肌肉组织中T-AOC 最低,肝脏组织中最高。不同温度组间,肌肉中T-AOC 随着温度升高而先降低后升高,最低出现在29 ℃组,显著(P<0.05)低于其他温度组。肝脏中T-AOC 随温度升高而上下波动,同样在29 ℃最低,与21 ℃和33 ℃组之间差异不显著(P>0.05)。鳃组织中T-AOC 随温度升高变化不大。肠组织中T-AOC 随温度升高而呈先降低后升高的趋势,在25 ℃组最低,与29 ℃组之间差异不显著(P>0.05)。
2.2 温度对大口黑鲈幼鱼免疫相关蛋白表达含量的影响
2.2.1 温度对大口黑鲈幼鱼HSP70 表达的影响
如图6所示,同一温度组中,肌肉组织中HSP70 含量较高,鳃中较低。不同温度组间,肌肉中HSP70 含量随着温度升高呈逐渐升高的趋势,最低出现在21 ℃组,且该组显著低于(P<0.05)其他温度组。肝脏中HSP70 含量随温度升高而先升高后降低,在29 ℃组最高,但与其他三组之间差异不显著(P>0.05)。鳃组织中HSP70 含量随温度升高变化不大,在33 ℃组最高。肠组织中T-AOC 随温度升高而呈先升高后降低的趋势,在25 ℃组最高,21 ℃组最低,两组间差异显著(P<0.05)。
2.2.2 温度对大口黑鲈幼鱼MT 表达的影响

图5 温度对T-AOC 的影响 Figure5 Effects of temperature on T-AOC
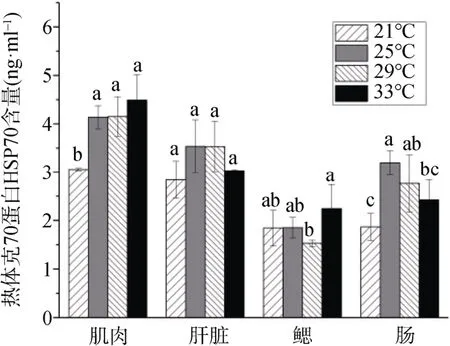
图6 温度对HSP70 含量的影响 Figure6 Effects of temperature on HSP70 content
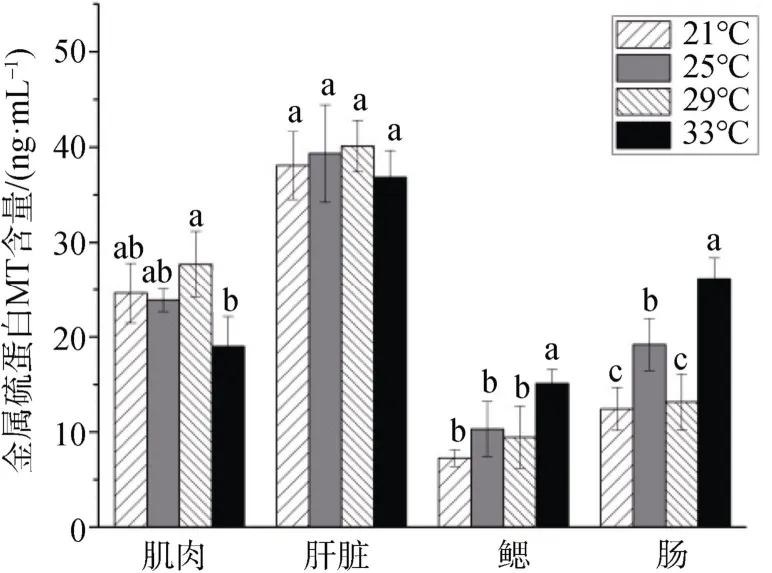
图7 温度对MT 含量的影响 Figure7 Effects of temperature on MT content
如图7所示,同一温度组中,肝脏中MT 含量较高,鳃中含量较低。不同温度组间,肌肉和肝脏中MT含量随着温度升高呈先升高后降低的趋势,最高出 现在29 ℃组,但各组之间差异不显著(P>0.05)。鳃和肠组织中MT 含量随温度升高呈现波动性变化,最高均出现在33 ℃组,且与其他三组之间差异显著(P<0.05)。
3 讨论
3.1 温度对大口黑鲈幼鱼不同组织抗氧化能力的影响
温度是影响鱼类生长发育的重要环境因素之一。不适的温度会引起鱼体的应激反应,而应激反应常常与ROS 的过量积累有关[21]。正常情况下,机体ROS 的产生与分解处于动态平衡中;但当受到外界胁迫刺激时,这种动态平衡即被打破,ROS 迅速积累,当其积累超过鱼体承受范围时会导致机体的氧化应激损伤[22],引起组织器官结构与功能上的变化,进而体现为抗病能力、生长速率等生产指标的降低。如长期低氧应激下,黄颡鱼对嗜水气单胞菌的抗病力显著下降[23]。高密度应激下,鱼类的能量输送偏向于生理功能调节,进而降低了生长速率[24]。生物体在长期进化过程中形成了一套完整的抗氧化系统来清除过多的ROS,避免一定程度上的氧化应激损伤,这套系统分为酶类抗氧化剂(SOD 和CAT 等)和非酶类抗氧化剂(GSH 和维生素C 等)[25-26]。研究表明,SOD 主要作用是将生物自身代谢或外界胁迫下产生的ROS转化为过氧化氢,而CAT作为过氧化氢的清除剂,将过氧化氢还原成氧分子和水[27]。
由于生物抗氧化系统的响应机制因物种、组织器官等而异,因此,随着温度变化,其抗氧化酶活性也呈现不同的变化趋势。由最适温度开始,军曹鱼(Rachycentron canadum)[28]和吉富罗非鱼(Oreochromis niloticus)幼鱼[29]SOD 和CAT 活性随温度降低而升高;褐牙鲆(Paralichthys olivaceus)[30]、小黄鱼(Larimichthys polyactis)[31]和大菱鲆(Scophthalmus maximus)[32]SOD 活性随温度升高而降低;金鱼(Carassius auratus)[33]SOD 活性高温胁迫温度升高而升高,并且肝脏和肾脏中SOD 活性较高。在本实验中,不同温度对大口黑鲈幼鱼造成的胁迫效应不尽相同。整体而言,随着温度从21 ℃到33 ℃上升,大口黑鲈幼鱼肝脏、鳃和肠道中SOD 和CAT活性随温度上升而呈先降低后升高的趋势,且基本均在29 ℃时活性最低。研究指出,大口黑鲈最佳生长水温为28.1—28.6 ℃[34],这与本实验研究结果相似。其抗氧化酶活性变化趋势与军曹鱼[28]、吉富罗非鱼[29]和金鱼[33]等研究类似,推测在低温或高温胁迫下,大口黑鲈幼鱼体内自由基代谢平衡被打破使得ROS 积累,进而诱导抗氧化酶活性的增强。而在比较低温和高温胁迫应激发现,25 ℃温度组中SOD活性较为接近适温组,而在33 ℃组中SOD 呈较高活性,表明相较于低温胁迫,高温对大口黑鲈幼鱼机体造成了更大损伤。高温会降低水体溶氧[35],加速机体代谢[36-37],代谢和呼吸旺盛加剧水体溶氧消化和水质恶化,间接影响鱼体胁迫,进而导致在本实验中,高温表现出对实验鱼具有较高的氧化应激损伤影响。在对不同组织中SOD 和CAT 活性进行比较发现,四个组织中抗氧化酶活性存在较大差异:鳃,肠和肝脏中其酶活性较高且波动较大,而肌肉中较低且波动平稳。这表明长期温度胁迫下,实验鱼鳃、肠和肝脏组织是主要响应靶器官,也是机体ROS 积累与代谢的主要场所。
当机体因外界胁迫积累大量ROS而无法及时清除时,过多的ROS 会攻击生物膜,生成脂质过氧化物(LPO),并最终分解为MDA[8]。MDA 可改变生物膜流通性,对其造成损伤。因此,组织中的MDA 水平往往是机体脂质过氧化程度的体现,其侧面反映了细胞损伤的程度[38]。而GSH 一方面作为抗氧化酶(GPX)的底物来清除多余的ROS,另一方面可以直接和部分ROS 反应,参与ROS 的代谢过程[9],其含量的多少与机体抗氧化能力密切相关。该实验结果显示,长期温度胁迫下大口黑鲈幼鱼鳃和肠中积累了大量MDA 和GSH,而肌肉中含量较低,这与SOD 和CAT 活性在肌肉中较低有一定一致性,推测温度胁迫对实验鱼肌肉组织的影响较小。整体来看,升温或降温均对大口黑鲈幼鱼组织器官产生一定氧化胁迫损伤。在相同的温度应激程度(4 )℃下比较,25 ℃组中MDA 含量整体低于33 ℃组。这与南方鲇(Silurus meridionalis)幼鱼[39]和虹鳟(Salmo gairdneri)[40]的研究结果相反,推测升温或降温的胁迫效应因鱼种而异。本实验表明大口黑鲈对升温具有更高的敏感性,在长期高温应激胁迫时,机体损伤程度更大。
T-AOC 是反映机体抗氧化能力的综合指标。研究表明,鱼体抗氧化能力与水温之间有较高的相关性[41]。本实验结果显示,随着温度升高,大口黑鲈幼鱼肌肉和肠组织中T-AOC 呈先降低后升高的趋势,在21 ℃和33 ℃时最高,表明长期温度胁迫影响,对机体造成了一定程度的氧化应激损伤,进而表现为T-AOC 的升高。在肝组织中,T-AOC 在一般低温组(25 )℃最高,显著高于(P>0.05)其他三组,推测适度的温度胁迫诱导抗氧化酶活性的增强,但过度的温度胁迫对肝脏造成了一定不可逆损伤,抑制了机体免疫相关酶的活性,进而表现为T-AOC 的降低。
3.2 温度对大口黑鲈幼鱼不同组织免疫相关蛋白含量的影响
鱼类为变温动物,外界温度变化会影响鱼类在分子和生理方面的变化,热休克蛋白(HSPs)作为机体应激时大量合成的内源性保护蛋白,其表达量常与抗氧化酶(SOD、CAT 等)一起作为衡量机体应激程度的指标[11]。已有研究指出,低温胁迫诱导了黄姑鱼(Nibea albiflora)[42]、东方蓝鳍鲔(Thunnus orientalis)[43]和金枪鱼(Salmo salar)[44]等HSP70 蛋白的表达。在本实验中,与常温组(29 )℃相比,其他温度组HSP70 含量在肝脏和肠组织中反而有所降低,这与上述多数研究结果不符,可能因为急性胁迫诱导HSP70 蛋白合成以提高机体耐受性,但机体对长期温度胁迫具有适应过程,如长期热应激胁迫对鲤鱼鳃组织中HSP70 的诱导效应不明显,而急性胁迫可诱导该组织中HSP70 的大量表达[45]。HSP70 的表达同样具有一定的时序性,研究发现随着胁迫时间的延长,其含量呈先升高后降低的趋势[42,46],并推测机体在受到胁迫刺激后建立了新的平衡。此外,Delaney 等[47]研究表明,中等强度增温可显著诱导鲤鱼血清中HSP70表达,而高强度热胁迫下,HSP70表达反而低于正常水平,这可能是因为机体对无法抵抗过高程度应激所造成的胁迫损伤,进而表现为免疫相关蛋白表达水平的降低。因此,本实验中长期胁迫下各个温度组中HSP70 表达量的降低很可能是这方面的原因导致,而较低的HSP70 表达量是否表明机体对后续可能的应激抵御力降低,并在一定程度上表现为机体自身免疫力的降低,还需要进一步的研究。
MT 是一类金属结合蛋白,广泛存在于人体、动植物和微生物体内,同样在机体受到胁迫应激时大量合成[12]。研究发现,胁迫应激会导致MT 在鱼类中显示组织特异性的应答机制[48]。本实验同样发现不同组织中MT 的含量呈现组织差异性:肌肉和肝脏中MT 含量整体较高,而鳃和肠中MT 含量整体较低。不同温度组之间MT 含量差异不大,仅在高温组(33 )℃时,其MT 含量整体较其他组有较大差异,并且各个温度组之间肝脏中MT 含量差异不显著(P>0.05)。该实验结果与Silvestre[49]和周彦峰[50]等的研究相符,在胁迫时间持续增加以后,MT 含量由一开始的升高转而降低,表明实验鱼对长期胁迫具有一定的适应性过程,以抵抗应激对机体所造成的损伤。
4 结论
本研究初步表明,长期温度胁迫对大口黑鲈肝脏、鳃、肠和肌肉均造成一定应激损伤,其中鳃、肠和肝脏组织是主要响应靶器官,也是机体ROS 积累与代谢的主要场所。升温或降温均对大口黑鲈幼鱼组织器官产生一定氧化胁迫损伤。大口黑鲈对升温具有更高的敏感性,相较于低温胁迫,高温对大口黑鲈幼鱼机体造成了更大损伤。而大口黑鲈鱼对长期胁迫具有一定的适应性过程,以抵抗应激对机体所造成的损伤。
