18F-FDG PE T/CT在恶性肿瘤神经浸润中的诊断价值
2019-07-01张宗斌李佳曹卫
张宗斌,李佳,曹卫
1三峡大学第二人民医院医学影像科,湖北 宜昌443000
2华中科技大学同济医学院附属协和医院核医学科,武汉4300000
淋巴瘤、肺癌、胃癌、宫颈癌、乳腺癌、结直肠癌和皮肤癌等许多恶性肿瘤,均可以直接侵犯外周神经,肿瘤细胞也可沿着神经鞘扩散,称为神经浸润[1-2]。神经浸润是恶性肿瘤独立的病理过程,是肿瘤复发的重要原因,是恶性肿瘤患者预后不良的独立危险因素[3-4]。因为恶性肿瘤的神经浸润可以无任何临床症状,容易被忽视,评估较困难,一般的成像技术很难识别[2]。早诊断、早治疗有助于改善伴神经浸润的恶性肿瘤患者的预后。正电子发射断层显像/计算机断层扫描(positron emission tomography/computed tomography,PET/CT)通过检测体内的18F-氟代脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)发射的γ射线来观察代谢过程,并与CT结合获得解剖学信息,在恶性肿瘤及转移灶的诊断中具有重要价值[5-6]。本研究探讨18F-FDG PET/CT对恶性肿瘤神经浸润的评估价值。
1 资料与方法
1.1 一般资料
选取2016年1月至2017年12月在三峡大学第二人民医院行18F-FDG PET/CT检查并经病理检查证实的恶性肿瘤患者。纳入标准:①经病理学证实为恶性肿瘤;②就诊时合并神经系统症状,包括感觉或运动障碍、疼痛、肌力减退、麻木、刺痛、尿失禁、便秘、面部肌肉痉挛和舌肌无力等。排除标准:①妊娠期女性;②餐后血糖≥11.1 mmol/L;③合并器官功能衰竭或活动性感染。依据纳入和排除标准,本研究共纳入50例恶性肿瘤患者,其中男34例,女16例;年龄17~74岁,平均年龄为(45.3±13.8)岁;17~39岁16例,40~50岁16例,51~74岁18例;非霍奇金淋巴瘤21例,头颈部恶性肿瘤9例(其中鳞状细胞癌8例,上颌窦腺样囊性癌1例),不明原因转移瘤6例,乳腺癌4例,支气管肺癌3例,胶质母细胞瘤2例,转移性肝细胞癌2例,结肠腺癌2例,黑色素瘤1例。
1.2 检查方法
所有患者扫描前24 h高蛋白、低糖、低脂饮食,禁止咀嚼口香糖;扫描前12 h,停止饮用调味水、糖水以及含碳水化合物、酒精、尼古丁等的饮料,分次饮用总量为2 L的白开水,用以充分水化和促进18F-FDG排泄;扫描前4~6 h禁食,包括含葡萄糖或肠外营养的静脉注射液。常规注射胰岛素控制血糖的糖尿病患者,建议早上6点早餐并注射正常剂量的胰岛素。注射18F-FDG前,检查指尖血糖水平,控制血糖<11.1 mmol/L。按0.1 mCi/kg的剂量注射18F-FDG,然后用10~20 ml生理盐水冲洗,在专用房间中隔离休息45~60 min,并排空尿液。检查前,去掉患者身上所有金属物体以避免任何伪影。所有患者分别于CT或超声引导下穿刺活检术后1周、肿瘤切除术后4周、化疗后2~4周和放疗后4~12周,采用Biograph 64HR PET/CT仪(其中CT为64层螺旋CT)对所有患者进行了PET/CT扫描。检查时,患者双臂上举仰卧在扫描台上,头颈部恶性肿瘤患者,双臂放置身体两侧,扫描期间,身体保持静止,扫描范围从颅顶至耻骨联合下。CT检查:静脉注射碘普罗胺对比剂80~120 ml,注射速度3 ml/s。扫描范围从头到脚,扫描参数:管电压130 kV,管电流200~250 mA,层厚3 mm,视野500~600 mm,体素尺寸0.98 mm×0.98 mm×5.00 mm。PET检查:PET扫描范围也是从头到脚,患者平缓呼吸,以减少肺部呼吸运动对检查结果的影响,采集床位数5~8个,每个床位2.5 min,每个床位之间重叠约50%,图像经衰减校正后重建。所有患者检查后48 h内避免接触儿童和孕妇。
1.3 图像分析及判断标准
所有图像均由2名主治医师以上级别的高年资医师共同分析。采用图像处理工作站,将最终得到512×512的横断面、冠状面及矢状面的CT图像、层厚为3 mm的PET扫描图像和PET/CT融合图像进行重建,得到轴位CT、PET、PET/CT融合图像,以及重建的矢状面、冠状面的PET、CT、PET/CT融合图像和PET最大密度投影。采用最大标准摄取值(maximum standardized uptake value,SUVmax)对具有代谢活性的病灶进行测量。PET/CT诊断恶性肿瘤神经浸润的标准:原发病灶周围神经走形区域可见软组织肿块,放射性摄取浓聚、增高或稍高为阳性。根据病理结果、抗炎治疗后1个月随访结果、化疗后临床随访结果作为诊断神经浸润的金标准[2]。灵敏度=真阳性例数/(真阳性+假阴性)例数×100%;特异度=真阴性例数/(真阴性+假阳性)例数×100%;准确度=(真阳性+真阴性)例数/总例数×100%;阳性预测值=真阳性例数/(真阳性+假阳性)例数×100%;阴性预测值=真阴性例数/(真阴性+假阴性)例数×100%。
1.4 统计学方法
采用SPSS 18.0软件对所有数据进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数表示;以P<0.05为差异有统计学意义。
2 结果
2.1 PET/CT检查对恶性肿瘤神经浸润的诊断效能
50例恶性肿瘤患者中,PET/CT检查阳性14例,阴性36例。14例阳性患者PET/CT检查显示沿受累神经走形的线性代谢活动,SUVmax为2.5~25.2,平均SUVmax为(7.6±6.5),其中真阳性10例[SUVmax为4.3~25.2,平均SUVmax为(8.2±6.2)],假阳性 4例[SUVmax为 2.5~10.6,平均 SUVmax为(5.9±3.8)],真阳性患者的平均SUVmax明显高于假阳性患者,差异有统计学意义(t=7.379,P<0.01)。PET/CT诊断恶性肿瘤神经浸润的灵敏度为83.33%,特异度为89.47%,阳性预测值为71.43%,阴性预测为94.44%,准确度为88.00%(表1)。

表1 PET/CT检查与病理或随访结果的对照
2.2 恶性肿瘤患者18F-FDG PET/CT的影像表现
4例PET/CT诊断假阳性的患者,PET/CT表现为受累神经走形过程中代谢活跃,但抗炎治疗后症状缓解,临床诊断为放疗后神经病变,1个月后随访无复发或无进展。其中1例女性乳腺癌根治术术后患者,放疗后5个月出现了左上肢无力和感觉减退,PET/CT检查发现沿左臂丛神经走形线性代谢活跃;1例为肝癌脊柱转移伴腰椎多发骨沉积患者,放疗后4个月出现神经症状,PET/CT表现为左侧脊神经L1处和右侧脊神经L2处代谢活跃;1例为男性非霍奇金淋巴瘤Ⅳ期患者,T11~L1骨沉积,放疗后5个月出现疼痛和乏力,PET/CT显示双侧脊髓神经L1处代谢活跃;1例为男性直肠癌复发患者,肿瘤切除及放疗后,出现左下肢疼痛和无力,PET/CT显示左侧腰骶丛代谢活跃。
10例PET/CT诊断真阳性的患者经抗炎治疗后神经症状无明显改善,其中6例患者发病时即出现了神经症状,既往曾有化疗改善史[其中1例女性非霍奇金淋巴瘤患者的PET/CT表现为膈下淋巴结浸润伴结外肝脏浸润,出现右肩疼痛,化疗后缓解,化疗结束后复发(图1)];1例胶质母细胞瘤患者根据临床神经症状诊断为神经浸润,其临床表现与炎性神经病不一致,对抗炎治疗无反应;3例患者化疗后随访2~3个月神经症状缓解。
36例PET/CT诊断阴性的患者中,34例对抗炎治疗反应良好,临床诊断为非恶性神经病变;2例抗炎治疗无反应,临床诊断为恶性神经病变。2例恶性神经病变患者中,其中1例为舌根鳞状细胞癌术后复发患者,主诉舌肌无力,临床诊断为舌下神经恶性浸润,但PET/CT检查舌下神经走形未见明显18F-FDG摄取征象,病灶大小为3.2 mm×2.8 mm×3.6 mm,SUVmax为0.3;另1例上颌窦腺样囊性癌患者接受左侧腮腺鳞状细胞癌切除术治疗,放化疗后出现面神经损伤症状,抗炎治疗1.5个月无好转,临床诊断左侧面神经浸润,为判断是否肿瘤复发,进行PET/CT检查,未发现左侧面神经走形过程中活性代谢反应,病灶大小6.5 mm×12 mm×8.2 mm,SUVmax为1.9。
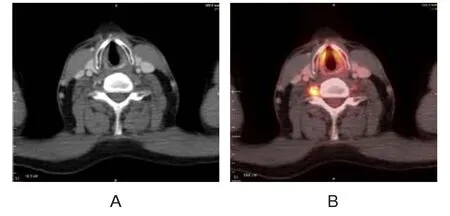
图168 岁女性非霍奇金淋巴瘤患者的18F-FDGPET/CT影像表现
3 讨论
恶性肿瘤发生神经浸润常提示预后不良,但也有证据表明,若及时给予针对性治疗,可改善预后[7],但早期正确诊断神经浸润是目前临床影像技术的难点[8]。目前,PET/CT检查主要应用于有临床症状的患者,与无症状患者相比,PET/CT检查诊断有症状神经功能损害患者的假阳性率较高[9]。本研究50例患者的神经症状表现多种多样,将病理学结果、抗炎药物和化疗后随访结果作为金标准,PET/CT检查对淋巴瘤、头颈部肿瘤和胶质母细胞瘤出现神经浸润的诊断灵敏度为83.33%,特异度为89.47%,阳性预测值为71.43%,阴性预测值为94.44%,准确度为88.00%。尽管神经淋巴瘤是少见的结外淋巴瘤[10],但本研究中10例PET/CT诊断真阳性的患者中,7例为原发性神经淋巴瘤,累及多个周围神经,如脊神经根、腰骶丛、坐骨神经、臂丛神经和脑神经。多数学者认为神经淋巴瘤是全身淋巴瘤病的继发症状[8-10]。但也有研究报道,神经淋巴瘤是一种独立的原发性疾病,可进展为全身淋巴瘤[11-12]。此外,小涎腺或大唾液腺癌、黏膜或皮肤鳞状细胞癌出现神经浸润较多见,尽管病理类型或肿瘤的原发部位不同,但位于颅神经走形过程中的头颈部恶性肿瘤均可能出现神经浸润[13-14]。本研究2例经病理证实的舌根鳞状细胞癌和上颌腺样囊性癌患者的PET/CT检查发现了与原发肿瘤部位相关的脑神经转移。
近年来,随着医疗技术水平的不断进展,特定肿瘤细胞、支持性间质和神经间的复杂相互作用机制研究发现越来越多[15-16],但是恶性肿瘤神经浸润的机制尚不清楚,有学者认为肿瘤细胞沿神经鞘的直接侵袭和肿瘤侵袭性增加均可能导致神经浸润。目前,胶质母细胞瘤神经浸润极为罕见[17]。Singh等[18]报道了1例颈段脊髓胶质母细胞瘤发生C6、C7脊神经根转移的患者;该患者临床症状的严重程度与炎性反应过程不一致,对抗炎药物的治疗也无反应,因此,考虑神经浸润。此外,放疗相关性神经丛病也被认为是导致恶性肿瘤患者出现神经症状的原因之一,与高剂量的放疗有关,一般发生于放疗后5~30个月,放疗后10~20个月是发病高峰[19],但这种神经症状对抗炎药物的治疗较敏感。本研究中2例恶性肿瘤神经浸润患者PET/CT检查显示阴性而被误诊,这可能是因为患者的肿瘤体积较小或部分肿瘤组织与邻近正常组织难以区别[20]。
近年来,PET与磁共振(MRI)融合的影像技术也取得了巨大进展[21-22]。MRI对软组织的对比性较好,在恶性肿瘤神经浸润的显像中具有很大优势,PET/MRI诊断神经浸润可能比PET/CT更为敏感[23]。研究表明,增强18FDG PET/MRI能检测到比增强18FDG PET/CT更多的神经浸润。具有基于飞行时间技术(time of flight,TOF)功能的PET/MRI扫描仪可能比不具有TOF功能的PET/MRI扫描仪更为敏感[24]。
综上所述,18F-FDG PET/CT有助于早期诊断恶性肿瘤患者的神经浸润情况,从而对患者进行针对性的干预。
