胰腺腺鳞癌七例的CT与MRI影像学特征分析
2019-07-01朱宁于亮王铁功
朱宁 于亮 王铁功
1宁波大学医学院附属医院影像科,宁波 315020;2海军军医大学附属长海医院影像科,上海 200433
【提要】 胰腺腺鳞癌是一种罕见的胰腺外分泌肿瘤,恶性度高,预后差,临床症状无特异性。本文回顾性分析7例经手术病理证实的胰腺腺鳞癌患者的CT和(或)MRI资料,结果显示瘤块多位于胰头部,边界不清,体积较大,伴有坏死囊变,增强后弱强化,常伴胰管扩张,可伴胰腺萎缩、胆管扩张、淋巴结转移、侵犯周围器官。该病需与胰腺导管腺癌、胰腺黏液性囊性肿瘤、胰腺实性假乳头状瘤相鉴别。
胰腺腺鳞癌(pancreatic adenosquamous carcinoma,PASC)是一种临床罕见的胰腺外分泌恶性肿瘤,约占胰腺恶性肿瘤的2.1%[1]。PASC恶性度高,预后较胰腺导管腺癌更差,大多数患者生存期很难超过1年[2-3]。既往对PASC报道较少,多为个案,且影像学表现多集中于 CT,而MRI的表现报道甚少[4-5]。本研究分析7例PASC患者的影像学表现,以进一步提高对本病的认识和影像学诊断水平。
一、资料与方法
1.一般资料:收集海军军医大学附属长海医院手术切除并经病理证实的7例PASC患者临床资料,其中男性5例、女性2例;年龄45~81岁,平均62岁。临床表现:腹痛6例次,腹胀3例次,黄疸3例次,体重下降1例次,发热1例次。手术方式:胰头+十二指肠切除术5例,胰体尾+脾切除术2例。
2.影像学检查:6例患者行CT平扫+增强扫描。采用德国Siemens Somatom 64层CT扫描仪。检查前口服清水500~600 ml。扫描范围自肝顶至两肾下缘水平,管电压120 kV,管电流280 mA,无间隔重建,层厚为3~5 mm。增强扫描对比剂为碘海醇(含碘300 mg I/ml),经肘静脉以3.5 ml/s 流率团注80~90 ml,注射后25~28、40~45、65~80 s行动脉期、胰实质期和肝实质期扫描。
4例患者行MRI平扫+增强扫描,1例行MRI平扫。采用德国Siemens Avanto 1.5T MR扫描仪。平扫分别行横断面呼吸门控快速自旋回波T2WI序列,重复时间(TR) 2 800 ms,回波时间(TE) 85 ms;横断面快速扰相梯度回波序列T1WI序列,TR 150 ms,TE 2 ms;横断面呼吸触发自旋平面回波DWI序列,TR 4 000 ms,TE 94 ms,b值取0、600 s/mm2;斜冠状位三维快速自旋回波MRCP序列,TR 6 000 ms,TE 450 ms,行三维最大密度投影后处理。动态增强扫描采用脂肪抑制三维快速扰相梯度回波T1WI序列,横断面增强扫描参数同平扫;冠状面增强TR 3.3 ms,TE 1.6 ms。对比剂为钆喷酸葡胺,经肘静脉以2 ml/s的流率团注0.1 mmol/kg,扫描方案同CT增强扫描。
由2名从事腹部影像诊断10年以上工作经验的放射科医师共同阅片,协商达成一致意见。观察指标包括:(1)病变部位;(2)肿瘤最长径;(3)形状;(4)边界;(5)坏死灶,即CT低密度、T2WI高信号且无强化区域;(6)钙化与出血;(7)肿瘤血供,以正常胰腺组织为参照物;(8)胰腺改变,包括胰腺萎缩、胰管扩张;(9)胰周转移淋巴结,即淋巴结短径>1 cm或出现明显强化的淋巴结;(10)周围组织器官侵犯及转移。
3.病理检查:由一名副主任病理医师复查阅片,观察病理表现,并采用免疫组织化学染色方法检测腺上皮标志物CK8、CAM5.2以及鳞状上皮标志物p63、p40的表达情况。
二、结果
1.影像学表现:7例病灶均为单发,其中5例位于胰头部,2例位于胰尾部;瘤体最长径1.8~5.0 cm,平均(3.5±1.4)cm;5例瘤体呈圆形或椭圆形,2例呈分叶状。
CT平扫见5例瘤体密度低于周围胰腺组织(其中2例内部见不规则更低密度影),1例密度与周围胰腺组织接近(图1A);6例瘤体实性部分CT值为(35.8±5.7)HU;1例呈浸润性改变,5例呈膨胀浸润性改变,边界均欠清晰;6例瘤体内均未见出血、钙化。CT增强扫描后6例瘤体实性部分均强化,其中5例弱于周围胰腺组织(图1B),且其更低密度的坏死囊变区无明显强化,另1例与周围胰腺组织较接近;6例瘤体实性部分各期CT值分别为(44.3±8.6)、(53.7±11.4)、(52.6±9.9)HU。1例见胰腺萎缩,5例见上游主胰管扩张,3例见胆管扩张。3例发生淋巴结转移,3例侵犯周围器官(图1B)。
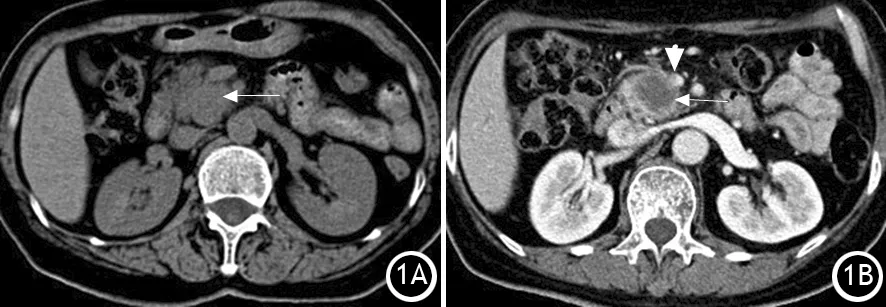
图1 CT平扫胰头部肿瘤呈椭圆形等密度影(1A);增强扫描胰实质期,胰头部的瘤体强化程度低于胰腺组织(↑),侵犯肠系膜上静脉(↑)
MRI平扫在T1WI图上5例瘤体均呈低信号(图2A),抑脂T2WI图密度略高、高信号,其中2例信号不均匀,内部见点片状更高信号影(图2B),且发现1例CT未明显显示的瘤体坏死囊变区(图3A),增强后实性部分强化程度低于胰腺组织,而坏死囊变区无明显强化(图3B)。DWI图上5例瘤体表现为不均匀高信号(图4A);1例呈浸润性改变,4例呈膨胀浸润性改变,边界均显示欠清晰;5例瘤体内均未见出血。增强扫描后4例瘤体实性部分均显示强化,但弱于周围胰腺组织,坏死囊变区无明显强化,1例位于瘤体中央,1例与实性部分夹杂分布(图4B)。1例见胰腺萎缩,3例见上游主胰管扩张,2例见胆管扩张。2例发生淋巴结转移,2例侵犯周围器官。
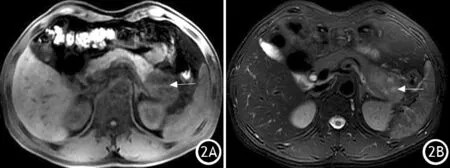
图2 T1WI上瘤体呈低信号(2A),T2WI上瘤体呈混杂高信号,内部多个坏死囊变区(↑,2B)
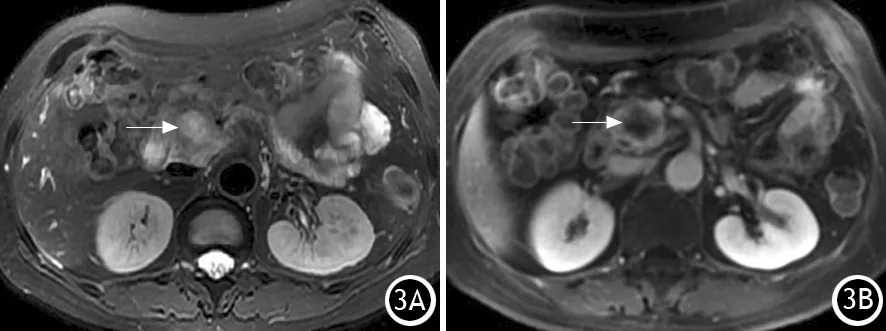
图3 T2WI上瘤体呈混杂高信号,中央为更高信号的坏死囊变区(↑,3A);增强扫描肝实质期瘤体实性部分强化程度低于胰腺组织,坏死囊变区无明显强化(↑,3B)

图4 DWI上胰尾部的瘤体、转移淋巴结(↑)均呈不均匀高信号(4A),增强扫描胰实质期胰尾部瘤体实性部分强化程度低于胰腺组织,夹杂分布的多个坏死囊变区无明显强化(↑),肿瘤侵犯脾脏,转移淋巴结呈环状强化(↑),左肾囊肿无强化(4B)
2.组织病理学改变:显微镜下见肿瘤组织呈不规则小管状、筛孔状排列,部分呈片巢状排列。肿瘤细胞呈多角形、不规则形,核圆形、卵圆形,核大深染、异型,部分区域可见灶状及大片状坏死(图5)。免疫组织化学染色显示,7例患者中腺上皮标志物CK8阳性5例次,CAM5.2阳性6例次,鳞状上皮标志物p63阳性4例次,p40阳性5例次。
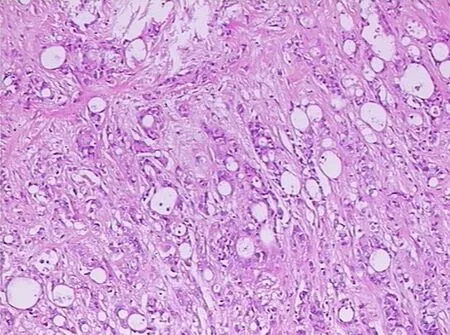
图5 PASC肿瘤组织由腺癌和鳞癌组成(HE×100)
讨论PASC多发生在60岁以上老年人,男性患者多于女性[2-3]。临床表现缺乏特异性,早期症状不明显,晚期常见的症状是腹痛、体重减轻、黄疸[6-7]。血清CA19-9和CEA常显著升高[6],具有一定的参考意义,但并不具有特异性。PASC的组织病理学特征是在导管腺癌的组织中含有鳞状细胞癌成分。ERCP抽吸胰液、EUS或CT引导下细针穿刺细胞学检查均有助于术前诊断,但可能导致肿瘤腹腔内种植转移和胰漏的发生[3,8]。治疗多以手术切除为主,能明显提高患者短期的生活质量[3]。
根据本研究结果并结合相关文献,笔者认为PASC的影像学表现具有以下特征:(1)肿瘤多位于胰头部。一项收集1988至2007年间共415例PASC的文献显示,44.6%的肿瘤位于胰头部[2]。本组71.4%位于胰头部。(2)瘤体较大。平均直径为4.9~5.7 cm[2-3]。本组瘤体的平均长径为3.5 cm,低于文献报道。(3)坏死囊变。孙琦和王益林[5]认为,囊性区周围多有不规则“卫星”小囊是PASC的特征表现。Trikudanathan和Dasanu[9]、Nabae等[10]认为,瘤体中央的坏死囊变是PASC特征表现。本组3例(42.9%)出现坏死囊变,其中1例胰头部的坏死囊变位于瘤体中央,2例胰尾部的肿瘤有多个大小不一的坏死囊变区,与实性部分夹杂分布。MR T2WI对这一征象的显示较CT更清楚。(4)强化方式。许雪峰等[11]报道PASC(4例胰头部)在动脉期明显强化,孙琦和王益林[5]报道PASC(5例胰头部、2例胰体尾部)在门静脉期明显强化,本组6例(6/7)表现为三期均强化,但其程度均弱于周围胰腺组织;1例(1/7)胰头部瘤体平扫、增强扫描的密度与周围胰腺组织较接近。(5)转移。PASC呈侵袭性生长,容易早期转移,出现局部的浸润、神经血管受侵和淋巴结转移。国内外报道显示,43.8%~52.8%的PASC发生淋巴结转移,43.8%侵犯周围脏器[2-3]。
PASC需与以下肿瘤进行鉴别诊断:(1)胰腺导管腺癌。PASC是胰腺导管腺癌的变异型之一,两者影像学表现有较大的重叠性,但胰腺导管腺癌很少出现坏死囊变,发生率不足2%(9/560)[12];且导管腺癌的直径小于PASC[2,13],淋巴结转移发生率低于PASC[2,14]。(2)胰腺黏液性囊性肿瘤。它是最常见的胰腺囊性肿瘤[15],好发于中年女性,肿瘤多位于胰体尾部,恶性肿瘤多伴实性成分和厚囊壁[16]。(3)胰腺实性假乳头状瘤。其好发于年轻女性,边界清,有包膜,呈囊实性改变,常伴有出血、钙化;动脉期呈轻度强化,门脉期和延迟期呈渐进性强化。
利益冲突所有作者均声明不存在利益冲突
