MicroRNA-27a靶向PHLPP2促进胃癌细胞增殖和转移的机制探讨
2019-06-28范波施莉
范波 施莉

[摘要] 目的 研究MicroRNA-27a靶向PHLPP2促進胃癌细胞增殖和转移的机制。 方法 选取我院2016年1月~2018年1月收治的胃癌患者60例,提取所有患者的胃癌组织和胃癌旁组织,研究MicroRNA-27a靶向PHLPP2促进胃癌细胞增殖和转移的机制。 结果 在SGC-7901细胞中,miR-27a antagomir与vector-3'UTR-wt共转染后可能会引起报告载体荧光素酶活性的上升,但是在miR-27a antagomir与vector-3'UTR-wt共转染之后,荧光素酶的活性并没有发生较大变化。在AGS细胞中,miR-27a antagomir与vector-3'UTR-wt共转染可能会引起报告载体荧光素酶活性的下降,但是在miR-27a antagomir与vector-3'UTR-wt共转染的报告载体中,荧光素酶的活性并没有发生较为显著的变化。转染miRa antagomir后,SGC-7901细胞中PHLPP2中的mRNA水平和蛋白水平明显上升,转染MicroRNA-27a agomir后,AGS细胞中的PHLPP2的mRNA水平和蛋白水平明显下降(P均<0.05)。 结论 miR-327a在胃癌组织和胃癌细胞系中表达上调,MicroRNA-27a能够在胃癌细胞中对PHLPP2的活性产生抑制作用,并且能够促进胃癌细胞的凋亡,对胃癌患者的治疗能够产生一定的积极作用。
[关键词] MicroRNA-27a;靶向PHLPP2;胃癌细胞;增殖;转移;机制
[中图分类号] R735.2 [文献标识码] A [文章编号] 1673-9701(2019)11-0001-04
Mechanism of MicroRNA-27a targeting PHLPP2 promoting proliferation and metastasis of gastric cancer cells
FAN Bo1 SHI Li2
1.Department of Clinical Laboratory, Jinhua People's Hospital in Zhejiang Province, Jinhua 321000, China; 2.Department of Gastroenterology, Jinhua People's Hospital in Zhejiang Province, Jinhua 321000, China
[Abstract] Objective To explore the mechanism of MicroRNA-27a targeting PHLPP2 promoting proliferation and metastasis of gastric cancer cells. Methods Sixty patients with gastric cancer admitted to our hospital from January 2016 to January 2018 were enrolled. The gastric cancer tissues and paracancerous tissues of all patients were extracted to study the mechanism of MicroRNA-27a targeting PHLPP2 to promote the proliferation and metastasis of gastric cancer cells. Results In SGC-7901 cells, co-transfection of miR-27a antagomir and vector-3'UTR-wt may cause an increase in luciferase activity in the reporter vector, but after co-transfection of miR-27a antagomir and vector-3'UTR-wt, there was no significant change in the activity of luciferase. In AGS cells, co-transfection of miR-27a antagomir and vector-3'UTR-wt may cause a decrease in luciferase activity in the reporter vector, but also no significant change was observed after co-transfection. After transfection of miRa antagomir, the mRNA level and protein level of PHLPP2 in SGC-7901 cells increased significantly. After transfection of MicroRNA-27a agomir, the mRNA and protein levels of PHLPP2 in AGS cells decreased significantly(P<0.05). Conclusion The expression of miR-327a is up-regulated in gastric cancer tissues and gastric cancer cell lines. MicroRNA-27a can inhibit the activity of PHLPP2 in gastric cancer cells and promote the apoptosis of gastric cancer cells, which has positive effects on the treatment of gastric cancer.
[Key words] MicroRNA-27a; Targeting PHLPP2; Gastric cancer cells; Proliferation; Metastasis; Mechanism
胃癌是临床上较为常见的一种恶性肿瘤类型,发病率和致死率均非常高,随着医学科技的不断发展完善,临床上对胃癌的防治取得了一定的成效,患者的生存率有所提升,但是胃癌患者的远期生存期仍处于较低水平,仍然需要不断地研究和探索,寻找更加合理的胃癌治疗方式[1,2]。MicroRNA属于分子长度为18~24的核糖核苷酸,MicroRNA调控着人体中大约30%的蛋白质编码基因表达,MicroRNA-27a位于人类第19号染色体。MicroRNA-27a在多种肿瘤组织中均会出现异常表达,并且在不同的肿瘤组织中,MicroRNA-27a的表达也不相同。PHLPP指的是PH结构域富亮氨酸重复蛋白磷酸酶蛋白,PHLPP2属于PHLPP家族的重要成员,由1323个氨基酸构成,位于16q22.3。有研究发现[3-6],PHLPP2在肿瘤的发生和发展过程中发挥着重要作用。由于microRNA能够通过调控原癌基因和抑癌基因在肿瘤发展过程中的表达,所以人们通常将microRNA和PHLPP联系起来,研究MicroRNA-27a靶向PHLPP2促进胃癌细胞增殖和转移的机制对于肿瘤的治疗意义重大。
1 资料与方法
1.1一般资料
选取我院2016年1月~2018年1月收治的胃癌患者60例,男31例,女29例,年龄45~78岁,平均(60.8±1.9)岁,所有患者均经临床检查和病理学诊断确诊为胃癌,提取所有胃癌患者的胃癌细胞组织和胃癌旁组织,为保证检测结果的准确性,本次研究排除了在术前接受过放疗、化疗以及其他肿瘤相关治疗的患者,所有患者均自愿接受本次研究,并签署知情同意书。
1.2 仪器与试剂
本次实验所用试剂包括TransScriptRRT/RI Enzyme Mix、RNAiso Plus、Bulge-LoopTMmiRNAqRT-PCR Primer kit、hsa-MicroRNA-27a检测引物、hsa-U6检测引物、FastStart Universal SYBR Green Master(ROX),本次实验所用仪器包括组织匀浆器、精密电子天平、低温高速离心机、荧光实时定量PCR仪、恒温水浴锅以及Epoch超微量微孔板分光光度计等。
1.3方法
切取所有患者的胃癌组织和癌旁组织,在对患者的胃癌旁组织进行切取时,为了保证与患者胃癌组织明确区分,正常组织需距离患者胃癌边缘5 cm以上,标本切取完成后,将切取的组织放置于冻存管中进行存放备用,剩余组织使用福尔马林浸泡。
利用Real-time PCR方式对60例胃癌患者的胃癌组织和癌旁正常组织的MicroRNA-27a表达水平进行检测,比较胃癌组织和癌旁正常组织中MicroRNA-27a表达的差异。按照RNAiso Plus的说明书对胃癌组织和癌旁正常组织的总RNA进行提取,首先取出胃癌组织和癌旁正常组织各50 mg,然后在样本中分别加入1 mL的RNAiso Plus混合,随后置入组织匀浆器,设置成60 Hz,进行时长为4 min的匀浆操作,室温条件下放置5 min,将EP管放入离心机中以12000 rpm的速度离心4 min,取上清放入去Rnase的EP管中,加入200 μL的氯仿,将EP盖盖紧,摇晃均匀在室温下放置5 min,在4℃条件下以12000 rpm的速度离心15 min,从离心机中平稳取出EP管,将上层水相转移到新的去Rnase的EP中,加入相同体积的异丙醇,混合均匀后加入适量的无RNA酶水溶解RNA沉淀,溶解后使用超微量微孔板分光光度计测定溶液的浓度和纯度。使用Bulge-LoopTMmiRNAqRT-PCR Primer kit进行miRNAcDNA逆转录反应,反应结束后导出各孔样本的Ct值,对基因差异表达水平进行定量分析。
使用TargetScan、MiRDB、StarBase等MiRNSA靶基因预测MicroRNA-27a与PHLPP2结合的可能位点。将含有与MicroRNA-27a可能结合位点的PHLPP2片段连接在pGL3-3UTR载体上,利用检测荧光值的方式对MicroRNA-27a与PHLPP2的结合情况进行检测。采取Western Blot方式对胃癌细胞中MicroRNA-27a低表达后的PHLLPP2蛋白表达水平进行检测。
1.4 统计学方法
应用SPSS21.0进行统计学分析,数据采用Student's two-tailed t-test校验,所有的实验结果最少要重复3次以上,所有的计量资料用(x±s)表示,采用t检验或方差分析,P<0.05表示差异具有统计学意义。
2 结果
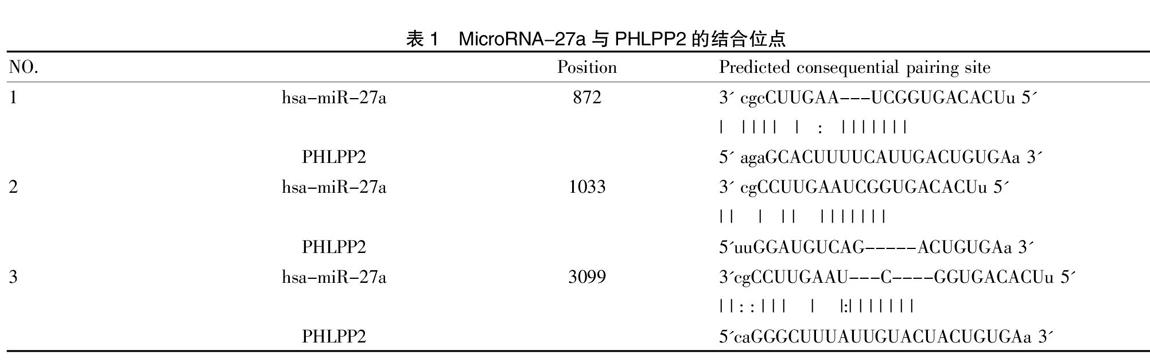
2.1 MicroRNA-27a与PHLPP2的結合位点
使用TargetScan、MiRDB、StarBase等MiRNSA靶基因预测MicroRNA-27a与PHLPP2结合的可能位点;结果见表1。在SGC-7901细胞中,miR-27a antagomir与vector-3'UTR-wt共转染后可能会引起报告载体荧光素酶活性的上升,但是在miR-27a antagomir与vector-3'UTR-wt共转染后,荧光素酶的活性并没有发生较大变化。在AGS细胞中,miR-27a antagomir与vector-3'UTR-wt共转染后,从报告上看,载体荧光素酶的活性出现下降,但荧光素酶的活性并没有发生较为显著的变化。在AGS细胞中,MicroRNA-27a antagomir与vector-3'UTR-wt共转染的报告载体中,荧光素酶的活性并没有发生较为显著的变化,说明在胃癌细胞中,MicroRNA-27a能够靶向结合PHLPP2的3'UTR区,利用这种方式达到对PHLPP2表达进行调控的目的。
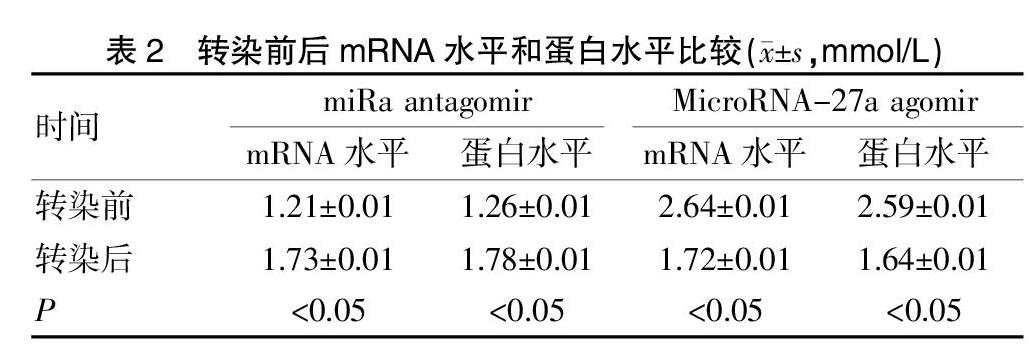
2.2 转染前后mRNA水平和蛋白水平比较
将MicroRNA-27a antagomir或者MicroRNA-27a agomir转染到胃癌细胞SGC-7901或胃癌细胞AGS中,将MicroRNA-27a的水平进行下调或者上调后,结果显示,转染miRa antagomir之前,患者的SGC-7901细胞中PHLPP2的mRNA水平和蛋白水平分别为(1.21±0.01)、(1.26±0.01),转染miRa antagomir后mRNA水平和蛋白水平分别上升为(1.73±0.01)、(1.78±0.01),两组比较差异显著(P均<0.05);转染MicroRNA-27a agomir前,AGS细胞中的PHLPP2的mRNA水平和蛋白水平为(2.64±0.01)、(2.59±0.01),转染MicroRNA-27a agomir后,AGS細胞中的PHLPP2的mRNA水平和蛋白水平下降为(1.72±0.01)、(1.64±0.01),差异有统计学意义(P均<0.05)。见表2。
表2 转染前后mRNA水平和蛋白水平比较(x±s,mmol/L)
2.3 miR-27a 在胃癌系中的表达
各个胃癌细胞系中的各指标均出现不同程度的miR-27a的高表达,其中MGC-803、AGS、SGC-7901与人正常胃黏膜细胞 GES-1比较,差异有统计学意义(P<0.05),胃癌细胞系BGC-823与人正常胃黏膜细胞GES-1比较,差异有统计学意义(P<0.05),见表3。
3 讨论
通过本次研究可以发现,MicroRNA-27a在胃癌中能够起到促癌基因的作用,一般来说,miRNA通常只有通过靶基因才能够发挥作用,为了对MicroRNA-27a在胃癌中发挥促癌作用的机制进行更加深入的研究,选择TargetScan、MiRDB和AtarBase V2.0等miRNA靶基因预测数据库对MicroRNA-27a的靶基因和结合位点进行预测。
PHLPP指的是PH结构域富亮氨酸重复蛋白磷酸酶蛋白,PHLPP2属于PHLPP家族的重要成员,由1323个氨基酸构成,位于16q22.3。PHLPP2在人体中的分布非常广泛,并且对于大部分细胞能够产生较大的作用,比如PHLPP2能够通过负向调解Akt、Mst1、PKC、MARK激活的信号通路,对人体各组织的功能产生调解作用,并且PHLPP2对于人体中细胞的增殖、生长、凋亡等也能够产生很大的影响。有研究发现[7-12],PHLPP是一种非常重要的抑癌基因类型,在癌症治疗方面能够发挥巨大的价值,如果人体中出现PHLPP表达的下调或者缺失,会对人体健康产生一定的不良影响。在PHLPP家族中,不仅包含PHLPP2,还包含PHLPP1α、和PHLPP1β等,其中以PHLPP2的表达最为活跃,一旦受到某种因素的刺激,PHLPP2很容易发生基因损伤或者突变。此外,PHLPP2还能够直接去磷酸化Akt Ser473,导致Akt Ser473失去活性,这种反应能够起到抑制PI3k/Akt信号通路的效果,在细胞存活方面影响非常大。
许多研究中均发现[13-16],MicroRNA-27a在肿瘤的发生和发展过程中起着非常重要的作用。在本次研究中也发现在胃癌细胞中的MicroRNA-27a比例下降时,p-Akt以及CyclinD1的表达也会出现下降,而p21和p27则会出现上升,在敲减PHLPP2单位情况下能够抵抗上述变化,这说明PHLPP2/Akt能够参与到MicroRNA-27a调控胃癌细胞的增殖过程中。MicroRNA-27a的高表达与胃癌患者的淋巴结转移和远端转移也具有较大的关系,在检测了E-cadherin、p-GSK3β、Vimentin和Snail的蛋白水平后,我们发现下调MicroRNA-27a的水平后,可能对Akt/GSK-3β通路造成了影响,从而使胃癌细胞EMT出现了明显的抑制作用[17-20]。提示MicroRNA-27a能够通过抑制PHLPP2的表达对Akt通路进行调节,达到在胃癌细胞中的增殖和转移。
综上所述,miR-27a在胃癌组织和胃癌细胞系中的表达上调,MicroRNA-27a能够在胃癌细胞中对PHLPP2的活性产生抑制作用,并且能够促进胃癌细胞的凋亡,对胃癌患者的治疗能够产生一定的积极作用。
[参考文献]
[1] 崔子峰. MicroRNA-27a在舌鳞癌组织中的表达及对舌鳞癌cal-27细胞增殖与凋亡行为影响的研究[D]. 河北医科大学,2018.
[2] 蔡群. MiR-27a对海马神经元缺血缺氧保护作用及其机制的研究[D]. 苏州大学,2017.
[3] 朱端,胡晨,赵力,等. 脂多糖诱导的小鼠急性呼吸窘迫综合征中microRNA-27a和PPARγ表达变化[J]. 第三军医大学学报,2017,39(20):1967-1972.
[4] 巩雪. MicroRNA-27a在青海藏族胃癌组织中的表达和临床病理关系的相关分析[D]. 青海大学,2017.
[5] 丁蕾. MicroRNA-27a通过靶向PHLPP2促进胃癌细胞增殖和转移的机制研究[D]. 吉林大学,2017.
[6] 阿立翔. microRNA-27a通过抑制PPARγ调控肥胖大鼠血管内皮一氧化氮释放的机制研究[D]. 吉林大学,2016.
[7] 吴丽娜. MicroRNA-27a对糖尿病大鼠肾脏系膜细胞增殖及细胞外基质堆积的影响及机制研究[D]. 郑州大学,2015.
[8] 黎建福. MicroRNA-27a在肝癌中的作用[D]. 昆明医科大学,2015.
[9] 刘信攸. MicroRNA-27a对小鼠骨髓来源树突状细胞成熟及其细胞因子分泌的影响[D]. 南京医科大学,2015.
[10] 许静,郭哲,孙慧霞. miRNA-27a在宫颈鳞癌患者血清和组织中的表达及判断价值研究[J]. 中国妇幼保健,2015,30(12):1841-1843.
[11] 李帅. MicroRNA-27a调控骨肉瘤生物学行为的机制研究[D]. 华中科技大学,2015.
[12] 宋石. miR-27a通过靶向调控PPARγ对酒精诱导大鼠BMSC分化的影响[D]. 郑州大学,2015.
[13] 刘信攸,周阳春,王瑶,等. microRNA-27a对树突状细胞表型及功能的影响[J]. 中国免疫学杂志,2015,31(1):31-35,39.
[14] 刘刚. MicroRNA-27a调控在椎间盘髓核细胞凋亡中的作用机制研究[D]. 第二军医大学,2014.
[15] 杨巧媛,揭志刚,叶升,等. microRNA-27a基因遗传变异与环境暴露因素联合作用对胃癌发生的影响[A].//中国毒理学会、广东省疾病预防控制中心.中国毒理学会第六届全国毒理学大会论文摘要[C].中国毒理学会、广东省疾病预防控制中心:中国毒理学会,2013:2.
[16] 张梦楠. 5-Aza-dC和microRNA-27a对肿瘤耐药性的影响及机制研究[D]. 北京协和医学院,2013.
[17] 潘伟波. 骨肉瘤细胞MG63中内源性microRNA-27a对骨肉瘤恶性行为的影响及其调控靶基因的研究[D]. 浙江大学,2013.
[18] 姚荣,胡咏华,左清平. 金雀异黄素对胃癌细胞增殖的影响及对microRNA-27a和FOXO1的调控[J]. 中南药学,2012,10(5):349-353.
[19] 刘东晓. JAK2基因多态性与胃癌风险相关性研究及miR-27a对胃癌细胞生长的影响[D]. 南京医科大学,2012.
[20] 赖允丽. 促卵泡激素通过microRNA-27a促进上皮性卵巢癌VEGF表达的分子机制[D]. 广西医科大学,2012.
