盐霉素类似物的分离及抑制吲哚胺2,3-双加氧酶活性研究
2019-06-25谢昌贤云喜报卢晓霞
郑 城,王 涛,谢昌贤,云喜报,卢晓霞
1中国科学院成都生物研究所,成都 610041;2金河生物科技股份有限公司,呼和浩特 010200;3中国科学院大学,北京 100049
盐霉素(salinomycin)是从白色链霉菌(Streptomyces albus)培养液中分离得到的天然聚醚类离子载体型抗生素[1],其结构中含有独特的三螺环缩酮结构,其中一个是不饱和六元环(图2)。由于分子内氢键作用,盐霉素可以以类似环状结构的形式存在,通常认为这与其生物活性有关[2-4]。盐霉素一直作为抗菌药以及兽药被广泛使用,近年来研究发现盐霉素还能够选择性地消除肿瘤干细胞和耐药性肿瘤细胞[7],并且其活性比临床常用的抗癌药物紫杉醇活性高100倍[8]。通过其结构中含氧官能团与碱金属离子(K+,Na+)络合形成具有亲脂性外壳的碱金属络合物,从而在细胞和亚细胞膜间运输金属阳离子并破坏Na+/K+离子平衡而诱导细胞死亡[5,6],盐霉素有望成为一种潜在的新型抗癌药物[9]。然而盐霉素的抗癌活性还需要进一步提高,而且因其具有一定的毒性,影响了其成药性。由于在盐霉素的发酵生产过程中会产生一系列聚醚类盐霉素类似物[10],为了发现具有抗癌活性的新型盐霉素类活性化合物,我们利用高效液相色谱柱后衍生方法检测,采用制备色谱从盐霉素发酵粗产物中分离出两个盐霉素类似物,通过红外光谱、质谱和核磁共振谱等手段表征了这两个新化合物,并对其抑制吲哚胺2,3-双加氧酶(IDO)活性进行了初步研究。
1 仪器和材料
Agilent 1260高效液相色谱仪(美国安捷伦公司),色谱柱为安捷伦公司Zorbax Rx-C8 (4.6 × 150 mm,5 μm);岛津LC-8A制备液相色谱仪(日本岛津公司)色谱柱为Daisogel SP-100-8-C8-HP (41.4 × 250 mm,8 μm),Perkin Elmer Spectrum 100红外光谱仪(美国珀金埃尔默公司),Perkin Elmer model 341 旋光仪(美国珀金埃尔默公司),Bruker Avance-600 MHz 核磁共振仪(瑞士布鲁克公司),Waters Xevo TQ质谱仪(美国沃特世公司),Varioskan Flash 全波长扫描式多功能读数仪(美国Thermo Scientific公司)。
盐霉素发酵粗产物由金河生物科技股份有限公司(内蒙古)提供;分析级乙酸,硫酸,乙酸钠三水合物,乙酸铵购自Fluka Chemie公司(瑞士);HPLC级的乙腈和甲醇购自赛默飞公司(美国)。对二甲氨基苯甲醛、碳酸氢钠、氘代氯仿购自阿拉丁公司;用于制备流动相的水通过Millipore Milli-Q plus纯化系统纯化并经过去离子化和蒸馏得到。Epacadostat购自毕得医药公司,犬尿氨酸酶(KYNU)检测试剂盒购自武汉优尔生公司,CCK-8试剂盒购自碧云天生物技术有限公司。
2 实验部分
2.1 化合物的制备
2.1.1 检测与制备色谱条件
检测条件为:以80%溶剂A(乙腈)+20%溶剂B(100 mM乙酸铵缓冲溶液)为流动相,设置柱温为30 ± 0.5 ℃,流动相流速为0.6 mL/min,衍生反应温度为95 ± 0.5 ℃,衍生试剂流速为0.7 mL/min,检测波长为585 nm。一次和二次制备条件一致:以80%溶剂A(乙腈)+ 20%溶剂B(100 mM乙酸铵缓冲溶液)为流动相,设置柱温为30 ± 0.5 ℃,流动相流速为50.0 mL/min,检测波长:210 nm;脱盐色谱条件为:以90%溶剂A(乙腈)+ 10%溶剂B(水)为流动相,设置柱温为30 ± 0.5 ℃,流动相流速为50.0 mL/min,检测波长:210 nm。
2.1.2 样品前处理和化合物制备
称取7.7 g乙酸铵于1.0 L锥形瓶,用水定容,再用冰醋酸调节pH值4.75得100 mM乙酸铵缓冲溶液;称取25.0 g对二甲氨基苯甲醛于1.0 L锥形瓶中,加入600 mL甲醇溶解,缓慢加入12 mL硫酸,搅拌得衍生试剂。称取约100.0 g盐霉素发酵粗产物,置于1.0 L烧杯中,加入650 mL中性甲醇,超声15 min,然后用3 000 rpm离心机离心15 min,0.45 μm滤膜过滤,滤液做为样品溶液。待基线平稳后,吸取样品溶液10 mL,注入制备色谱仪,记录色谱图,在制备色谱条件下对化合物A和B进行定位,然后根据分析结果计算出化合物A与化合物B在制备色谱图上的相对保留时间分别为1.35和1.48。
吸取样品溶液注入制备色谱仪,根据化合物A与化合物B的相对保留时间,进行分段收集。将收集液分别取样、检测,根据液相色谱检测结果,将符合要求的化合物A(色谱纯度大于80%)与化合物B(色谱纯度大于60%)的制备液分别进行混合,得到化合物A的混合液约8.1 L,化合物B的混合液约4.2 L,浓缩,冻干得共收得一次制备化合物A约328 mg,化合物B约269 mg。将化合物A和化合物B的一次制备粉末分别加入50 mL中性甲醇溶解进行二次制备,在制备色谱仪上,进行分段收集。将收集液分别取样、进行液相色谱仪检测,根据检测结果,将符合要求的化合物A与化合物B的收集液分别进行混合。得到化合物A的混合液约300 mL,化合物B的混合液约450 mL,浓缩得到化合物A的粗品溶液约40 mL,化合物B的粗品溶液约60 mL。
取盐霉素粗品溶液10 mL,注入制备色谱仪,记录在脱盐色谱条件的色谱图对化合物A和B进行定位。记录化合物A与化合物B在脱盐色谱图上的出峰时间,分别吸取化合物A与化合物B的粗品溶液,注入制备色谱仪,根据定位试验中化合物A与化合物B在制备色谱图上的出峰时间进行分段收集,将收集液分别取样,进行液相色谱仪检测,根据液相色谱检测结果,将含有化合物A与化合物B的收集液分别进行混合。得到化合物A的混合液约300 mL,化合物B的混合液约450 mL,浓缩,冻干,最后得到白色粉末化合物A约20 mg,色谱纯度99.8%,白色粉末化合物B约17 mg,色谱纯度98.3%。
2.2 哚胺2,3-双加氧酶(IDO)抑制活性研究
将4-T1细胞接种于96孔板,密度1×105个/mL,培养24 h,加入INFγ(10 μg/mL)处理2 h,分别加入化合物A(10 μmol/L)、B(10 μmol/L)和Epacadostat(10 nmol/L)处理24 h,将犬尿氨酸酶抗体包被于96孔微孔板中, 加入50 μL细胞液上清,然后加入生物素化的犬尿氨酸酶抗体,洗板,加入HRP标记的亲和素50 μL孵育20 min,洗板后加入TMB 45 μL孵育10 min,加终止液25 μL,立即酶标仪450 nm下测定吸光度。
将4T1细胞以104~105个细胞/孔的密度在96孔板中,细胞在CO2培养箱中37 ℃培养24 h。化合物A(10 μmol/L)、B(10 μmol/L)和Epacadostat(10 nmol/L)分别处理24 h后每个孔中加入10 μLCCK-8溶液,孵育2 h。酶标仪450 nm下测定吸光度。
3 实验结果
3.1 盐霉素类似物的制备

图1 盐霉素发酵产物的HPLC谱图Fig.1 HPLC spectrum of salinomycin fermentation products

图2 化合物A的HPLC谱图Fig.2 HPLC spectrum of compound A
在盐霉素发酵产品中,通过高效液相色谱(HPLC)柱后衍生化法检测发现在盐霉素主产物峰后还有两个明显的峰,其中两个未知化合物A和B的含量分别达到4.13%和2.47 %(图1)。因此利用高效液相色谱(HPLC)柱后衍生化法对A和B进行定位,采用制备色谱,经过一次制备,二次制备和脱盐等过程制备分离得到纯度分别为99.8%和结合质谱和核磁共振碳谱可确定化合物A的分子式为C43H72O11,分子量为765,比盐霉素的分子量(751)高14个质量单位。化合物A的1H和13C NMR谱数据与盐霉素文献值[11,12]基本一致,表明它们具有相同的骨架,其区别在于盐霉素中C-40位甲基信号δH0.96 ppm和δC11.3 ppm在化合物A中消失,而出现一组新的乙基信号δH1.25~1.42,1.43~1.54 ppm 和δC16.0 ppm与 δH0.87~0.90 ppm 和δC11.8 ppm,同时,C-5和C-6的化学位移值也发生了变化分别从δC27.0 和 29.0 ppm变为 δC21.9和34.9 ppm,可将δH1.25~1.42,1.43~1.54 ppm和δC16.0 ppm 与 δH0.87~0.90 ppm和δC11.8 ppm归属为40-CH2和40a-CH3,因此化合物A为40-甲基盐霉素(图4)。
98.3%(图2和3)的两个新化合物A和B。
3.2 化合物A和B的表征


结合质谱和核磁共振碳谱确定化合物B的分子式为C43H72O11,分子量为765,比盐霉素的分子量(751)高14个质量单位。化合物B的1H和13C谱数据与盐霉素的文献值[11,12]基本一致,表明它们具有相同的骨架,其区别在于盐霉素中C-35位甲基信号δH0.93 ppm和δC17.9 ppm在化合物B中消失,而出现一组新的乙基信号δH0.91~0.95 ppm和δC11.0 ppm与 δH1.09~1.14,1.46~1.50 ppm和δC24.1 ppm,同时,C-14,C-13和C-15的化学位移值也发生了变化分别从δC33.6,77.4 和39.2 ppm变为 δC38.2,74.7和 34.6 ppm,可将δH0.91~0.95 ppm和δC11.0 ppm与 δH1.09~1.14,1.46~1.50 ppm和δC24.1 ppm归属为35a-CH3和35-CH2,因此化合物B为35-甲基盐霉素(图4)。
3.2 IDO抑制活性
吲哚胺2,3-双加氧酶(IDO)是介导色氨酸沿犬尿氨酸途径分解代谢的限速酶,其与肿瘤免疫抑制有关[13],对化合物A和化合物B的吲哚胺2,3-双加氧酶(IDO)抑制活性进行了研究,结果显示(图5),化合物B能够有效抑制犬尿氨酸的产生,且没有细胞毒性,表明其具备一定的吲哚胺2,3-双加氧酶(IDO)抑制活性。
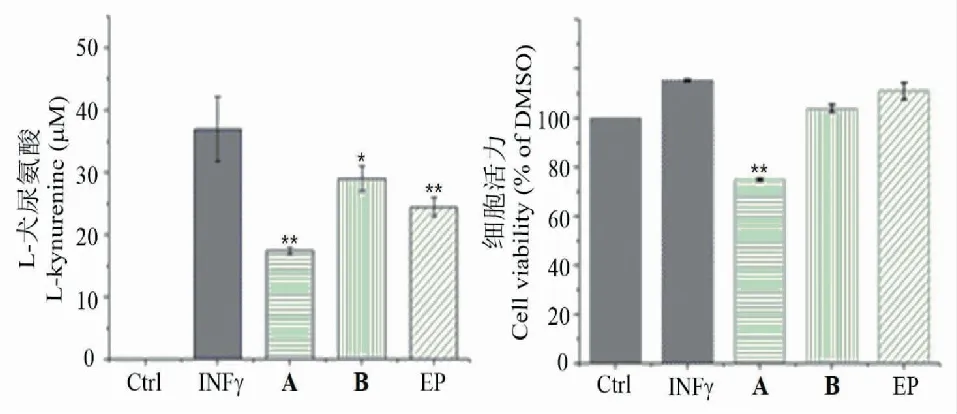
图5 化合物A和B的IDO抑制活性Fig.5 The IDO inhibitory activities of compounds A and B注:与空白对照组比较,* P < 0.05;** P < 0.01。Note:Compare with control,* P < 0.05;** P < 0.01.
4 结论
本论文利用制备色谱经过两次制备和脱盐,首次在盐霉素发酵产物分离得到化合物A和B,通过红外光谱、质谱和核磁共振谱等表征了这两个新化合物。结构分析发现两个新化合物均为盐霉素类似物:化合物A为40-甲基盐霉素,化合物B为35-甲基盐霉素。生物活性研究表明,化合物B具有抑制吲哚胺2,3-双加氧酶(IDO)活性,可作为一种潜在的抗肿瘤药物,值得进一步研究。
