枸杞色素及多糖的不同提取次序对其得率及抗氧化活性的影响
2019-06-25李文君王成章叶建中季金金
李文君,王成章*,叶建中,季金金
1中国林业科学研究院林产化学工业研究所;2南京林业大学化工学院, 南京 210042
枸杞属植物枸杞(LyciumbarbarumL.)为多棘刺落叶小灌木,具有很强的抗旱能力,在我国的宁夏、青海、甘肃、新疆等地分布较广。其浆果枸杞子在《神农本草经》中引为上品,是我国传统名贵中药材,素有“红宝”美称[1]。其味甘、性平,有清肝、润肺、滋补肝肾、强筋骨、抗癌的功效,既含有碳水化合物、脂肪、蛋白质、核黄素、胡萝卜素、磷、钙、铁、锌,还含有多种维生素及玉蜀黍黄素[2]。21世纪初就开始了枸杞子的有效成分与药理学的研究,现代医药表明,枸杞子中含有的甜菜碱、枸杞色素和枸杞多糖为枸杞子的主要活性物质。其中,枸杞色素为枸杞浆果中各种呈色物质的总称,主要成分是类胡萝卜素及其酯,具有消炎、抗疲劳、抗氧化、延缓衰老和预防肿瘤等重要的生物学功能,是食品和化妆品天然的着色物质。枸杞多糖(LBP)是由多个单糖或衍生物聚合而成的大分子活性化合物,其结构按LBP-I、LBP-II、LBP-III、LBP-IV的顺序水溶性依次递减,不溶于乙醇、丙酮等有机溶剂[3],具有调节机体免疫力[4],控制肿瘤生长和细胞突变,延缓衰老,提高适应能力,并具有抗疲劳和加速消除疲劳作用[5,6],已成为保健食品的一种重要功能性添加剂而且显示出良好的应用前景。目前,枸杞色素作为食用色素其提取方法主要有水浸提、有机溶剂浸提、皂化提取、微波或者超声处理、超临界流体萃取等,而其多糖的提取方法主要有水提法、碱液提取法、酶解提取法、微波法、超声波萃取法等[7],所以枸杞色素和多糖在提取方式上有相似之处,故当对同一批样品,即提取枸杞色素又提取枸杞多糖,就可能会对两者的含量造成影响,但是,目前这一方面的研究国内还未见报道。因此,本文将通过实验论证这一点,通过不同提取次序考察其对枸杞多糖和色素的得率及其抗氧化活性的影响,这将为枸杞子中色素和多糖后续同批次的综合加工利用提供一定的参考。
1 材料与方法
1.1 材料与仪器
1.1.1 原料
宁夏枸杞子,60 ℃烘干后,放入干燥器中冷却24 h,研碎过200目筛得枸杞粉,4 ℃干燥保存备用。
1.1.2 试剂
乙醇、乙酸乙酯、石油醚、三氯甲烷、环己烷均为分析级,正己烷为色谱级。
1.1.3 仪器
数显恒温水浴锅,HH-6,国华电器有限公司;实验室纯水机,FA2004,南京易普易达科技发展有限公司;恒温干燥箱,XMTD-8222,上海精宏实验设备有限公司;紫外可见分光光度计,UV765,上海怡电仪器公司。
1.2 方法
1.2.1 枸杞色素的提取工艺探究
1.2.1.1 枸杞色素提取率分析方法的建立
由于枸杞色素的主要成分为脂溶性类胡萝卜素类化合物,故本实验中对枸杞色素的提取率分析以β-胡萝卜素为指标,故需要测定的其标准曲线如下:
称10.0 mg的β-胡萝卜素于25 mL的容量瓶中,正己烷定容至刻度线,配制4.0 mg/mL标准溶液。分别取0.5、1.0、1.5、2.0、2.5、3.0 mL的上述标准溶液于10 mL的容量瓶中,正己烷定容至刻度线,分别得浓度为0.02、0.04、0.06、0.08、0.10、0.12 mg/mL的溶液,以蒸馏水同法做空白参比,在其最大吸收波长448 nm下的吸光度值A,以标准溶液浓度为横坐标x,吸光度值A为纵坐标y,得到标准曲线为y=0.187 8x+0.011 11,R2=0.997 8。

图1 β-胡萝卜素标准曲线Fig.1 β-carotene standard curve
1.2.1.2 枸杞色素的提取
枸杞色素的提取过程是利用索氏提取器热回流进行,主要提取其中的脂溶性色素,分别考察了提取溶剂、提取次数、提取时间、提取温度、料液比等因素对枸杞色素提取率的影响,基本方法为:称取10 g的枸杞粉末置于圆底烧杯中,加入100 g的石油醚溶液,于80 ℃水浴锅中加热进行索式提取,1 h后过滤,残渣中再次倒入100 g的石油醚继续提取1 h,将两次的滤液浓缩,在25 mL容量瓶中加入正己烷定容至刻度,继续稀释500倍,利用紫外分光光度计测量其吸光度值。
1.2.2 枸杞多糖的提取工艺探究
1.2.2.1 枸杞多糖的分析方法的建立
枸杞多糖是一种水溶性多糖,在枸杞中含量约为7.09%,已明确该多糖系蛋白多糖,分析枸杞多糖的提取率,以α-无水葡萄糖标准品为指标,故需要测定的其标准曲线如下:
采用苯酚-硫酸比色法[8],α-无水葡萄糖作为标准品配制标准溶液,在485 nm处测吸光度值A,以标准溶液浓度为横坐标x,吸光度值A为纵坐标y,得标准曲线为y=8.713 9x-0.043 9,R2=0.993 5。

图2 α-无水葡萄糖标准曲线Fig.2 α-anhydrous glucose standard curve
1.2.2.2 传统工艺提取枸杞多糖
取10 g枸杞粉置于普通回流装置中,加入氯仿与甲醇混合溶剂(氯仿∶甲醇=2∶1),在60 ℃回流脱脂2次,每次2 h,滤出溶剂,残渣风干后取80%乙醇适量,60℃回流2次,每次2 h,回收乙醇,再以50~60 ℃水提2次,共4 h,液固比为1∶15~1∶30[9],合并滤液浓缩至20 mL左右,以4~5倍95%的乙醇沉淀,放置24 h,抽滤,所得固形物先后以95%乙醇、无水乙醇、丙酮依次洗涤、真空干燥(50 ℃)[10],即得固形物枸杞多糖粗粉。
1.2.2.3 水提取枸杞多糖
取10 g枸杞粉置于普通回流装置中,加入超纯水回流2次,每次2 h,液固比为1∶15~1∶30,合并滤液浓缩至20 mL左右,以4~5倍95%的乙醇沉淀,放置24 h,抽滤,所得固形物先后以95%乙醇、无水乙醇、丙酮依次洗涤、真空干燥(50 ℃),即得固形物枸杞多糖粗粉。
1.2.2.4 超声辅助提取枸杞多糖[11]
取10 g枸杞粉置于100 mL烧杯中,加适量超纯水超声提取2次,每次30 min,过滤,滤液于50~70 ℃浓缩,最后用95%乙醇沉淀,放置24 h,抽滤,所得固形物先后以95%乙醇、无水乙醇、丙酮依次洗涤、真空干燥(50 ℃),即得枸杞多糖粗粉。
1.3 枸杞色素、枸杞多糖的抗氧化活性研究[12-16]
1.3.1 枸杞色素、枸杞多糖对DPPH·的清除能力
DPPH·的单电子,在510 nm处有强吸收,且其乙醇水溶液呈紫色,加入待测物后,通过检测其在该波长下的吸光度值的变化,利用公式(1)计算出DPPH·的清除率,以此评价待测物的抗氧化活性能力。
分别取4 mL浓度为0.025 mg/mL的DPPH·的乙醇溶液,加入6支试管中,依次加入0.2 mL浓度为0、0.01、0.015、0.02、0.025、0.03 mg/mL的枸杞色素、枸杞多糖和抗坏血酸(Vc)溶液立即摇匀,在室温遮光反应30 min,然后利用紫外可见光分光光度计在517 nm波长下,检测其吸光度值:
DPPH·清除率(S%)=(1-A30/A0)×100%
(1)
其中,A30是指分别加入了枸杞色素、枸杞多糖和Vc并反应30 min后溶液体系的吸光度值,A0是指体系未加入枸杞色素、枸杞多糖和Vc时溶液体系的吸光度值。
1.3.2 枸杞色素、枸杞多糖对·OH的清除能力
将H2O2与Fe2+混合产生的·OH,可与体系中的水杨酸结合生成紫色物质,在530 nm波长下具有最大吸收峰。加入待测物后,通过检测其在该波长下的吸光度值的变化,利用公式(2)计算出DPPH·的清除率,以此评价待测物的抗氧化活性能力。
分别量取2 mL浓度为9 mmol/L 的FeSO4溶液和2 mL浓度为9 mmol/L的H2O2溶液,加入6支试管中,依次加入0.2 mL浓度为0、0.01、0.015、0.02、0.025、0.03 mg/mL的枸杞色素、枸杞多糖和抗坏血酸(Vc)溶液,摇匀,静置10 min,再加入2 mL的9 mmol/L的水杨酸溶液,摇匀,在37 ℃下反应30 min,以超纯水作为参比,然后利用紫外可见光分光光度计在510 nm波长下,检测其吸光度值:
·OH清除率(S%)=1-[(AX-AX0)/A0]×100%
(2)
其中,A0为空白对照的吸光度值,AX为加入样品溶液的吸光度值,AX0为不加显色剂H2O2的吸光度值。
2 结果与讨论
2.1 枸杞色素的提取工艺研究
2.1.1 不同提取溶剂对枸杞色素得率的影响
利用1.2.1.2的方法,考察不同提取溶剂如石油醚、三氯甲烷、乙酸乙酯、环己烷、正己烷、乙醇、80%乙醇等对枸杞色素得率的影响,料液比1∶10,于80 ℃下索式提取2次,每次1 h,仅改变提取溶剂,将两次的滤液浓缩,在25 mL容量瓶中加入正己烷定容至刻度,继续稀释500倍,利用紫外分光光度计测量其吸光度值,其实验结果如图3(A)所示。由实验结果可知,三氯甲烷和正己烷溶剂对枸杞色素得率的影响相差无几,但是考虑到安全性和经济性,本实验采用正己烷进行提取枸杞色素。

图3 提取溶剂对枸杞色素得率的影响Fig.3 Effect of different factors on the yield of Lycium barbarum pigment
2.1.2 不同提取次数对枸杞色素得率的影响
利用1.2.1.2的方法,考察不同的提取次数如提取1、2、3、4和5次对枸杞色素得率的影响,以正己烷为提取溶剂,料液比1∶10,于80 ℃下索式提取,仅改变提取次数,将每次的滤液浓缩,在25 mL容量瓶中加入正己烷定容至刻度,继续稀释500倍,利用紫外分光光度计测量其吸光度值,其实验结果如图3(B)所示。由实验结果可知,提取次数为2次时,枸杞色素的得率最高,因此,本实验的提取次数为2次。
2.1.3 不同提取时间对枸杞色素得率的影响
利用1.2.1.2的方法,考察提取时间如提取0.50、1.00、1.50、2.00、2.50、3.00 h对枸杞色素得率的影响,故以正己烷为提取溶剂,料液比1∶10,于80 ℃下索式提取2次,仅改变提取时间,将两次的滤液浓缩,在25 mL容量瓶中加入正己烷定容至刻度,继续稀释500倍,利用紫外分光光度计测量其吸光度值,其实验结果如图3(C)所示。由实验结果可知,在提取时间为1.5 h时枸杞色素得率较高,但与提取时间为1 h时的枸杞色素得率相差不大,考虑到经济问题,在本实验中选择提取时间为1 h。
2.1.4 不同料液比对枸杞色素得率的影响
利用1.2.1.2的方法,考察不同料液比如料液比为1∶5、1∶10、1∶15、1∶20、1∶25对枸杞色素得率的影响,故以正己烷为提取溶剂,提取2次,每次1 h,于80 ℃下索式提取2次,每次1 h,仅改变料液比,将两次的滤液浓缩,在25 mL容量瓶中加入正己烷定容至刻度,继续稀释500倍,利用紫外分光光度计测量其吸光度值,其余试验条件不变,其实验结果如图3(D)所示。由实验结果可知,料液比在1∶10时枸杞色素得率最高,因此,本实验后续过程选择1∶10料液比进行。
2.1.5 不同提取温度对枸杞色素得率的影响
利用1.2.1.2的方法,考察不同提取温度如75、80、85、90 ℃对枸杞色素得率的影响,故以正己烷为提取溶剂,提取2次,每次1 h,料液比1∶10时,仅改变提取温度,将两次的滤液浓缩,在25 mL容量瓶中加入正己烷定容至刻度,继续稀释500倍,利用紫外分光光度计测量其吸光度值,其实验结果如图3(E)所示。由实验结果可知,提取温度为80 ℃时,枸杞色素得率最高,因此本实验后续过程选择提取温度为80 ℃。
2.1.6 验证试验
综上所述,枸杞色素的提取工艺为以正己烷为提取溶剂,提取2次,每次1 h,料液比1∶10,提取温度为80 ℃,色素得率较高。因此,为了验证该条件的正确性,在此条件下进行三组平行实验,得其枸杞色素的得率分别为3.8%、3.9%、4.1%,平均得率为3.93%。
2.2 枸杞多糖提取工艺研究
在本部分实验中的枸杞子原料粉末为首先利用2.1.6中的最佳条件将枸杞色素提取出来后的烘干的料渣,故本部分试验是先提取后枸杞色素后再进行提取枸杞多糖。
2.2.1 不同提取工艺对枸杞多糖得率的影响

图4 不同因素对枸杞多糖得率的影响Fig.4 Effect of different factors on the yield of Lycium barbarum polysaccharides
利用1.2.2.2和1.2.2.3的方法,考察不同提取工艺如传统工艺提取方法、普通水提取和索式水提法对枸杞多糖得率的影响,其余条件如料液比、提取时间、提取温度等都相同,测定其中多糖含量时,首先将提取得到的粗多糖粉末,配制成0.10 mg/mL 的溶液,紫外检测其中α-无水葡萄糖的含量,实验结果如图4(A)所示。由实验结果可知,在传统脱脂法、普通水提法和索式水提法三种工艺过程中,索式水提法得到的枸杞多糖较多,因此,本实验后续实验中将采用索式水提法进行。
2.2.2 不同料液比对枸杞多糖得率的影响
利用1.2.2.3的方法,考察不同料液比1∶10、1∶15、1∶20、1∶25、1∶30对枸杞多糖的影响,利用索式水提法,仅改变料液比,于90 ℃下索式提取2次,每次2 h,合并滤液浓缩至20 mL左右,以4~5倍95%的乙醇沉淀,放置24 h,抽滤,所得固形物先后以95%乙醇、无水乙醇、丙酮依次洗涤、真空干燥(50 ℃),即得固形物枸杞多糖粗粉。测定其中多糖含量时,首先将提取得到的粗多糖粉末,配制成0.10 mg/mL 的溶液,紫外检测其中α-无水葡萄糖的含量,实验结果如图4(B)所示。由实验结果可知,当料液比为1∶15时对枸杞多糖得率的影响最显著,因此,本实验后续实验中将采用1∶15的料液比进行。
2.2.3 不同提取时间对枸杞多糖得率的影响
利用1.2.2.3的方法,考察不同提取时间如1.00、1.50、2.00、2.50、3.00 h对枸杞多糖得率的影响,利用索式水提法,料液比为1∶15,于90 ℃下索式提取2次,仅改变提取时间,合并滤液浓缩至20 mL左右,以4~5倍95%的乙醇沉淀,放置24 h,抽滤,所得固形物先后以95%乙醇、无水乙醇、丙酮依次洗涤、真空干燥(50 ℃),即得固形物枸杞多糖粗粉。测定其中多糖含量时,首先将提取得到的粗多糖粉末,配制成0.10 mg/mL 的溶液,紫外检测其中α-无水葡萄糖的含量,实验结果如图4(C)所示。由实验结果可知,提取时间在1.5 h时最佳。
2.2.4 不同提取次数对枸杞多糖得率的影响
利用1.2.2.3的方法,考察考察不同提取次数如提取1次、2次、3次、4次对枸杞多糖得率的影响,利用索式水提法,料液比为1∶15,提取时间为1.5 h,于90 ℃下索式提取,仅改变提取次数,每次2 h,合并滤液浓缩至20 mL左右,以4~5倍95%的乙醇沉淀,放置24 h,抽滤,所得固形物先后以95%乙醇、无水乙醇、丙酮依次洗涤、真空干燥(50 ℃),即得固形物枸杞多糖粗粉。测定其中多糖含量时,首先将提取得到的粗多糖粉末,配制成0.10 mg/mL 的溶液,紫外检测其中α-无水葡萄糖的含量,实验结果如图4(D)所示。由实验结果可知,提取2次时枸杞多糖的得率最高,因此,后续工作中提取2次。
2.2.5 不同提取温度对枸杞多糖得率的影响
利用1.2.2.3中方法,考察不同提取温度如85、90、95、100 ℃对枸杞多糖得率的影响,利用索式水提法,料液比为1∶15,仅改变提取温度,提取时间为1.5 h,提取2次,合并滤液浓缩至20 mL左右,以4~5倍95%的乙醇沉淀,放置24 h,抽滤,所得固形物先后以95%乙醇、无水乙醇、丙酮依次洗涤、真空干燥(50 ℃),即得固形物枸杞多糖粗粉。测定其中多糖含量时,首先将提取得到的粗多糖粉末,配制成0.10 mg/mL 的溶液,紫外检测其中α-无水葡萄糖的含量,实验结果如图4(E)所示。由实验结果可知,提取温度为100 ℃时,提取效果最佳。
2.2.6 验证试验
综上所述,枸杞多糖以索式水提时,料液比为1∶15,提取时间为1.5 h,提取2次,提取温度为100 ℃时,多糖得率较高。因此,为了验证该条件的正确性,在此条件下进行三组平行实验,枸杞多糖的得率分别为4.28%、4.46%、4.09%,平均得率为4.28%。
2.3 超声提取法提取枸杞多糖
同上,在本部分实验中的枸杞子原料粉末也是为首先利用2.1.6中的最佳条件将枸杞色素提取出来后的烘干的料渣,故本部分试验是先提取枸杞色素后再进行提取枸杞多糖。
2.3.1 不同超声时间对枸杞多糖得率的影响

图5 不同超声时间对枸杞多糖得率的影响Fig.5 Effect of different ultrasonic factors on the yield of Lycium barbarum polysaccharides
利用1.2.2.4的方法,考察不同超声时间如10、20、30、40、50、60 min时对枸杞多糖得率的影响,料液比1∶10,20%超声功率(最大功率1 200 W)下超声2次,仅改变超声时间,过滤,滤液于50~70 ℃浓缩,最后用95%乙醇沉淀,放置24 h,抽滤,所得固形物先后以95%乙醇、无水乙醇、丙酮依次洗涤、真空干燥(50 ℃),即得枸杞多糖粗粉。将提取得到的粗多糖粉末,配制成0.10 mg/mL 的溶液,紫外检测其中α-无水葡萄糖的含量,实验结果如图5(A)所示。由实验结果可知,超声20 min时,提取的效果最佳。
2.3.2 不同超声功率对枸杞多糖得率的影响
利用1.2.2.4的方法,考察不同超声功率如10%、15%、20%、25%、30%对枸杞多糖得率的影响,仅改变超声功率,料液比1∶10,超声2次,每次20 min,过滤,滤液于50~70 ℃浓缩,最后用95%乙醇沉淀,放置24 h,抽滤,所得固形物先后以95%乙醇、无水乙醇、丙酮依次洗涤、真空干燥(50 ℃),即得枸杞多糖粗粉。将提取得到的粗多糖粉末,配制成0.10 mg/mL 的溶液,紫外检测其中α-无水葡萄糖的含量,实验结果如图5(B)所示。由实验结果可知,超声效率25%时,超声提取多糖的效果最佳。
2.3.3 不同料液比对枸杞多糖得率的影响
利用1.2.2.4的方法,考察不同超声料液比如1∶10、1∶15、1∶20、1∶25、1∶30对枸杞多糖得率的影响,仅改变料液比,25%超声功率下每次超声2次,每次20 min,过滤,滤液于50~70 ℃浓缩,最后用95%乙醇沉淀,放置24 h,抽滤,所得固形物先后以95%乙醇、无水乙醇、丙酮依次洗涤、真空干燥(50 ℃),即得枸杞多糖粗粉。将提取得到的粗多糖粉末,配制成0.10 mg/mL 的溶液,紫外检测其中α-无水葡萄糖的含量,实验结果如图5(C)所示。由实验结果可知,超声料液比1∶10的条件下,超声提取的效果最佳。
2.3.4 验证试验
综上所述,枸杞多糖以超声水提时,超声20 min,超声功率25%,料液比为1∶10,多糖得率较高。因此,为了验证该条件的正确性,在此条件下进行三组平行实验,得其枸杞多糖的得率分别为5.35%,5.26%,5.08%,平均得率为5.23%。
2.4 枸杞多糖提取后枸杞色素的提取
由上可知,枸杞多糖的最佳提取条件为超声水提,可能是枸杞色素由于枸杞子已经过高温提取而损失,但超声又使枸杞子细胞进一步的充分破碎,且超声产生的热量又促使枸杞多糖溶解,因此在此条件下,超声水提法(5.23%)提取得到的枸杞多糖得率高于索氏水提(4.28%)。经超声水提未经处理过的枸杞子,然后再利用枸杞色素提取的最佳条件进行提取。结果发现,此时枸杞多糖的平均得率为7.45%,而枸杞色素的平均得率为2.48%。
2.5 不同提取次序对枸杞色素和枸杞多糖抗氧化活性的影响
考察不同提取提取次序对枸杞色素和枸杞多糖抗氧化活性的影响,通过相同浓度下的枸杞色素、枸杞多糖和Vc对DPPH·和·OH的自由基清除率来确定,由于提取次序不同,不仅造成了先提取的枸杞色素和枸杞多糖分别比后提取的得率高,也会由于提取过程的影响对不同提取次序下的枸杞色素和枸杞多糖产生影响。具体结果如图6所示:其中,枸杞色素1和枸杞多糖2分别代表先提枸杞色素然后再提的枸杞多糖,而枸杞色素2和枸杞多糖1则代表先提的枸杞多糖然后再提的枸杞色素。图6表明,在同样溶液浓度下,Vc对DPPH·和·OH的自由基清除率基本都是最大的,而枸杞色素和枸杞多糖则随着浓度的升高,抗氧化活性逐渐增强,尤其是枸杞色素1在浓度升高到0.60 mg/mL及更高时,对DPPH·自由基的清除能力十分接近Vc。另外,图6(A)和(B)均可发现,不同提取次序对于枸杞色素和多糖的影响不同,对枸杞多糖的影响不大,但对枸杞色素的影响比较大,这可是能在先提取枸杞多糖时,所用溶剂把枸杞色素上的脂质保护膜部分的破坏掉了,导致色素部分氧化造成的。同样条件下,枸杞色素的抗氧化活性较枸杞多糖的强,所以枸杞色素受影响的情况较为明显一点。总体上,枸杞色素1和枸杞多糖1对DPPH·自由基清除率都较高,枸杞多糖1对·OH自由基清除率都较高,其抗氧化活性接近Vc。
3 结论
综上,在以正己烷为提取溶剂,提取2次,每次1 h,料液比1∶10,提取温度为80 ℃时,可得到3.93%的枸杞色素,然后料渣通过超声水提,在超声20 min,超声功率25%,料液比为1∶10的条件下可得到5.23%的枸杞多糖。改变提取顺序,在同样的提取条件下,可分别得到7.45%的枸杞多糖,2.48%的枸杞色素。因为枸杞多糖是一种易溶于热水或稀酸、稀碱溶液,能被乙醇、丙酮等有机溶剂析出的蛋白多糖,超声提取法提取时,超声波能够破碎植物的细胞壁,从而可大幅度提高有效成分提取率。而枸杞色素则由于其本身性质的不稳定性,在先提取枸杞多糖时也会将枸杞色素部分的溶解出去,故后提取枸杞色素时其得率较低。同时,提取次序的改变对于枸杞色素和枸杞多糖的抗氧化活性都有一定的影响,但对枸杞色素的影响更大一点。总体上,枸杞色素1和枸杞多糖1对DPPH·自由基清除率都较高,枸杞多糖1对·OH自由基清除率都较高,其抗氧化活性接近Vc。在后续的研究中,将对多个提取条件的交互效应以及提取次序的改变对其他成分的改变和影响进行更多的深入研究。
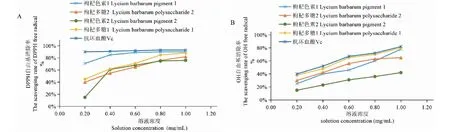
图6 枸杞色素、枸杞多糖及Vc的抗氧化活性Fig.6 Antioxidant activity of Lycium barbarum pigment,Lycium barbarum polysaccharide and Vc
