蕨菜多糖超声波辅助提取及其药理活性初步研究
2019-06-25郝经文陈林霖司华阳陈乃富陈乃东刘孝全
郝经文, 陈林霖,司华阳,陈乃富,陈乃东,李 彬,刘孝全
1 皖西学院,六安 237012;2安徽中医药大学,合肥 230031; 3湖北中医药大学,武汉 430065
蕨菜是采自蕨科蕨属植物蕨Pteridiumaquilinum(L.)Kuhn var.latusculum(Desv)Underw的幼嫩叶,别名拳头菜、如意菜、龙爪菜等,因其生长于天然林地,少受污染,是我国优质的绿色天然食品[1-3]。
近年来,随着蕨菜野生资源的开发利用,对蕨菜中化学成分的研究主要集中于黄酮、氨基酸、矿物质、维生素等物质[4-6],而对蕨菜多糖的研究相对较少。现代药理学研究表明,多糖作为一类重要的大分子化合物,具有免疫调节、抗肿瘤、抗氧化、降血糖及降血脂等药理作用,且毒性小,从而成为药效物质基础研究的热点[7-10]。开展蕨菜多糖的研究对蕨菜资源的深度开发具有重要意义。
本实验以大别山区野生蕨菜为原料,利用超声辅助提取方法,在单因素试验基础上采用响应面设计优化超声辅助提取蕨菜多糖的工艺参数,以促进小鼠脾细胞增殖和抑制结肠癌细胞(HCT-8)增殖能力的研究为例,对获得的蕨菜多糖免疫增强活性和抗肿瘤活性进行初步评价,旨在为蕨菜多糖的深入研究和蕨菜资源开发提供参考依据。
1 材料与方法
1.1 材料
蕨菜材料采自于安徽省霍山县,品种经皖西学院陈乃东教授鉴定。幼嫩叶鲜品洗净,在低温冻干机中冻干至恒重,粉碎、过40目筛,密封备用。
1.2 试剂与仪器
主要试剂:葡萄糖(标准品)、刀豆蛋白A(ConA)、DMEM培养基,购于Sigma-aldrich试剂公司;无水乙醇(分析纯),购于上海振兴化工试剂公司;乙醚(分析纯),购于上海中试化工试剂公司;丙酮、氯仿、硫酸(分析纯),购于西陇化工试剂公司;正丁醇(分析纯),购于天津博迪试剂公司;紫杉醇(标准品)、蒽酮、二甲基亚砜,均购于阿拉丁试剂公司; RPMI1640培养基,购于海克隆试剂公司;PBS溶液,购于上海立菲生物技术有限公司;红细胞裂解液,购自于Thermo试剂公司。
主要仪器与设备: TU-1901双光束紫外-可见分光光度计,北京普析通用仪器有限责任公司;KQ-5200B型超声波清洗器,昆山市超声仪器有限公司;HH-S6 型数显恒温水浴锅,江苏金坛市金城国胜实验仪器厂;GL-200-Ⅱ 型离心机,上海安亭科学仪器厂;GL-20G-Ⅱ 电子分析天平,上海安亭科学仪器厂;202A-3型数显电热干燥箱,上海锦屏仪器仪表有限公司;BB15型二氧化碳培养箱,ThermoFisher仪器有限公司; Thermo Scientific Microplate Reader 酶标仪,ThermoFisher仪器有限公司。
1.3 试验方法
1.3.1 标准曲线的制备
葡萄糖标准曲线的绘制参照文献[11],用蒽酮-硫酸法,于 621 nm下测样品吸光度值,得回归方程A= 9.561 4C+ 0.021 8,R2= 0.998 ,A为吸光度,C为浓度,计算出各供试样品的多糖含量[14-16]。
1.3.2 蕨菜样品粗多糖的提取及测定
准确称取0.5 g的蕨菜冻干粉,加入一定体积蒸馏水,超声波辅助提取、 5 000 rpm离心,收集上清液,定容,得蕨菜总多糖提取液,备用。
精密吸取 1.0 mL制备的多糖提取液,同“1.3.1操作”于 621 nm 下测吸光度值(A),计算出各供试样品的多糖含量[14]。
1.3.3 蕨菜精制多糖的制备
蕨菜精制多糖的制备参照相关文献[12],使用Sevag法除去粗多糖溶液中的蛋白质,冷冻干燥,得精制多糖。
1.3.4 单因素试验
采用单因素试验分别考察超声波辅助下液料比、浸提次数、超声浸提时间、超声功率4 个因素对蕨菜多糖提取得率的影响。
1.3.5 响应面法试验因素水平设计
根据Box-Behnken的中心组合试验设计原理[13-16],结合单因素试验结果,选择以液料比(X1)、浸提次数(X2)、超声浸提时间(X3)、超声功率(X4)作为相应变量,编码水平为-1,0和1,且以蕨菜多糖提取得率(Y)作为响应值,采用响应面法对蕨菜多糖提取条件进行优化。
1.3.6 蕨菜精制多糖对小鼠脾细胞增值的影响
小鼠脾淋巴细胞的制备参考文献[17],小鼠短颈处死后,置于70%乙醇溶液中浸泡3 min,于无菌条件下取出脾脏,置于病理级载玻片,压碎,PBS缓冲溶液冲洗,过200目筛网,制得脾细胞悬浮液。将制得的细胞悬浮液置于离心管中,1 200 rpm 离心5 min,除去上清,向离心管中加入1 mL红细胞裂解液,吹打均匀,静置4 min,1 200 rpm离心,除去上清液,加入适量的RPMI1640培养基,吹打均匀,使用台盼蓝染色,检测细胞活性在95%以上即可。
用RPMI1640培养基将蕨菜精制多糖配制0、1、5、10、50、100、500、1 000 μg/mL7个给药浓度。将小鼠淋巴细胞悬浮液加入96孔细胞培养板中,每孔100 μL,5×105个/孔,每孔加入10 μL不同浓度药液,以等体积的RPMI1640培养基作为空白对照组,以最终浓度为5 μg/mL的ConA给药为阳性对照组,每组设置5个复孔。在37 ℃、5%CO2条件下培养24 h,采用CCK-8法检测[18],每孔加入10 μL的CCK-8溶液,继续孵育4 h,终止培养,在490 nm下测定其吸光度值,用多功能酶标仪测定吸光度值(OD),实验设3次重复。
1.3.7 蕨菜精制多糖对结肠癌细胞(HCT-8)增殖的影响
蕨菜精制多糖对结肠癌细胞(HCT-8)增殖抑制及细胞培养参考文献[19],分别将结肠癌细胞HCT-8以1×104的数目接种于96孔细胞培养板中,每孔100 μL,空白组加入等体积的DMEM培养基,37 ℃、5%CO2培养12 h,待细胞贴壁后,加入不同浓度的蕨菜精制多糖药液10 μL,以最终浓度为100 nmol/L的紫杉醇为阳性对照[19], 在37 ℃、5%CO2条件下培养24 h,采用CCK-8法检测,每孔加入10 μL的CCK-8溶液,继续孵育4 h,终止培养,在490 nm下测定其吸光度值,用多功能酶标仪测定吸光度值(OD),实验设3次重复。
1.3.8 数据分析
使用统计分析软件SPSS 23.0和Design Expert.10.0对响应面法设计实验的结果进行分析,拟合二次多项式方程并绘制响应面图,确定蕨菜多糖的较佳提取工艺。
2 结果与分析
2.1 单因素试验
2.1.1 液料比对多糖提取得率的影响
在超声功率240 W、浸提次数3次、超声浸提时间30 min的条件下,比较不同液料比对蕨菜多糖提取得率的影响如图1所示。

图1 液料比对多糖提取得率的影响Fig.1 Effect of liquid /solid ratio on the extraction yield of polysaccharide
由图1可得,随着液料比的增大,多糖提取得率逐渐增大,当液料比(mL/g)在20~40∶1 时,多糖提取得率上升较快;当液料比大于40∶1 时,增长缓慢。液料比为60∶1和80∶1时获得的蕨菜多糖提取得率差异无统计学意义,过多使用提取溶液会造成后续处理的难度,且提高成本,当液料比为40∶1时获得较好的多糖提取得率,因此液料比控制在 40∶1为宜。
2.1.2 浸提次数对多糖提取得率的影响
在超声功率240 W、超声浸提时间30 min、液料比30∶1(mL/g)的条件下,比较不同浸提次数对蕨菜多糖提取得率的影响如图2所示。

图2 浸提次数对多糖提取得率的影响Fig.2 Effect of extraction times on the extraction yield of polysaccharide
由图2可得,浸提次数在1~3之间时,蕨菜多糖提取得率随浸提次数的增加而上升,浸提次数超过3次后,多糖提取得率的增加幅度趋于平缓,且浸提3次与浸提4次,浸提5次的蕨菜多糖提取得率差异不具有统计学意义,故浸提次数选择3次为宜。
2.1.3 超声浸提时间对多糖提取得率的影响
在超声功率240 W、浸提次数3次、液料比30∶1 (mL/g)的条件下,比较不同超声浸提时间对蕨菜多糖提取得率的影响如图3所示。

图3 浸提时间对多糖提取得率的影响Fig.3 Effect of time on the extraction yield of polysaccharide
由图3可得,随着超声浸提时间的增加,多糖提取得率显著提高,但当超声浸提时间超过40 min后,多糖提取得率增长缓慢,且超声浸提时间为40 min和50 min时提取得率差异不具有统计学意义,考虑到节约成本等因素,选40 min作为超声浸提时间为宜。
2.1.4 提取功率对多糖提取得率的影响
在超声浸提时间30 min、浸提次数3次、液料比30∶1(mL/g)的条件下,考察比较不同超声功率对蕨菜多糖提取得率的影响如图4所示。

图4 提取功率对多糖提取得率的影响Fig.4 Effect of ultrasonic power on the extraction yield of polysaccharide
由图4可得,超声功率在180~240 W时,多糖提取得率逐渐增大,当超声功率大于240 W时,多糖提取得率下降,说明超声功率对多糖提取得率的影响,既有正效应又有负效应,实际生产中应避免超声功率过大而引起得率下降,故选取超声功率240 W为宜。
2.2 四因素响应面试验分析结果
2.2.1 工艺参数优化
结合“2.1单因素试验”结果,以液料比(X1):30∶1(mL/g)、浸提次数(X2):3次、超声浸提时间(X3):40 min(X3)、超声功率(X4):240 W为中心点,用响应面分析方法进行四因素优化。中心试验设计及试验结果见表1。

表1 中心试验设计及试验结果Table 1 Design and results of central composite experiment
续表1(Continued Tab.1)
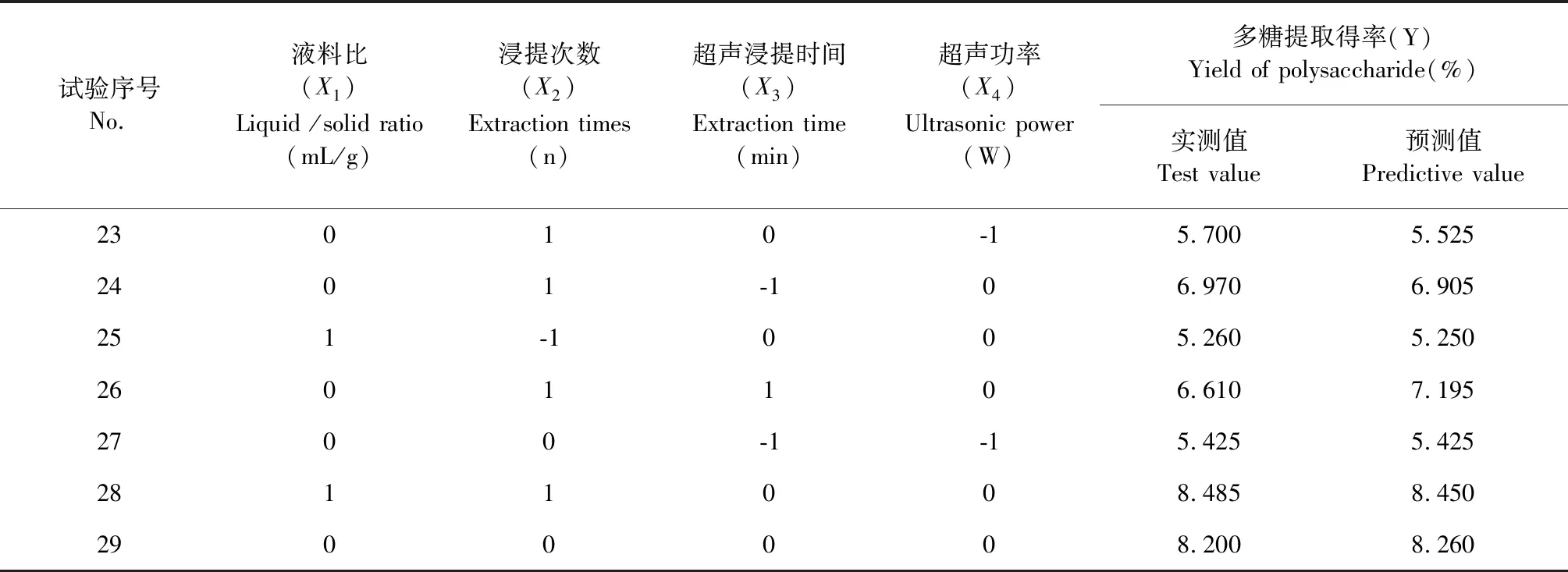
试验序号No.液料比(X1)Liquid /solid ratio(mL/g)浸提次数(X2)Extraction times(n)超声浸提时间(X3)Extraction time(min)超声功率(X4)Ultrasonic power(W)多糖提取得率(Y)Yield of polysaccharide(%)实测值Test value预测值Predictive value23010-15.7005.5252401-106.9706.905251-1005.2605.2502601106.6107.1952700-1-15.4255.4252811008.4858.4502900008.2008.260

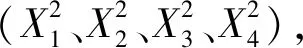
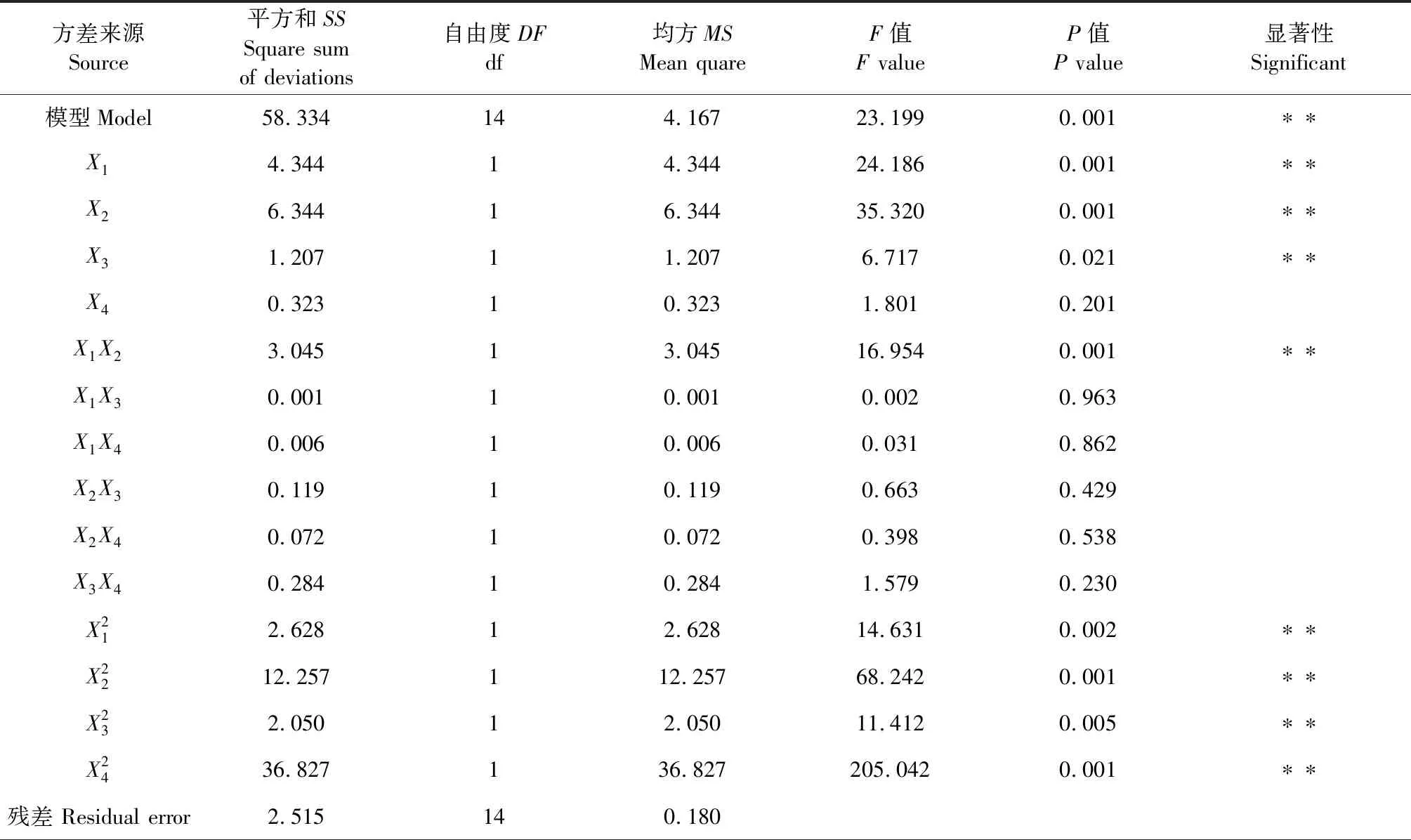
表2 回归模型的方差分析 Table 2 Variance analysis of regression model
续表2(Continued Tab.2)

方差来源Source平方和SSSquare sum of deviations自由度DFdf均方MSMean quareF值F valueP值P value显著性Significant失拟 Lack of fit2.472 10 0.247 23.361 0.004 ∗∗误差Error0.042 4 0.011 总变异 Cor total60.848 28 模型的决定系数Model determination coefficientR2=0.958 7模型的调整决定系数Adjust of model determination coefficientR2adj=0.917 4
注:*在a=0.05水平上显著,**表示在a=0.01水平上极显著。
Note:*Indicates significant at a=0.05 level,**Indicates extremely significant at a=0.01 level.
2.2.2 多糖提取条件的响应面优化分析
为了更直观地表现二个因素对多糖提取得率的影响,绘制四因素交互作用的响应面图(图5),由图5可知,响应面开口向下,随着每两个因素的值增加,响应值增大,当响应值增到极值后,又随着每两个因素的增加而逐渐减小。该模型有稳定点,且等高线图中的曲线都随着响应面的增加而形成一个顶点,即较佳的蕨菜多糖提取得率。

图5 四因素交互作用对多糖提取得率的响应面图Fig.5 Response surface plots showing the cross interaction among four factors on extraction rate of polysaccharide
经Design Expert 10.0 软件分析该模型得到的多糖优化提取条件为液料比:36.2∶1 mL/g、 超声浸提时间 :43.1 min、浸提次数:4.28次、超声功率:239.17 W。 在此条件下,蕨菜多糖理论提取得率达 8.72%。 根据实际情况调整后的优化提取条件为:液料比:36.2∶1 mL/g、 超声浸提时间:43.1 min、浸提次数:4次、提取功率:240 W。在此条件下,重复 3 次试验得多糖提取得率如表3所示,其提取得率为 8.60%,预测值与实际值接近,因此该工艺参数可用来指导蕨菜多糖提取。

表3 预测值与优化工艺试验值的比较Table 3 Comparison of simulation and optimized experimental results
2.3 蕨菜多糖药理活性研究
2.3.1 蕨菜多糖对脾细胞增值的影响
蕨菜多糖对小鼠脾细胞增殖的影响如由图6所示,空白对照组与阳性对照组相比具有显著性差异(P<0.05),说明ConA诱导小鼠脾细胞增殖,提示造模成功,药物组与空白对照组相比,(1~50 μg/mL)各组吸光度均有显著差异(P<0.05),提示该浓度范围内蕨菜多糖对诱导脾细胞增殖具有明显的促进作用,且当蕨菜多糖的浓度达到1 000 μg/mL时,吸光度与空白对照组比较有显著差异(P<0.05),其对脾细胞增殖具有抑制作用,因此表明蕨菜精制多糖在一定浓度范围内具有免疫增强活性。

图6 蕨菜多糖对小鼠脾淋巴细胞增殖的影响Fig.6 Effects of polysaccharide from P.aquilinum on proliferation of mice spleen lymphocyte
2.3.2 蕨菜多糖对肠癌细胞(HCT-8)的抑制效果
蕨菜多糖对结肠癌细胞HCT-8的抑制情况,使用CCK-8法检测细胞增殖抑制情况,由图7可得,细胞增殖抑制率与剂量(5~50 μg/mL)蕨菜多糖下呈依赖性抑制。且在该浓度范围内反应时间相同时,蕨菜多糖的浓度越大,细胞增殖抑制率越高,与对照组比较具有显著性差异(P<0.01);当蕨菜多糖剂量增加到500 μg/mL时,细胞生长抑制率超过常用抗癌药物(100 nmol/L)紫杉醇对结肠癌细胞HCT-8的抑制率,结果为蕨菜多糖开发成抗癌药物提供一定参考。

图7 蕨菜多糖对结肠癌细胞增殖抑制的影响Fig.7 Effects of polysaccharide from P.aquilinum on inhibits the proliferation of HCT-8 cells
3 结论
采用响应面分析法优化蕨菜多糖提取工艺,得到优化工艺条件为:液料比:36.2∶1 mL/g、超声浸提时间:43.1 min、浸提次数:4次、超声功率:240 W。在此条件下,蕨菜多糖中多糖的提取得率达8.60%,且各因素对多糖提取得率的影响依次为:浸提次数>液料比>超声浸提时间>超声功率,此提取工艺条件合理可行。
通过比较不同浓度的蕨菜精制多糖对小鼠脾细胞增殖能力和抑制结肠癌细胞(HTC-8)增殖能力的影响,结果表明:在一定浓度范围内蕨菜精制多糖能提高小鼠脾细胞增殖率和抑制结肠癌细胞(HTC-8)的增殖,提示蕨菜多糖在深度开发成提高免疫力和天然抗癌药物等领域具有较好的潜力。
