豌豆根瘤菌RND外排转运基因tpaA的功能研究
2019-06-25程国军罗莎谢婧吴和涛
程国军,罗莎,谢婧,吴和涛
(中南民族大学 生命科学学院/微生物资源与利用湖北省工程技术研究中心,武汉 430074)
根瘤菌是一类革兰氏阴性土壤细菌.可以与特定的宿主植物共生形成结瘤,并将空气中的分子氮转化为植物可以使用的氨态氮,是能与豆科植物结瘤的共生固氮细菌的总称. 一般来说,根瘤菌被分为6个属,皆属于α-变形杆菌[1]. 根瘤菌积极参与细胞外信号传导至宿主豆科植物的过程,以引发感染和根瘤形态发生. 根瘤菌也可利用N-酰基高丝氨酸内酯信号进行群体感应基因调控,增强与豆科植物的相互作用和在胁迫下的存活[2].
前期对豌豆根瘤菌3841的转录组的生物信息学分析研究发现,tpaA基因是编码RND外排泵转运蛋白的基因. 细菌的外排泵主要有5个家族,分别是易化子超家族(MFS 家族)、ABC转运家族、小型多药防御家族(SMR家族)、防御结瘤分裂家族(RND家族即RND外排泵) 和多药有毒化合物排出家族(MATE家族)[3]. 基因组分析和微阵列分析表明:主动外排是细菌内在耐药性的主要机制,而RND外排泵是一种与抗生素外排直接相关的外排泵,几乎所有的这类外排泵都与耐药性有关[4,5]. 革兰氏阴性细菌比阳性细菌对抗生素显示出更强的耐受性,RND外排泵的过量表达是革兰阴性菌细菌抗生素耐药性形成的重要原因之一[6]. 革兰氏阴性菌RND外排泵主要由3部分组成,分别是在细胞内膜上的转运蛋白即RND内膜外排转运蛋白(RND efflux transporters)、细胞周质膜融合蛋白(MFP)和细胞外膜上的孔道外排蛋白(OMF)[7]. 其中,RND内膜外排转运蛋白负责细菌细胞膜上和周质空间药物的结合和转运. RND外排泵系统对许多抗生素具有外排作用,主要与细胞内膜的转运蛋白有关[8],所以缺少其中任一部分在细菌对药进行外排的过程中,都将会导致其耐药性能的丧失[9]. 研究编码外排泵系统蛋白的相关基因在根瘤菌共生固氮中的作用机制、并分析根瘤菌中RND外排泵功能以及其与耐药性和致病性的关系,对于揭示根瘤菌的耐药机制,降低致病性具有重要的指导意义.
R.leguminosarum3841tpaA基因编码RND家族内膜外排转运蛋白,在对tpaA基因进行生物信息学分析的基础上,通过构建R.leguminosarum3841tpaA基因突变株,研究tpaA基因突变对根瘤菌生长、抗生素耐药性以及根瘤共生的影响,为深入阐明RND家族内膜外排转运蛋白在根瘤菌中的作用机制奠定基础.
1 材料与方法
1.1 菌株质粒和培养基
豌豆根瘤菌R.leguminosarumbv.Viciae3841、突变体构建载体pk19mob由英国牛津大学Philip S Poole教授提供. 根瘤菌培养基为TY天然培养基或AMS基本培养基,大肠杆菌为LB培养基.抗生素均购于Sigma公司,其中筛选和培养大肠杆菌所用抗生素及浓度:卡那霉素(Km)20 μg/mL; 四环素(Tc)5 μg/ mL. 筛选和培养根瘤菌所用抗生素及浓度:四环素(Tc)2g/mL,链霉素(Str) 500g/mL,新霉素(Neo) 80g/mL. 实验所用的菌株与质粒见表1.

表1 实验所用的菌株与质粒Tab.1 The strains and plasmids used in this paper
1.2 主要试剂
限制性内切酶(XbaⅠ、BamHⅠ、Hind Ⅲ等)、T4 DNA连接酶、RNAiso Plus(TaKaRa);Phusion 高保真酶、TaqDNA 聚合酶(Thermo Scientific);反转录试剂盒为PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time),FastStart Universal SYBR Green Master (Rox);PCR产物回收试剂盒以及DNA凝胶回收试剂盒(博大泰克公司).
1.3 R. leguminosarum tpaA 突变体的构建
参照田梦洋等[10]方法构建豌豆根瘤菌tpaA基因突变体,抽提豌豆根瘤菌3841总DNA,以R.leguminosarum3841总DNA为模板,以tpaAUP/tpaALW为PCR引物扩增得到tpaA基因片段. 研究所用PCR引物如表2.
表2 PCR引物序列
Tab.2 Sequences of the PCR primers

(5′→3′)tpaAUPAAA TCT AGA TGA GAT TAT ATC AGG GTC TGtpaALWAAA GGA TCC ACG ATG CTG GCA AGC TTG GTtpaAMapAGA TCC GTC TGC TTG AAG GTpK19AATC AGA TCT TGA TCC CCT GCpK19BGCA CGA GGG AGC TTC CAG GGQtpaAUPAGGAATACGACCGGCAGCTCQtpaALWGAGATCGAGATTGGCCTGAGgyrB1UPGGC ATC ACC AAA AGG GAA AAgyrB1LWGCG AGG AGA ATT TCG GAT CA
注:下划线为限制性酶切位点
将扩增得到的目的片段与载体pK19mob分别用XbaⅠ和BamH Ⅰ双酶切,酶切产物经T4 DNA连接酶连接过夜,转化大肠杆菌DH5α感受态细胞. 转化子质粒经酶切和PCR验证正确后,获得tpaA基因突变体构建质粒pKtpaA. 以R.leguminosarum3841为受体菌,含pRK2013质粒的大肠杆菌为辅助菌,含pKtpaA质粒的大肠杆菌为供体菌进行三亲本杂交,获得的转移接合子,通过抗性筛选后用引物tpaAMap/pK19A或 tpaAMap/pK19B对接合子进行PCR验证,筛选tpaA基因突变株RLtpaA.
1.4 菌株生长实验
将野生型豌豆根瘤菌3841和突变体菌株RLtpa接种到含相应抗生素的TY斜面培养基上,于30 ℃培养箱中培养1 d后用AMS液体培养基洗脱,重悬接种到AMS液体培养基或TY液体培养基中,初始OD600为0.01,在30 ℃,200 r/min的恒温震荡摇床中培养,定时测OD600. 包括下面各项实验在内,所有菌株实验均3组重复.
1.5 抗生素抗性实验
将野生型豌豆根瘤菌3841和突变体菌株RLtpaA接种到含相应抗生素的TY培养基上,30 ℃培养1 d后用3 mL不含抗生素的TY液体培养基洗脱,取10 μL 103CFU菌液点样在分别含有链霉素(750g/mL,500g/mL,250g/mL)、氯霉素(5g/mL)、四环素(1g/mL)、壮观霉素(5g/mL)、氨苄青霉素(10g/mL,50g/mL,100g/mL)的TY培养基上,30 ℃培养3 d,统计突变体和野生型菌落的生长情况[11].
1.6 接种植株共生固氮酶活的测定
采用无菌蛭石种植甜豌豆[12]. 将消毒后的豌豆种子播种于已灭菌的蛭石烧杯内,再分别接种野生型豌豆根瘤菌3841和突变体菌株RLtpaA菌液,每颗豌豆上接种1 mL菌液. 播种完成后用保鲜膜封口,在光照培养箱中培养1周后挑破幼苗上的保鲜膜,并定期浇灌营养液,4周后用乙炔还原法测定根瘤固氮酶活性.
1.7 qRT-PCR分析tpaA基因在根瘤中的表达
野生型3841菌株接种豌豆植株,培养25 d后采集豌豆植株,采用Trizol法提取类菌体总RNA,反转录成cDNA. 以AMS培养的对数期3841菌株为对照,对类菌体中的tpaA基因进行荧光定量PCR分析. qRT-PCR引物见表2,gyrB1基因为内参.
2 结果与分析
2.1 豌豆根瘤菌3841 tpaA生物信息学分析
在NCBI上通过基因序列分析发现豌豆根瘤菌3841tpaA基因编码RND家族内膜外排转运蛋白(图1),含有399个氨基酸. RND外排泵 (resistance-nodulation-cell division family)即耐药节结化细胞分化家族,能够从胞内和细胞周质中捕获底物并有效地排到胞外,减少抗生素在菌体内积聚[13]. 细菌中几乎所有RND类外排泵都与耐药性相关,其中,革兰阴性菌的耐药性主要由RND外排泵引起[14].

图1 豌豆根瘤菌3841中TpaA蛋白结构域分析Fig.1 Analysis of the protein domains of TpaA in R. leguminosarum 3841
2.2 豌豆根瘤菌tpaA突变菌株的构建
以豌豆根瘤菌3841为受体菌,含pRK2013质粒的大肠杆菌菌株为辅助菌,含pKtpaA质粒的大肠杆菌为供体菌进行三亲本杂交后,通过抗性筛选及用引物tpaAMap/pK19A或tpaAMap/pK19B为引物对接合子进行PCR验证后表明,tpaA基因突变株RLtpaA构建成功.
2.3 tpaA基因突变对菌株生长的影响
活化的RLtpaA菌株与野生型3841菌株生长实验表明(图2, 3),在AMS基本培养基中,前20 h野生型3841菌株比突变体RLtpaA菌株生长更快,表明tpaA基因突变会使豌豆根瘤菌延迟生长. 而在TY天然培养基中,野生型3841菌株和突变体RLtpaA菌株生长变化趋势相同,tpaA基因突变不影响豌豆根瘤菌在天然培养基中的正常生长(图3).

图2 AMS培养基中3841与RLtpaA菌株的生长情况Fig.2 The growth of 3841 and RLtpaA in AMS medium

图3 TY培养基中3841与RLtpaA的生长情况Fig.3 The growth of 3841 and RLtpaA in TY medium
2.4 tpaA基因突变对根瘤菌抗生素抗性的影响
将活化的野生型豌豆根瘤菌3841和突变体菌株RLtpaA在分别含有不同浓度的多种抗生素的TY培养基上培养3 d后,在选择性抗生素培养基中野生型菌株3841比突变体菌株RLtpaA表现出了更强的抗生素抗性(表3),由于RND家族外排泵的表达是革兰阴性菌细菌抗生素耐药性形成的重要原因之一,表明tpaA基因突变可能会抑制根瘤菌中的RND家族外排泵的表达,从而降低其抗生素耐药性.

表3 根瘤菌菌株对抗生素的敏感性Tab.3 The sensitivity of Rhizobium strains to antibiotics
注:+++,++,+ 表示生长状况良好、一般、不好
2.5 豌豆盆栽实验
盆栽4周后,接种了tpaA基因突变株RLtpaA的豌豆植株形成红色有效根瘤. 将接种根瘤菌的豌豆植株利用乙炔还原法测定根瘤固氮酶活性,突变株接种植株比野生型接种植株的固氮酶活性减少了10.5% (图4),表明tpaA基因突变对根瘤菌的固氮酶活性有一定的影响.
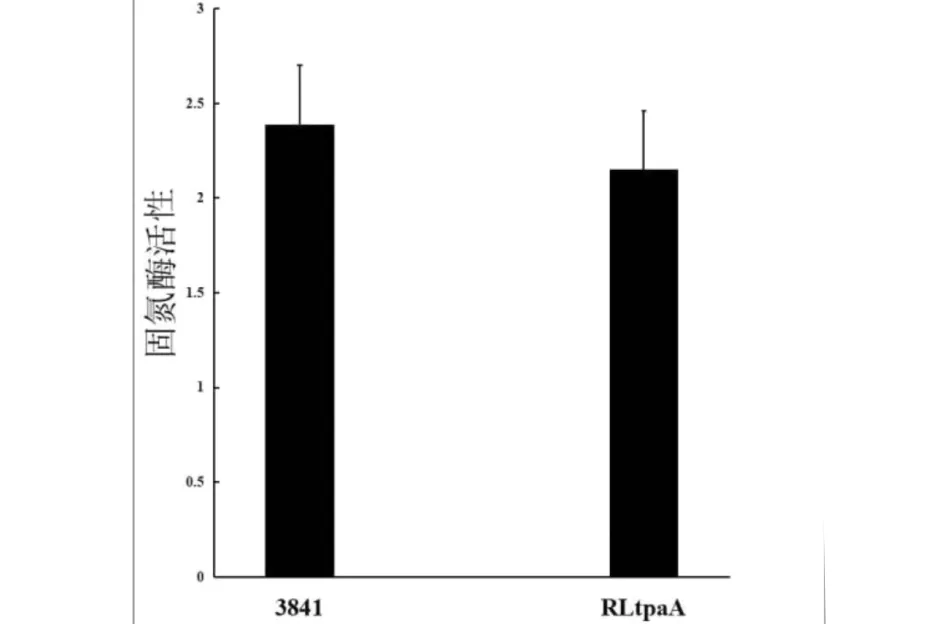
图4 豌豆根瘤菌3841和突变菌株RLtpaA的固氮酶活性Fig.4 The symbiotic nitrogenase activity of RLtpaA and 3841
2.6 tpaA基因在根瘤类菌体中的表达
荧光定量RT-PCR分析tpaA基因在根瘤类菌体中的表达量,结果表明在形成25 d根瘤类菌体中表达量为在自生条件下的2.37±0.29倍. 统计分析表明,tpaA基因的表达达到显著差异(P<0.05),说明tpaA基因的表达受根瘤共生环境的诱导.
3 讨论
抗生素耐药性一直是细菌性疾病防治中的一个难题.细菌的外排泵可以增强细菌耐抗生素的能力, 而外排泵的过量表达是细菌耐药性形成的重要机制之一. RND多耐药外排泵对革兰氏阴性细菌耐药性贡献很大,在大肠杆菌和铜绿假单胞菌中发现的以耐药结节分化家族为代表的多耐药外排泵成为人们关注的焦点[15].
tpaA基因编码RND外排泵转运蛋白,该基因突变会使根瘤菌在基本AMS培养基生长延迟,但不影响其在天然培养基TY中的正常生长. 说明失去该基因之后,细菌生长受到了部分抑制,这可能是因为菌株生长到一定阶段后,细胞内通过代谢产生的不利产物不能通过转运排出体外,从而影响菌体生长繁殖.tpaA基因突变株接种豌豆植株能形成红色有效根瘤,但其固氮酶活酶减少了10.5%,表明tpaA基因突变对根瘤菌的共生酶活有一定的影响. Takeshima等[16]发现用染料木黄酮处理大豆根瘤菌后,外排泵基因受到诱导表达明显上调. 本研究也表明tpaA基因在根瘤类菌体中的表达显著上调且显著差异. Eda等[17].通过调控寄主植物中抑菌化合物的分泌,证明了苜蓿根瘤菌主要外排系统SmeAB对结瘤竞争力起到了重要作用野生型菌株3841比突变体菌株RLtpaA表现出更强的抗生素抗性. 由于RND家族外排泵的表达是革兰氏阴性菌抗生素耐药性形成的重要原因之一,表明tpaA基因突变可能会抑制根瘤菌中的RND家族外排泵的表达,从而使得其抗生素耐药性降低. 已有研究发现RND外排泵引起铜绿假单胞菌耐药性及影响其致病性.虽然细菌外排泵的研究历史较长,但根瘤菌中外排泵的报道较少,外排泵系统相关基因在根瘤菌共生固氮中的作用机制值得深入研究.
