葡甘露聚糖-虾青素复合物的表征及对AFB1致肉鸡肝损伤的影响
2019-06-25汪文俊王胜军余诚余程向福
汪文俊,王胜军,余诚,余程,向福
(1武陵山区特色资源植物种质保护与利用湖北省重点实验室,中南民族大学 生命科学学院,武汉430074;2 湖北省武昌实验中学高二(9)班,武汉 430060 ;3大别山特色资源开发湖北省协同创新中心,黄冈师范学院,黄冈 438000)
近年饲料、食品及其原料广泛受到霉菌毒素污染是一个全球性问题,黄曲霉毒素尤其是黄曲霉毒素B1(AFB1)的残留问题尤被关注[1].AFB1严重危害人畜生命和生产安全,对肝脏有特殊的亲和性,经肝脏代谢为毒性极强的AFB1-8,9-环氧化物(AFBO)等,影响动物生长性能、消化代谢、肉品质甚至导致死亡[2-4].
酵母细胞壁上富含的葡甘露聚糖(GM)是由甘露糖和葡萄糖通过β糖苷键连接而成的高分子多糖[5],葡甘露聚糖对霉菌毒素有很强的吸附作用,能有效抵抗霉菌毒素的毒性[6-8].虾青素(3,3′-二羟基-β,β′-胡萝卜素-4,4′-二酮,ASTA)是一种重要的类胡萝卜素,有抗氧化、抗炎、抗肿瘤等活性,因其优良的色素沉积作用并能促进动物发育,在饲料工业、养殖业及医药工业中应用广泛[9],前期研究表明ASTA对AFB1引起的肉鸡肝损伤有显著改善作用,其与GM配合使用能显著地消除AFB1的毒害作用[10].
红法夫酵母富含ASTA和GM,本文从红法夫酵母中提取GM、ASTA,并将二者制备复合物,对提取物及其复合物进行了表征,并考察了其对AFB1致肉鸡肝损伤的影响.
1 材料与方法
1.1 仪器和材料
全自动发酵罐(Biostat 5, B. Braun, Germany,工作体积为3 L);傅里叶变换红外光谱仪(EQUINOX55型,德国Bruker);热失重分析仪(NETZSCH STA 4493F3,耐驰科学仪器);全自动生化分析仪(7020,日本日立).
1.2 菌种与培养条件
红法夫酵母4 ℃保藏于YM斜面.YM培养基:葡萄糖10 g/L、酵母浸粉3 g/L、蛋白胨5 g/L、麦芽汁3 g/L、琼脂20 g/L (用于制作平板时添加),pH 5.0.发酵培养基:葡萄糖50 g/L、酵母浸粉8 g/L、KH2PO41.5 g/L、NaH2PO41 g/L、MgSO42 g/L,自来水配制,pH 5.0.斜面上挑取一环菌种于YM培养基中,培养过夜后种子液以10%(体积比)接种量接种到500 mL三角瓶(含有YM培养基50 mL)中,18 ℃、200 r/min下摇床振荡培养36 h制备种子液,将种子液按10%接种量接种到在5 L全自动发酵罐中于20 ℃、搅拌速度200 r/min、通气量为0.36 vvm下进行培养80 h.
1.3 GM、ASTA提取和复合物制备
GM和ASTA提取方法参见文献[11,12].将丙酮溶解的ASTA (100 mg/L)缓慢加入GM丙酮液[δ(ASTA∶GM)=1∶100],同时剧烈搅拌30 min,室温挥发丙酮,得到GM-ASTA复合物.
1.4 红外光谱分析
将GM、GM-ASTA复合物、GM和ASTA物理混合物(两种物质按质量比1∶100的比例混合所得)经KBr压片,在红外光谱仪上4000~400 cm-1区间红外扫描.
1.5 热失重分析
准确称取GM、GM-ASTA复合物、GM和ASTA物理混合物20~25 mg,进行热失重分析,N2气氛,流速40 mL/min,升温速度20 ℃/min,温度范围20~600 ℃.
1.6 GM-ASTA复合物结合位点分析
利用Hyperchem软件模拟GM空间结构(力场: MM+,几何优化: Polak-Ribiere),GM和ASTA结构如图1所示.利用frodock软件,基于范德华力、静电力和疏水作用力进行计算,预测GM和ASTA之间相互作用的可能性位点[13].
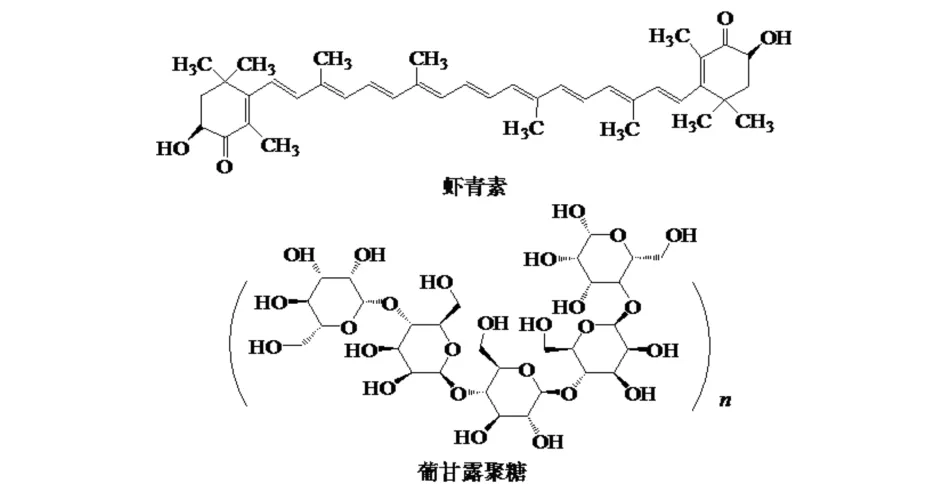
图1 ASTA和GM的分子结构Fig.1 The molecular structure of ASTA and GM
1.7 GM-ASTA复合物对AFB1致肉仔鸡肝损伤的影响
1.7.1 试验设计及基础日粮
1日龄商品代艾维茵肉仔鸡,正常饲料育雏10 d后,选取90只随机分为3个处理组,每个处理5个重复,每个重复6只鸡,具体如下:(1)对照组:正常玉米组;(2)AFB1饲料组:含有400 mg/kg AFB1;(3)复合物组:含有400 mg/kg AFB1+5 g/kgGM-ASTA复合物.为防止在饲养过程中饲料霉变,配料前所有玉米的含水率控制在12%以下,并于干燥、阴凉条件下存放.基础日粮配制见文献[14].
1.7.2 饲养管理
采用网上平养的方式,每笼6只,试验前将鸡舍、鸡笼进行彻底清扫,熏蒸消毒.于第7、21 日龄接种新城疫IV苗,28日龄接种法式囊疫苗.从第10 d正式开始试验,饲喂相应的饲粮.整个试验内,鸡自由采食和饮水.第1周室温控制在32~36 ℃,以后每周降低2 ℃,直至温度降至25 ℃,最后控制在22~25 ℃之间,相对湿度约55%~60%,饲养期为42 d.
1.7.3 肉鸡肝脏指标分析
于35日龄,每个重复随机选取体重相近的2只鸡,取肝脏中部约5 g,装入5 mL冻存管中,立即浸入液氮后置-80 ℃低温冰箱中保存,采用相关试剂盒测定丙二醛(MDA)、超氧化物歧化酶(SOD).取部分肝组织于10%中性福尔马林溶液中固定,进行组织病理学观察.经脱水、浸蜡、包埋、切片等处理步骤,再经苏木精-伊红染色,光镜下观察.
2 结果与分析
2.1 GM-ASTA复合物红外光谱
GM、GM-ASTA物理混合物、GM-ASTA复合物经KBr压片,在4000~400 cm-1区间进行红外光谱扫描,结果见图2.如图2所示,红外图谱中含有多个特征吸收峰[11],在3420.1 cm-1处有强的O—H键的伸缩振动引起的特征吸收,在2936 cm-1和1393 cm-1处有两组糖类C—H的伸缩振动引起的特征峰,分别代表了糖类C—H伸缩振动与变角振动,1470 cm-1处为GM-ASTA复合物的—CH键因形成复合物而转向更低的波长,由于二者之间形成了氢键,在1641 cm-1处有C—O非对称伸缩振动峰,1073 cm-1处为O—H变角振动峰,红外光谱在1700~1775 cm-1范围内无吸收.
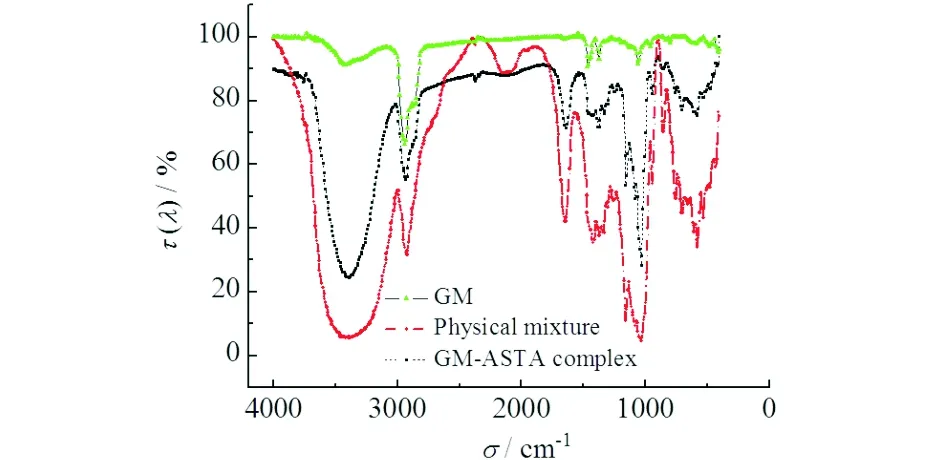
图2 GM-ASTA复合物红外光谱Fig.2 Infrared spectrum of GM-ASTA complex
2.2 GM-ASTA复合物热失重分析
GM、GM-ASTA物理混合物、GM-ASTA复合物在N2氛围下以20 ℃/min速度升温进行热失重分析,结果见图3.如图3所示:3种样品为两阶段热失重过程,第一阶段热失重温度区域几乎相同,在50~150 ℃之间,主要为样品吸附水分损失而形成的失重;而第二阶段的热失重主要为样品分解产生的失重,其中GM-ASTA复合物最稳定,热分解温度为275 ℃,较GM、GM-ASTA物理混合物的热失重温度250 ℃高了约25 ℃,表明在GM和ASTA之间发生某种作用而形成了GM-ASTA复合物,提高了其二次热失重的稳定性.此外,GM-ASTA两阶段的热失重率分别为62.22%和13.81%,表明复合物形成过程是按一定的比例进行的.

图3 GM-ASTA的热失重分析Fig.3 Thermo-gravimetric analysis of GM-ASTA
2.3 GM-ASTA复合物结合位点拟合分析
GM-ASTA复合物结合位点拟合分析计算共发现248个结果,其中相关性最高的结果见图4.如图4所示,ASTA结合在GM的两侧链间,不与乙酰基结合(从而不影响溶解性),而是通过与侧链的C24,C25,O29等原子,和主链的C12、C13、C14、C20,C21,O14,O17、O18、O20等原子形成较强的范德华力和静电力而紧密结合.

a)骨架结构结合位点图; b) 分子结构结合位点图图4 GM与ASTA结合位点分析Fig.4 Binding site analysis of GM and ASTA
2.4 GM-ASTA复合物缓解AFB1致肉仔鸡肝损伤
2.4.1 GM-ASTA复合物对抗氧化水平的影响
肉鸡35日龄肝脏组织中SOD,MDA活性结果见表1.
表1 GM-ASTA复合物对肉鸡肝脏组织中SOD、MDA活性的影响
Tab.1 Effects of the GM-ASTA complex on the activitiy of SOD and MDA from broiler liver tissue

SOD/(U·mg-1)MDA/(nmol·mg-1) 298±19 4.81±0.53 AFB1 245±24∗ 5.29±0.90∗ GM-ASTA 286±48 4.47±0.51
*与对照组相比,P<0.05
由表1可见,AFB1污染饲料SOD活性较对照组显著降低(P<0.05),MDA活性具有增加的趋势,但差异不显著(P>0.05),表明AFB1污染饲料可降低肝脏的抗氧化能力.与AFB1污染饲料组和对照组相比,GM-ASTA复合物组SOD和MDA活性差异均不显著(P>0.05),表明GM-ASTA吸附剂缓解了发霉饲料所致抗氧化能力的下降.
不同试验组肉鸡肝脏组织病理学结果如图5所示.由图5a中对照组肝脏中央静脉结构清楚,肝细胞大小一致,胞核、胞浆清晰;图5b中AFB1组脂肪变性肝细胞较多,局部红细胞略变,部分胞浆内有不清晰的小泡,间结成分少,部分存在淋巴细胞小结,局部红细胞脂变,间质内管道系统上皮细胞增生,增生结节更明显;而图5c中GM-ASTA组基本结构清晰一致,少量淋巴细胞小结淤血,部分肝细胞轻度变性,有个别轻度脂变,未见明显异常.说明GM-ASTA具有较好的AFB1解毒能力.

a)对照组; b) AFB1组; (c) GM-ASTA+AFB1组图5 不同试验组肉鸡肝脏组织病理学Fig.5 Broiler liver histopathology under different treatments
3 讨论
研究表明酵母细胞壁中GM对霉菌毒素有很强的吸附作用,能有效抵抗霉菌毒素的毒性[7-9],前期研究表明GM和ASTA共同作用能有效地降低AFB1毒性,缓解AFB1诱导的肉鸡肝损伤,效果与对照物污染饲料组无显著差异,对AFB1有明显的吸附作用并具有解毒效果[11].多糖分子与小分子之间往往通过静电引力、范德华力或疏水作用发生相互作用而形成复合物[15,16].如能将GM和ASTA制备成复合物,用于AFB1的吸附解毒,会有良好的效果.为此本文采用红外光谱、TGA分析及分子对接模拟研究从红法夫酵母提取的GM、ASTA制备的GM-ASTA复合物,证明ASTA和GM主链通过范德华力和静电力紧密结合而形成了复合物, 复合物中GM、ASTA结合较稳定.
AFB1中毒的症状包括肝组织中出现大的脂肪空泡聚集在核的周围,对肉鸡的肝脏造成中度至重度水肿和肝细胞脂肪化[9].本实验中AFB1饲料组导致明显的脂肪变性、淋巴细胞增生和血管充血,表明AFB1对肝组织造成了损伤,GM-ASTA复合物组基本正常,其缓解程度与血液生化指标和抗氧化水平结果相一致,说明GM-ASTA复合物能显著的改善AFB1导致的肉鸡肝损伤,其具有吸附AFB1并解除其毒性的双重功效.
