可见光促进下喹啉5-位选择性三氟甲基化反应
2019-06-25孙焕陈晓伟周义博盛典李正辉刘吉开
孙焕,陈晓伟,周义博,盛典,李正辉,刘吉开*
(1中南民族大学 药学院,武汉430074;2 中南民族大学 民族药学国家级实验教学示范中心,武汉430074)
含氟有机化合物是一类非常重要的化合物,在医药、材料、农业等领域发挥着重要作用[1].统计结果显示:在医药领域,20%~25%的药物分子中至少含有一个氟原子,而在作物保护领域,这一比例更是高达35%[2](见图1).
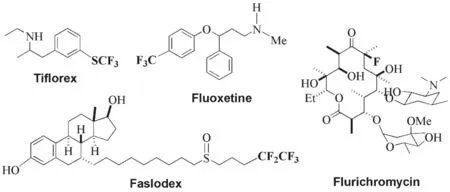
图1 含氟药物分子举例Fig.1 Selected drug molecules containing fluorine
氟原子的引入,可诱导化合物的物理化学和生物特性,如生物活性、新陈代谢稳定性和药物动力学的特性发生显著改变[3].但自然界中的含氟天然产物屈指可数,实现含氟有机化合物的高效合成,是有机化学家和药物化学家关注的热点和难点之一.
含氟化合物的合成通常通过对有机化合物进行氟化或氟烷基化实现[4].其中,氟烷基化主要依赖各种氟烷基化试剂通过亲核反应、亲电反应和自由基反应实现.近年来,可见光促进的氟烷基化反应因其在单电子氧化还原电势方面的优势和反应条件温和、底物普适性广等特点受到了有机合成化学家的广泛关注[5].Umemoto试剂、Togni试剂、Langlois试剂、氟烷基卤化物、氟烷基磺酰氯、氟烷基膦盐、氟烷基亚砜亚胺、氟烷基砜试剂等先后被报道可作为氟烷基自由基前体实现向有机分子中高效引入氟烷基[6].
喹啉是一类重要的含氮杂环化合物,其广泛存在于天然产物、生物活性分子及农业化学品当中,在药物发现、材料科学、催化等领域扮演着重要角色[7](见图2).此外,喹啉类化合物可作为荧光探针用于阳离子(如Fe3+和Zn2+)的检测和细胞荧光成像当中[8,9].近年来,氨基喹啉类化合物作为一种经典的双齿配体用于惰性碳氢键活化的导向基团[10].基于喹啉类化合物的广泛应用,合成喹啉类化合物衍生物具有重要的研究价值.

图2 喹啉类活性分子举例Fig.2 Selected active molecules containing quinoline skeleton
前期,喹啉类化合物的选择性官能团化通常局限于喹啉的2位、3位、4位和8位[11],而对5位的直接官能团化较为少见.自2013年Stahl课题组首次报道了喹啉5-位选择性氯化反应以来[12],5-位选择性卤代、硝基化、重氮化、烷基化等反应先后丰富了喹啉类化合物的结构多样性.吉林大学李继贞课题组[13]和本课题组[14]先后报道了硫酸镍或醋酸铜催化下以NFSI或Selectfluor为氟化试剂实现喹啉5-位选择性氟化的实例.针对5-位氟烷基的选择性引入,以碘化亚酮为催化剂、Togni试剂或三氟亚甲磺酸钠为氟烷基化试剂可实现喹啉5-位的选择性三氟甲基化[15,16].除使用过渡金属催化策略外,以高碘试剂为氧化剂、氟烷基硅试剂为氟烷基化试剂同样可在温和条件下实现5-位全氟烷基化[17].可见光作为清洁、廉价、可再生资源能促进喹啉5-位或8-位的全氟烷基化[18].本文在前人研究的基础上,以Umemoto试剂为三氟甲基自由基前体,在可见光促进下实现对8-氨基喹啉类化合物5-位的选择性三氟甲基化反应(见图3).该反应具有反应条件温和、转化率较高、底物普适性较广等优势.

图3 喹啉5-位选择性氟烷基化Fig.3 5-position-selective fluoroalkylation of quinoline
1 实验部分
1.1 仪器与试剂
8-氨基喹啉、Umemoto试剂(麦克林);Ru(bpy)3Cl2· 6H2O(Adamas),未经任何纯化处理直接使用;试剂盒溶剂纯化参照Purification of Laboratory Chemicals(W.L.F. Armarego, Christina Li Lin Chai, Elsevier Inc. 2009);薄层硅胶板采用GF254(60-F250, 0.2 mm, 青岛海洋化工厂),用UV(波长254 nm)显色;快速柱层析用青岛海洋硅胶60(200~300 mesh ASTM),以乙酸乙酯和石油醚为洗脱剂.
1H NMR和13C NMR采用Bruker Advance-600(1H:600 MHz,13C:150 MHz)核磁共振仪测定,用CDCl3为溶剂;19F NMR采用Bruker Advance-600(19F:565 MHz)测定,以CDCl3为溶剂;高分辨质谱由中南民族大学药学院分析测试中心完成,使用ESI为离子源.
1.2 8-氨基喹啉5位三氟甲基化产物的合成
称取8-氨基喹啉衍生物(0.1 mmol)、Ru(bpy)3Cl2· 6H2O(0.001 mmol, 1%摩尔比)、Umemoto试剂(0.12 mmol, 1.2 equiv.)、硫酸镁(50 mg)于干燥反应管中,加入1 mL溶剂后封口.蓝光LED灯(12 W)照射下室温搅拌24 h.反应结束后,旋蒸浓缩,并通过柱层析分离[V(石油醚)∶V(乙酸乙酯)=20∶1],得三氟甲基化产物.
2 结果与讨论
2.1 反应条件优化
以8-氨基喹啉衍生物1a为模板底物,以Umemoto为三氟甲基化试剂,Ru(bpy)3Cl2· 6H2O(1 mol%)为催化剂,从添加剂、溶剂等角度对反应条件进行筛选,发现向反应体系中加入硫酸镁作为添加剂时可促进三氟甲基化产物的生成,通过对反应溶剂的筛选发现该反应在乙醚中展现出最佳的反应效率.

表1 光氧化还原催化喹啉5-位选择性三氟甲基化反应条件优化Tab.1 Optimization of reaction conditions for visible light-induced C-5 trifluoromethylation of 8-aminoquinoline 1a
注:反应条件:1a(0.1 mmol), Umemoto reagent2(0.12 mmol, 1.2 equiv.), Ru(bpy)3Cl2· 6H2O(0.001 mmol, 1%摩尔比)溶于 1.0 mL溶剂中,室温、空气氛围下经12 W 蓝光-LED照射;*分离产率
2.2 底物普适性考察
在优化后的反应条件下,对该反应的底物普适性进行考察.由表2可见,该反应表现出良好的底物普适性,丙酰基、乙酰基取代底物可分别以67%和38%的收率得到目标产物.对于苯环取代的底物而言,对苯环上所含取代基的电性、位置进行了考察,发现相较于含拉电子基团(如4-硝基)的底物而言,含给电子基团(如4-甲氧基)的底物反应活性更好,产率较高.此外,除对位取代外,苯环的邻位、间位均可允许取代基团的存在,不会对反应产生较大干扰.另一方面,卤素取代基(如溴、氯)在三氟甲基化反应条件下也可得到很好的兼容,未见副产物的生成.
N-(5-(Trifluoromethyl)quinolin-8-yl)propionamide(3a):67%产率,白色固体.1H NMR(600 MHz,Chloroform-d)δ10.01(s,1H),8.88(dd,J=4.2,1.5 Hz,1H),8.81(d,J=8.2 Hz,1H),8.51(dt,J=8.7,1.7 Hz,1H),7.91(d,J=8.2 Hz,1H),7.60(dd,J=8.6,4.2 Hz,1H),2.64(q,J= 7.6 Hz,2H),1.35(t,J=7.6 Hz,3H).13C NMR(150 MHz,Chloroform-d)δ172.87,148.55,138.12,138.04,133.24(q,J=2.2 Hz),126.66(q,J=5.8 Hz),125.17(q,J=272 Hz),124.26,122.80,119.46(q,J=31.0 Hz),114.01,31.31,9.59.19F NMR(565 MHz,Chloroform-d)δ-58.70.HRMS(ESI):m/zcalcd for C13H12F3N2O [M+H]+:269.0902; found:269.0896.

表2 光氧化还原催化喹啉5-位选择性三氟甲基化反应底物普适性考察Tab.2 Substrate scope for visible light-induced C-5 trifluoromethylation of 8-amimoquinoliens
N-(5-(Trifluoromethyl)quinolin-8-yl)acetamide(3b):38%产率,白色固体.1H NMR(600 MHz,Chloroform-d)δ9.99(s,1H),8.89(dd,J=4.2,1.5 Hz,1H),8.79(d,J=8.2 Hz,1H),8.51(dt,J=8.6,1.7 Hz,1H),7.91(d,J=8.2 Hz,1H),7.61(dd,J=8.6,4.2 Hz,1H),2.39(s,3H).13C NMR(150 MHz,Chloroform-d)δ169.13,148.53,137.99,137.94,133.22(q,J=2.2 Hz),126.62(q,J=6.2 Hz),125.11(q,J=272 Hz),124.21,122.80,119.58(q,J=31.0 Hz),114.02,25.23.19F NMR(565 MHz,Chloroform-d)δ-58.72. HRMS(ESI):m/zcalcd for C12H10F3N2O [M+H]+:255.0745; found:255.0739.
N-(5-(Trifluoromethyl)quinolin-8-yl)benzamide(3c):43%产率,白色固体.1H NMR(600 MHz,Chloroform-d)δ10.95(s,1H),8.98(d,J=8.2 Hz,1H),8.95(dd,J=4.1,1.6 Hz,1H),8.55(dt,J=8.7,1.7 Hz,1H),8.08~8.09(m,2H),7.98(d,J=8.2 Hz,1H),7.68~7.61(m,2H),7.61~7.57(m,2H). HRMS(ESI):m/zcalcd for C17H12F3N2O [M+H]+:317.0902; found:317.0895.
4-Methoxy-N-(5-(trifluoromethyl)quinolin-8-yl)benzamide(3d):37%产率,白色固体.1H NMR(600 MHz,Chloroform-d)δ10.88(s,1H),8.96~8.94(m,2H),8.54(dt,J=8.8,1.7 Hz,1H),8.08(d,J=8.5 Hz,2H),7.98(d,J=8.2 Hz,1H),7.64(dd,J=8.6,4.2 Hz,1H),7.07(d,J=8.5 Hz,2H),3.92(s,3H). HRMS(ESI):m/zcalcd for C18H14F3N2O2[M+H]+:347.1007; found:347.1000.
3-Chloro-N-(5-(trifluoromethyl)quinolin-8-yl)benzamide(3e):34%产率,白色固体.1H NMR(600 MHz,Chloroform-d)δ10.89(s,1H),8.96~8.93(m,2H),8.55(dt,J=8.6,1.7 Hz,1H),8.07(t,J=1.9 Hz,1H),7.99~7.95(m,2H),7.65(dd,J=8.6,4.2 Hz,1H),7.59~7.57(m,1H),7.53~7.51(m,1H).
2-Chloro-N-(5-(trifluoromethyl)quinolin-8-yl)benzamide(3f):18%产率,白色固体.1H NMR(600 MHz,Chloroform-d)δ10.72(s,1H),8.98(d,J=8.2 Hz,1H),8.89(dd,J=4.1,1.6 Hz,1H),8.54(d,J=8.6 Hz,1H),7.99(d,J=8.2 Hz,1H),7.84(d,J=7.5 Hz,1H),7.62(dd,J=8.6,4.2 Hz,1H),7.53(m,1H),7.49~7.47(m,1H),7.45~7.43(m,1H).
3-Methyl-N-(5-(trifluoromethyl)quinolin-8-yl)benzamide(3g):24%产率,白色固体.1H NMR(600 MHz,Chloroform-d)δ1H NMR(600 MHz,Chloroform-d)δ10.90(s,1H),8.98~8.95(m,2H),8.54(dt,J=8.7,1.9 Hz,1H),7.89~7.87(m,2H),7.64(dd,J=8.6,4.2 Hz,1H),7.47~7.42(m,2H),2.50(s,3H).
2-Methyl-N-(5-(trifluoromethyl)quinolin-8-yl)benzamide(3h):25%产率,白色固体.1H NMR(600 MHz,Chloroform-d)δ10.42(s,1H),8.98(d,J=8.2 Hz,1H),8.87(dd,J=4.2,1.6 Hz,1H),8.54(dt,J=8.6,1.8 Hz,1H),7.98(d,J=8.2 Hz,1H),7.70(d,J=7.6,1H),7.61(dd,J=8.6,4.1 Hz,1H),7.45~7.42(m,1H),7.36~7.34(m,2H),2.62(s,3H).
4-Bromo-N-(5-(trifluoromethyl)quinolin-8-yl)benzamide(3i):23%产率,白色固体.1H NMR(600 MHz,Chloroform-d)δ10.91(s,1H),8.95~8.94(m,2H),8.56(d,J=8.6 Hz,1H),7.99~7.96(m,3H),7.72(d,J=8.0 Hz,2H),7.66(dd,J= 8.7,4.2 Hz,1H).
4-Nitro-N-(5-(trifluoromethyl)quinolin-8-yl)benzamide(3j):<10%产率,白色固体.1H NMR(600 MHz,Chloroform-d)δ11.02(s,1H),8.97-8.95(m,2H),8.58(d,J=8.7 Hz,1H),8.44(d,J=8.5 Hz,2H),8.26(d,J=8.4 Hz,2H),8.01(d,J=8.2 Hz,1H),7.68(dd,J=8.7,4.2 Hz,1H).
对未用酰基保护的8-氨基喹啉1k而言,在标准反应条件下也可以18%产率生成三氟甲基化产物(见图4).

图4 8-氨基喹啉5-位三氟甲基化Fig.4 C-5 trifluoromethylation of 8-aminoquinoline
5-(trifluoromethyl)quinolin-8-amine(3k):18%产率,棕色固体.1H NMR(600 MHz,Chloroform-d)δ8.81(dd,J=4.1,1.6 Hz,1H),8.42(dt,J=8.5,1.8 Hz,1H),7.70(d,J=8.0 Hz,1H),7.51(dd,J=8.7,4.1 Hz,1H),6.84(d,J=8.0 Hz,1H),5.40(s,2H). HRMS(ESI):m/zcalcd for C10H8F3N2[M+H]+:213.0640; found:213.0638.
2.3 反应机理研究
通过对照实验和自由基抑制实验,对反应机理进行了初步研究.在对照实验中(见表3)发现,在无光催化剂或光照时反应均不能发生.

表3 对照实验Tab.3 Control experiment
注:反应条件:1b(0.1 mmol),Umemoto reagent2(0.12 mmol,1.2 equiv.),Ru(bpy)3Cl2· 6H2O(0.001 mmol,1 mol%) 溶于 1.0 mL乙醚中,室温、空气氛围下经12 W蓝光-LED照射;*分离产率
在自由基抑制实验中发现,向反应体系中加入自由基捕捉剂TEMPO可有效抑制该反应(见图5).

图5 自由基抑制实验Fig.5 Radical inhibition experiment
3 结语
本文以商业可得Umemoto试剂为三氟甲基自由基前体,在可见光和光氧化还原催化剂的共同作用下,实现了对8-氨基喹啉类衍生物的5-位选择性自由基三氟甲基化反应.该反应在室温、空气条件下即可进行,反应条件温和、操作简便,底物普适性较广.
