术前老年人营养风险指数对胰腺导管腺癌预后的预测价值
2019-06-24胡思聘涂梦芸林炜航林承怡周蒙滔
胡思聘,涂梦芸,林炜航,林承怡,周蒙滔
(1.温州医科大学附属第一医院 肝胆外科,浙江 温州 325000;2.温州医科大学附属第二医院 检验科,浙江 温州 325000)
迄今为止,胰腺癌仍被认为是世界上最为致命的恶性肿瘤之一。胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)是胰腺癌最常见的病理组织学类型,大多数患者在确诊后1年内死亡,5年生存率低于6%[1-2]。目前,根治性手术切除仍是PDAC的主要治疗方法,但由于手术难度大,肿瘤的可切除率较低,频繁的局部复发和远处转移,使得其预后和总生存率(overall survival,OS)总是不能令人满意。因此,寻找用于预测PDAC患者预后的最佳临床标志物是非常迫切的。
营养不良是癌症患者常见的并发症,不仅与术后其他并发症有关,而且与长期预后相关[3-6]。根据流行病学观点,营养不良影响超过80%以上的消化道恶性肿瘤患者和至少60%的肺癌患者[7-9]。因此,有必要通过评估癌症患者的营养状况来预测疾病的预后。老年人营养风险指数(geriatric nutritional risk index,GNRI)是一个新的营养状况评估指标,可用于预测老年人群与营养相关的并发症和死亡风险[10-12]。该指数是一种客观简单的营养评估工具,仅由血清白蛋白、身高和体重决定。目前已有文献报道GNRI是心力衰竭、食管鳞状细胞癌、病理性I期非小细胞肺癌和非转移性肾细胞癌患者临床预后方面的独立危险因素[13-16]。关于GNRI与胰腺癌预后之间的关系,Balzano等[17]曾报道GNRI分级是PDAC患者早期死亡的独立预测因子,但GNRI与PDAC患者长期预后之间是否存在着相关性,目前仍然未知。因此,本研究旨在探讨术前GNRI是否可作为胰十二指肠切除术后PDAC患者总体生存率的可靠预测因子。
1 资料和方法
1.1 一般资料
通过伦理审查委员会的审查并得到批准之后,本研究回顾性分析了2006年1月1日至2015年12月31日在温州医科大学附属第一医院进行根治性切除术的265例胰腺导管腺癌患者。纳入标准:(1)组织学证实是PDAC;(2)未接受术前抗癌治疗;(3)无其他恶性肿瘤病史;(4)胰十二指肠切除术后未出现急性严重并发症,如肠梗阻、穿孔和出血;(5)完全切除肿瘤组织,并在手术前获得实验室检查。
1.2 研究方法
本研究收集的人口统计学和临床病理学数据包括:年龄、性别、吸烟史、饮酒史、肿瘤部位、肿瘤大小、肿瘤分级、神经浸润、血管侵犯、邻近组织侵犯、淋巴结转移、第7版AJCC TNM分期、中性粒细胞计数、淋巴细胞计数、单核细胞计数、白蛋白水平、血红蛋白水平、糖类抗原(CA19-9)、癌胚抗原(CEA)、肿瘤是否复发、是否早期死亡等。老年人营养风险指数(GNRI)计算公式:GNRI=[1.489×白蛋白(g/L)+41.7×实际体重/理想体重]。理想体重根据Lorenz方程计算,男性:身高-100-[(身高-150)/4];女性:身高-100-[(身高-150)/2.5]。当患者的实际体重超过理想体重时,实际体重/理想体重设定为1。根据GNRI值将患者分为两组:正常GNRI组(n=170),GNRI>98被认为是正常的;异常GNRI组(n=95),GNRI≤98的患者则有营养不良的风险。
1.3 随访
所有患者术后均进行标准化随访。随访检查内容包括腹部超声、胸片、血常规、血生化(肝功能、肾功能)、肿瘤标志物,如果发现可疑占位且不能明确占位性质,可根据情况行增强CT、MRI、PET等检查。术后2年内每3个月复查一次,此后每3~6个月复查一次。如果患者不能来院复查,则通过电话等随访方式进行随访。
1.4 统计学分析
2 结果
2.1 术前GNRI与患者基线特征之间的关系
与正常GNRI组相比,异常GNRI组中肿瘤位于胰头位置较多,CEA水平、CA19-9水平较高,白蛋白水平、血红蛋白水平较低,术后更容易出现早期死亡和肿瘤更易复发,差异具有统计学意义(P<0.05)。而在年龄、性别、吸烟状况、饮酒状况、肿瘤大小、肿瘤分级、神经浸润、血管侵犯、邻近组织侵犯、淋巴结转移、TNM分期等方面两组无统计学差异(P>0.05)。见表1。
2.2 PDAC患者预后相关因素
Kaplan-Meier分析显示,生存曲线按术前GNRI分类显著分层(见图1)。正常GNRI组的中位生存时间是异常GNRI组(25.7个月vs10.8个月)的2.5倍,1年、3年、5年生存率分别为69.2%、43.0%、27.2%和44.2%、20.0%、8.59%,两组差异具有统计学意义(P<0.05)。多因素Cox回归分析显示年龄、饮酒史、肿瘤分级、TNM分期、CA19-9水平和GNRI是影响PDAC患者总体生存率的独立危险因素。与正常GNRI组相比,异常GNRI组的死亡风险增加了53.8%(HR=1.538,95%CI1.115~2.121) (见表2)。
TNM分期系统被广泛应用于预测肿瘤患者的预后,因此,基于不同的TNM分期,我们进一步对GNRI进行亚组分析。结果显示无论是在I/II期还是在III期的PDAC患者中,正常GNRI组都有着更好的预后(见图2、图3)。
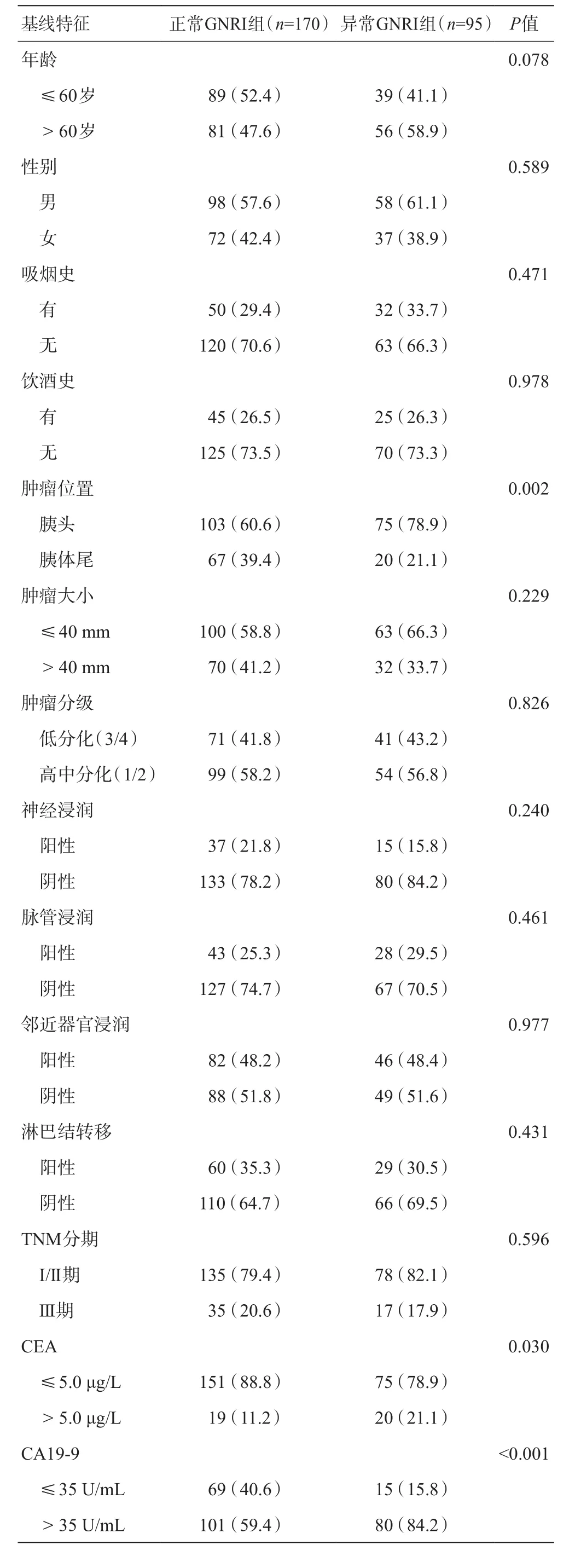
表1 两组患者基线资料比较[例(%)]
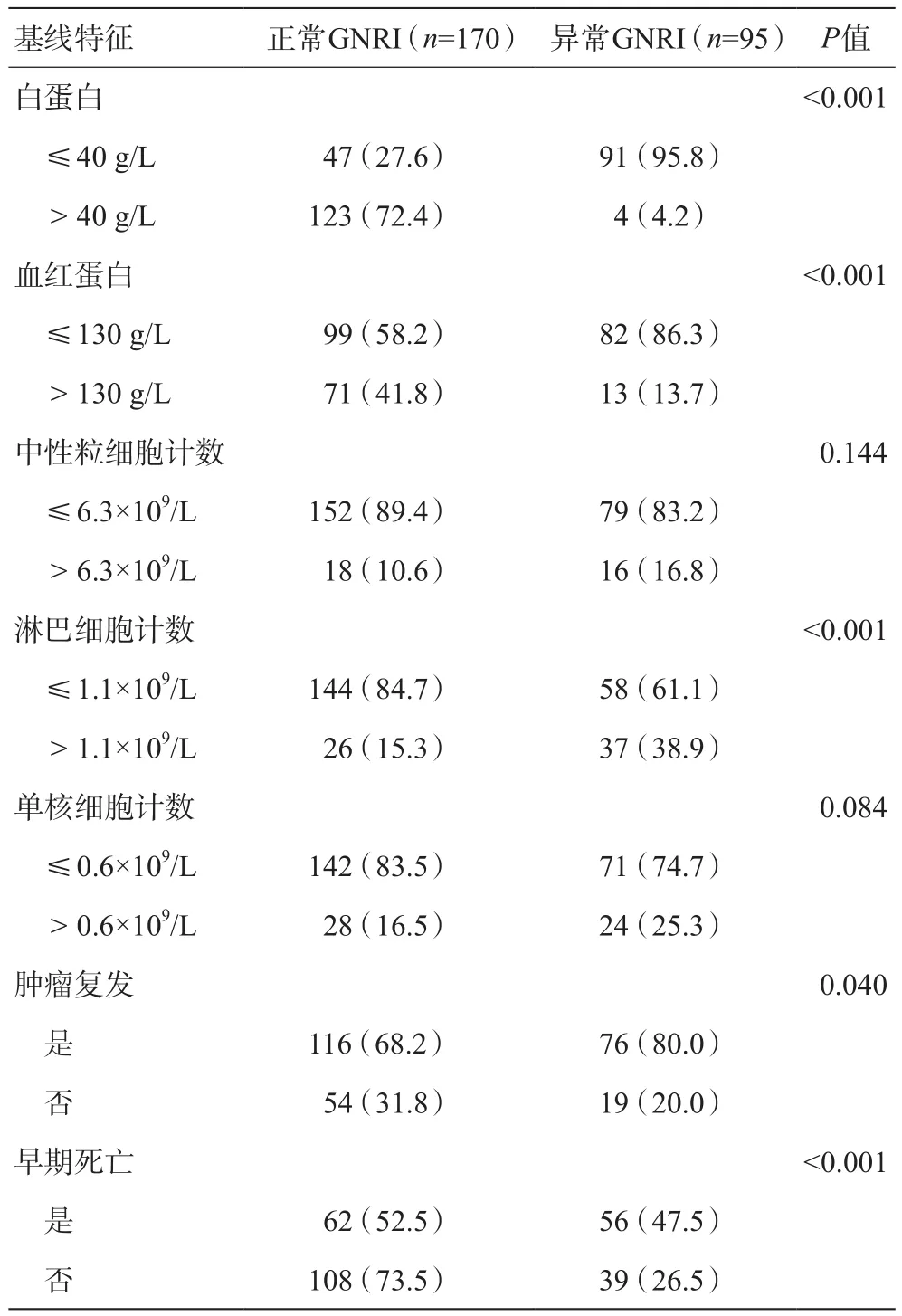
续表1
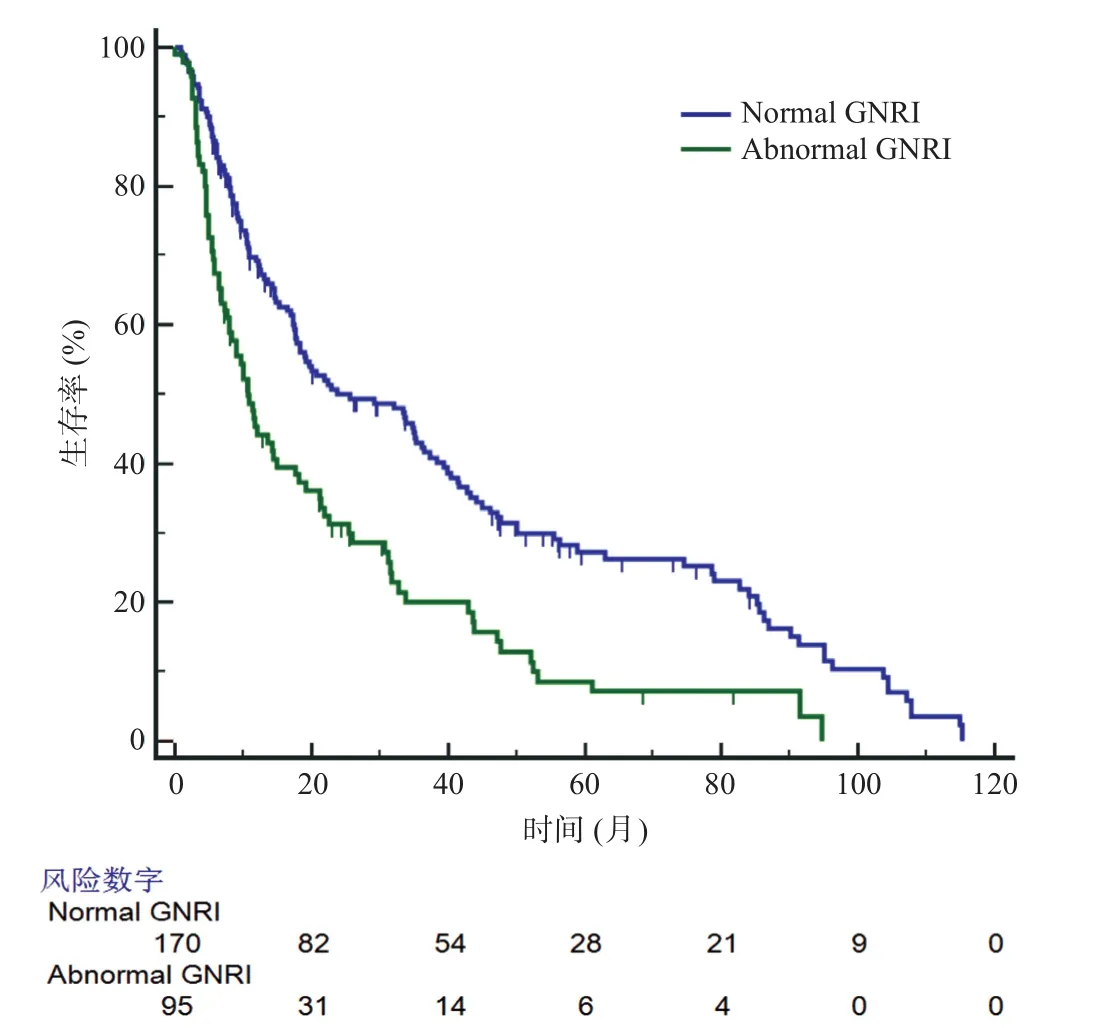
图1 两组PDAC患者生存曲线比较
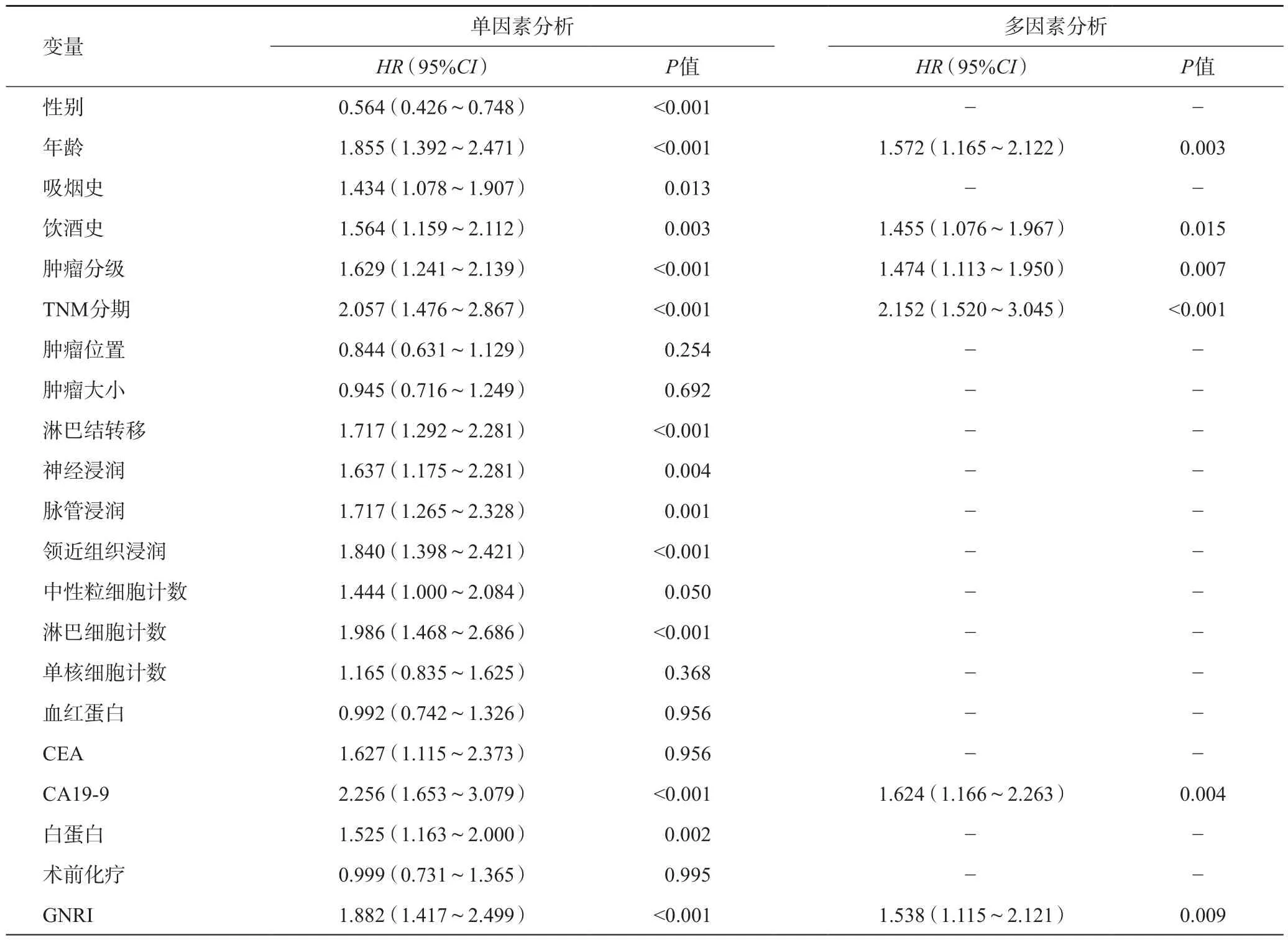
表2 影响PDAC患者总体生存率的单因素和多因素分析
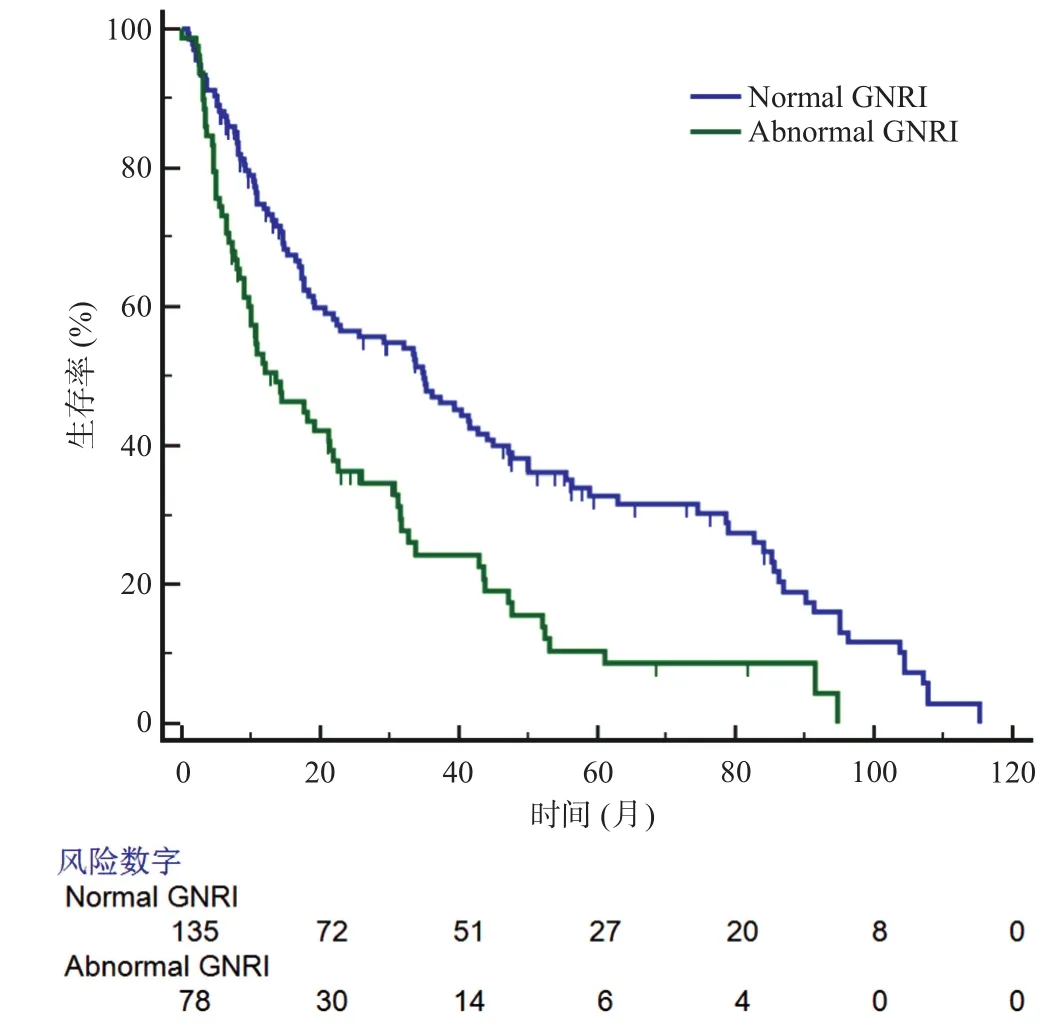
图2 TNM分期为I/II期时两组PDAC患者生存曲线
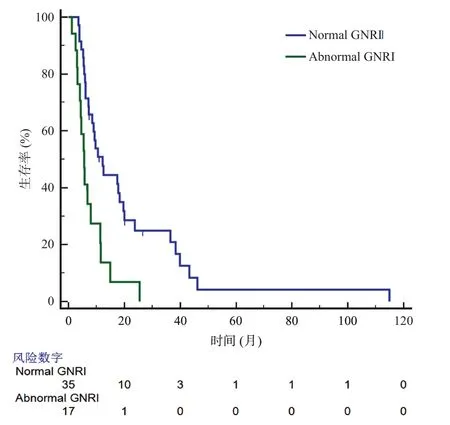
图3 TNM分期为III期时两组PDAC患者生存曲线
3 讨论
胰腺癌是一种恶性程度高、预后极差的恶性肿瘤肿瘤,其起病隐匿、进展快、早期诊断率低、手术切除率低,并对放化疗不敏感,是严重危害人类健康的恶性肿瘤之一。目前相关研究已经发现年龄、肿瘤分化类型、TNM分期、淋巴结是否转移、血管是否侵犯等与胰腺癌患者预后不良密切相关。本研究发现年龄、饮酒史、肿瘤分级、TNM分期、CA19-9水平是影响患者预后的独立危险因素,这与先前的多数研究一致。同时,我们也发现PDAC患者的术前GNRI水平对患者的总体生存率可能起到重要的评估作用。Kaplan-Meier生存分析结果显示,异常GNRI组较正常GNRI组患者的术后中位生存时间短(10.8个月vs25.7个月),远期生存率也明显更低;Cox回归分析同样也证实异常GNRI是PDAC患者术后预后不良的独立危险因素(HR1.538,P=0.009)。另外,通过对术前GNRI与临床病理特征的相关关系研究中,我们发现异常GNRI组的术后早期死亡率及肿瘤复发率更高,而早期死亡及肿瘤复发又是影响患者总体生存率的重要影响因素,这也提示术前GNRI与PDAC患者术后的总体生存率存在着相关性,对预测疾病的预后具有一定的参考价值。
胰腺癌患者往往伴有营养不良症状,这是由于肿瘤导致的胃肠道阻塞、胆道梗阻、伴发性胰腺炎和癌性疼痛引起的口服摄入减少和消耗增加[18-20]。而营养状况不佳又与临床结局不佳及生存率低有关,Gao等[21]曾报道,营养状况恶化可抑制机体的肿瘤免疫力,进而导致术后并发症的增加和肿瘤扩散。因此,早期识别营养高危状态对于改善癌症患者预后是至关重要的。尽管目前已经开发了多种营养筛查工具来评估患者的营养状况,例如SGA、NRS和NRI等,但这些筛查工具主要基于患者的主观记忆,容易产生较大的偏差;此外,关于评判患者营养相关风险的标准,目前国际上仍然没有达成共识。GNRI基于三个重要的营养指标,包括血清白蛋白水平,体重和身高。血清白蛋白是最常见的用来评价营养不良指标之一,Hendifar等[22]最近发现,术前低血清白蛋白水平与胰腺癌患者的无瘤生存期和总体生存期相关。Gupta等[23]也报道高血清白蛋白浓度与癌症患者更好的生存率相关。身高和体重也经常被用于评价个体的营养状况,Umegaki等[24]曾指出,低体重指数与胰腺癌死亡风险增加有关,Okura等[25]提出,极低的BMI与胰腺切除术后患者死亡风险显着相关。基于这些因素,我们认为术前GNRI用于评估PDAC患者的预后及营养相关的风险是可靠的,并且已被国内外相关研究证明与多种疾病老年患者的死亡率相关,而且具有广泛性[12,16,26-32]。总之,本研究表明,GNRI可能是一种简单有效的工具,可用于预测胰十二指肠切除术后PDAC患者的总生存期,并有助于鉴定需要营养支持治疗的PDAC患者。
本研究有一定的局限性:首先,本研究是来自单一机构的回顾性研究,样本量相对较小,进一步研究需要多中心前瞻性研究和更大样本临床分析;其次,本研究仅包括接受胰十二指肠切除术的PDAC患者,结果可能并不代表接受其他治疗方法的PDAC患者,如姑息治疗和靶向治疗等。
