腹腔镜辅助胰十二指肠切除术的近期疗效观察
2019-06-24柴伟雷豹孟宇赵秀雷张雷孔德帅刘汝海
柴伟,雷豹,孟宇,赵秀雷,张雷,孔德帅,刘汝海
(沧州市中心医院 普通外一科,河北 沧州 061000)
复杂的消化道重建是全腹腔镜胰十二指肠切除术(total laparoscopic pancreaticoduodenectomy,TLPD)的最大难点之一。为了简化手术操作、降低手术风险,部分学者选择腹腔镜辅助胰十二指肠切除术(laparoscopic assisted pancreaticoduodenectomy,LAPD)作为实施TLPD之前的过渡。本研究回顾性分析2015年10月至2017年12月沧州市中心医院普外科施行的102例LAPD和179例开腹胰十二指肠切除术(open pancreaticoduodenectomy,OPD)患者的临床资料,比较两组病例近期疗效,探讨LAPD的手术安全性及可行性,现报道如下。
1 资料和方法
1.1 一般资料
本组施行LAPD102例患者中,女59例,男43例;年龄29~75岁,平均(58.1±10.3)岁;同期施行OPD的179例患者中,女106例,男73例;年龄22~78岁,平均(56.7±17.9)岁。两组患者的性别、年龄、ASA分级、术前血清总胆红素、谷丙转氨酶及白蛋白水平比较,差异均无统计学意义(P>0.05),具有可比性。详见表1。两组患者由同组医师完成手术。
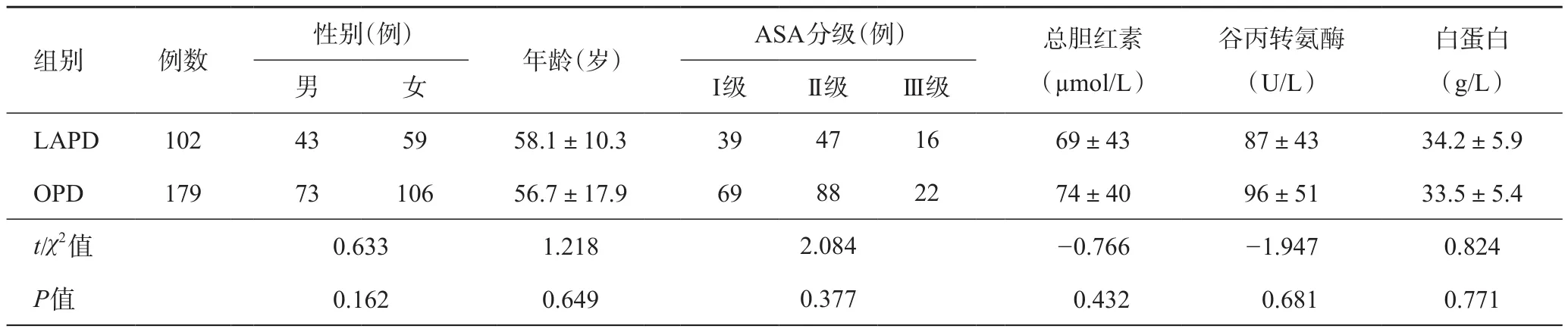
表1 两组术前一般情况比较
1.2 纳入、排除标准
纳入标准:(1)患者因原发疾病需行胰十二指肠切除手术,无手术及麻醉禁忌证;(2)既往无其他肿瘤病史及消化道重建病史;(3)肿瘤局部侵润在可根治范围内且无远处转移。(4)病例资料完整。
排除标准:(1)伴有严重的心、肺、肾、脑等重要脏器基础疾病;(2)原发病灶未完全切除;(3)合并其他脏器肿瘤。
1.3 手术方法
LAPD组在腹腔镜下完成手术(图1)。患者平卧分腿位,术者站于患者右侧,助手位于左侧,扶镜手位于患者两腿之间。采用5孔法,Trocar布局类似腹腔镜胃癌手术[1]。探查腹腔,排除肿瘤转移情况后根据肿瘤的特点选择相应的手术入路。(1)对于绝大部分无血管侵犯的壶腹部周围恶性肿瘤及胰头良性肿瘤采用经典的Kocher切口入路[2]。(2)对于胰头向胰腺背侧生长的肿瘤、胰头下缘肿瘤、钩突部的肿瘤以及肠系膜上动脉(superior mesenteric artery,SMA)的后方和根部可疑受侵犯的肿瘤采用右后下动脉优先入路:该入路沿十二指肠下曲后方游离进入胰头后间隙,依次显露下腔静脉、左肾静脉、SMA及腹腔干根部,探查肿瘤与血管关系的同时完成周围淋巴结清扫[3]。(3)对于部分胰头、颈部上方的肿瘤采用胰颈上方动脉入路:首先在胰颈部上缘切开后腹膜,显露肝总动脉、脾动脉起始部及腹腔干,沿肝总动脉向右向上分离显露肝固有动脉、胃十二指肠动脉,进而清扫肝门区淋巴结。向下牵拉胰腺,沿腹主动脉在腹腔干下方向足侧分离,显露SMA根部,探查腹腔干及肠系膜上动脉的侵犯情况,明确肿瘤的可切除性。肿块切除后,取上腹正中6~10 cm小切口取出标本并辅助完成消化道重建。按照Child顺序进行消化道重建,胰肠吻合采用荷包套入式胰肠端侧吻合[4-5]。距离胰肠吻合口约10 cm处行肝总管断端与空肠对系膜缘端侧吻合,距离胆肠吻合口远端约45 cm处行结肠前胃空肠侧侧吻合。胰肠及胆肠吻合口后方各放置硅胶引流管1根。
OPD组为经典的胰十二指肠切除术,消化道重建方式与LAPD组相同。

图1 腹腔镜辅助胰十二指肠切除术
1.4 观察指标
(1)手术情况:手术时间、术中出血量、手术切口总长度、淋巴结清扫数目、R0切除率。(2)术后情况:术后入住ICU时间、进食流食时间、术后住院天数、术后并发生发生率及术后6个月无瘤生存率。
1.5 随访
采用门诊及电话随访相结合的方式进行随访,门诊随访包括:术后每3个月返院复查肝功能、肿瘤标记物、腹部彩色多普勒超声,每6个月复查腹部增强CT。电话随访,了解患者是否有腹泻等胰腺外分泌功能异常的表现。统计两组病例术后6个月无瘤生存率,随访时间截止2018年6月。
1.6 统计学分析
应用SPSS19.0统计学软件进行分析。正态分布计量资料以(±s)表示,组间比较采用t检验,计数资料组间比较采用χ2检验。P<0.05为差异具有统计学意义。
2 结果
2.1 两组术中、术后情况比较
两组患者均顺利完成既定术式。两组手术时间、术中出血量、手术切口长度、术后进流食时间、术后ICU入住时间、术后住院时间比较,差异均具有统计学意义(P<0.05);淋巴结清扫数目、R0切除率比较,差异均无统计学意义(P>0.05)。详见表2~3。
LAPD组29例出现术后并发症,其中包括胰瘘16例(A级胰瘘11例,B、C级胰瘘5例),A、B级胰瘘患者给予营养支持、延长引流管留置时间、穿刺引流等综合治疗痊愈,C级胰瘘2例,其中1例通过再次手术治愈,另外1例死于胰瘘导致的感染性休克及多脏器功能衰竭;胆瘘4例,保守治疗痊愈;胃排空障碍5例,给予持续胃肠减压、静脉营养治愈;消化道出血1例,再次手术后出现多脏器功能衰竭死亡;切口感染3例,切口换药治愈。Clavien-Dindo系统分级I级13.73%(14/102)、II级10.78%(11/102)、III级0.98%(1/102)、IV级0.98%(1/102)、V级1.96%(2/102)。
OPD组56例出现术后并发症,胰瘘25例(A级18例,B、C级7例),A、B级给予营养支持、延长引流管留置时间、穿刺引流等综合治疗,C级胰瘘3例,其中1例通过彩超引导下多点穿刺引流治愈、1例通过再次手术治愈、1例因胰瘘导致的腹腔出血及严重感染死亡;胆瘘6例,保守治疗痊愈;胃排空障碍9例,给予持续胃肠减压、静脉营养治愈;消化道出血1例,保守治疗痊愈;腹腔出血1例,行DSA检查发现胃左动脉分支出血,行出血动脉栓塞治愈;切口感染12例,切口换药治愈;术后急性肺动脉栓塞死亡1例、脑干梗塞死亡1例。Clavien-Dindo系统分级I级16.20%(29/179)、II级10.61%(19/179)、III级2.23%(4/179)、IV级0.56%(1/179)、V级1.68%(3/179)。两组术后总体并发症发生率比较,差异无统计学意义(P>0.05)。
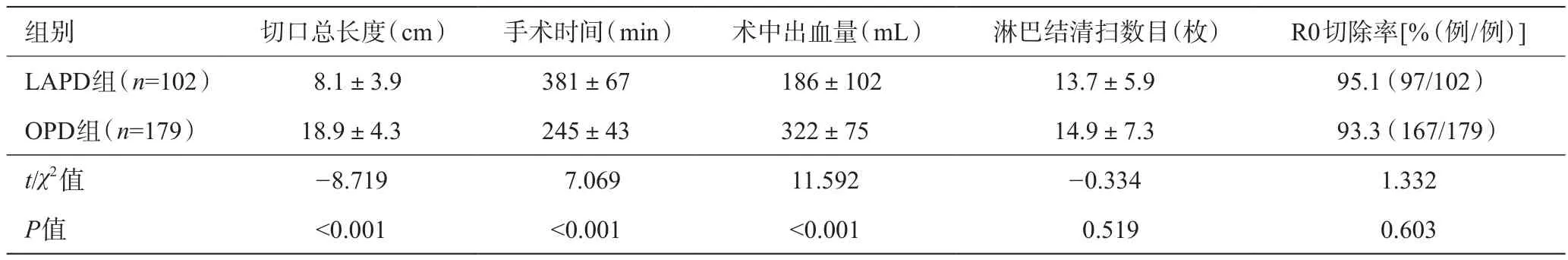
表2 两组术中情况比较

表3 两组术后情况比较
2.2 两组随访情况比较
LAPD组83例获得随访,随访时间为(11.7±4.3)个月,OPD组135例获得随访,随访时间为(13.4±5.9)个月。两组术后6个月无瘤生存率分别为86.7%(72/83)和84.4%(114/135),两组比较差异无统计学意义(χ2=0.814,P>0.05)。
3 讨论
近年来,TLPD手术在国内外部分胰腺外科中心已经成为常规手术[6-7]。但TLPD手术的学习曲线长,尤其是完成全腔镜下消化道重建对术者及团队配合要求极高,需要较长时间的练习及经验积累。故而笔者团队认为,作为OPD与TLPD之间的良好过渡,LAPD不仅有利于手术团队快速度过学习曲线,同时也能增加手术的安全性。
3.1 手术入路选择
笔者团队认为:根据肿瘤本身的特点选择个体化的手术入路是手术成功的关键因素。经典的Kocher切口入路适用范围广,是各种其它手术入路的基础,熟练掌握该入路可使术者学习其他手术入路变得更加容易。胰颈上方动脉入路可以早期探查肿瘤对肝总动脉及腹腔干的侵犯情况,有利于提高胰头、颈部上方肿瘤的R0切除率[8]。右后下动脉优先入路相对传统入路具有诸多优势,包括:(1)早期完成SMA及腹腔干的探查,以动脉作为肿瘤可切除性的评价更为合理;(2)可以对以腹腔干及SMA为轴线的右侧神经及脂肪淋巴组织进行完整性彻底切除,提高R0切除率、降低术后局部复发率、延长术后生存期[9];(3)有利于胰头、钩突与SMV之间的分离,同时可以减少钩突切除过程中的出血量;(4)更加符合肿瘤切除过程中的“无接触”原则,减少肿瘤的医源性播散。
3.2 术前减黄
对于术前合并梗阻性黄疸的病例,是否行术前减黄也是争论的焦点之一。但目前多项研究表明,术前减黄利大于弊。杨晓军等[10]研究表明,对于合并梗阻性黄疸的恶性肿瘤患者,术前减黄组比未减黄组行胰十二指肠切除手术时间更短,且术中出血量更少,术后平均住院时间更短。笔者团队的经验为:术前血清胆红素>342 μmol/L、合并胆道感染、肌酐清除率降低伴尿素氮明显升高、黄疸持续超过8周者均需行术前PTCD减黄。
3.3 LAPD技术要点
笔者团队认为,LAPD的技术要点主要包括:主要血管游离过程中大出血的预防与控制、钩突的离断及胰肠吻合方式的选择。
3.3.1 大出血的预防与控制:LAPD术中难以控制的出血包括动脉及静脉两种,动脉出血多为胃十二指肠动脉残端出血及异位右肝动脉损伤出血。动脉出血的预防相对简单,笔者团队在离断胃十二指肠动脉之前将其近端游离出大于1 cm的距离从而使得离断动脉时有充分的操作空间,动脉近心端先用丝线结扎后再用Hem-o-lok夹闭,且最好夹在线结残端,这样可以有效降低夹子脱落的风险。避免异位右肝动脉损伤出血最好的方法就是术前完善影像学检查,术者将变异动脉的位置、走形牢记于心。而静脉主要是胃结肠静脉干及以肠系膜上静脉-门静脉为轴线的出血。预防胃结肠静脉干出血的方法包括:在分离胃-结肠融合筋膜时助手牵拉结肠力度适中,避免撕裂胃结肠静脉干的结肠支而导致出血。其次,在分离胃-结肠融合筋膜过程优先离断结肠支,同时在游离十二指肠之前将结肠肝曲充分下降以达到充分暴露视野、减少张力的目的。肠系膜上静脉-门静脉为轴线的静脉出血多发生于第一支空肠静脉,正常情况下该静脉开口于SMV的左后壁,而在行钩突切除时往往需要将钩突拉向右侧而造成该静脉顺时针移位,如果对这一解剖特点不熟悉则极易造成该血管损伤。损伤的血管一旦回缩到SMV的背侧则极难处理,最终被迫中转开腹。其预防措施包括熟悉该血管解剖,该血管往往有一支钩突的汇流支,术中仔细寻找并于其汇入第一支空肠静脉前离断,避免撕裂出血。
3.3.2 胰腺钩突离断:(1)对于非胰腺及钩突肿瘤可选择常规静脉优先,即首先离断钩突的静脉汇流支,找到SMA,沿SMA右侧血管鞘外进行钩突离断。(2)胰头、钩突肿瘤或肿瘤侵犯SMA动脉鞘时选择动脉优先入路离断钩突,此法可优先离断钩突血供,且可以保证胰腺全系膜切除,提高R0切除率。
3.3.3 胰肠吻合方式的选择:是胰十二指肠切除术中的重要环节,同时也是手术质量的集中体现。胰腺质地及胰管直径都是影响术后胰瘘发生率的重要因素,故而为了适合不同的胰腺特征、降低术后胰瘘发生率,笔者团队将胰肠吻合方式加以改良,创新采用了荷包套入式胰肠端侧吻合法。该法可显著缩短胰肠吻合时间、降低术后胰瘘发生率[4]。本研究中两组采用该吻合方式,术后胰瘘发生率均较低,分别为15.7%(16/102)及13.9%(25/179),且绝大部分为A级瘘,进一步验证了该吻合方式的优势。
本研究失访率偏高对研究结果有一定影响,主要原因在于以下几点:(1)患者群以基层农民为主、文化程度相对较低、对疾病重视程度不足等因素大大降低了患者的依从性;(2)对疾病的预后持消极态度:该类患者往往认为恶性肿瘤难以治愈,系统性治疗及规律复查意义不大;(3)患者高龄、行动不便或因原发疾病以外的其他原因死亡;(4)就诊距离、交通等客观因素。另外本研究仅仅比较了小样本病例的短期疗效,无法对长期预后进行对比分析。故本研究的结果仍需大宗病例的随机对照临床试验进一步验证。
