双氢青蒿素通过调控细胞自噬性死亡增强宫颈癌细胞的化疗敏感性①
2019-06-24姜广利马静静何胜悦
姜广利 马静静 何胜悦
(新乡市中心医院产科,新乡 453000)
近年来,随着癌症筛选、预防、诊断及治疗水平的提高,宫颈癌患者的生活质量得到了较大的改善,但宫颈癌仍是导致女性癌症死亡的首要原因,预计每年宫颈癌发病率占癌症发病率的3.7%,致死率占3.2%,严重威胁着女性健康[1]。化疗是宫颈癌系统治疗的常用方法,可增加早期宫颈癌的治愈率,改善宫颈癌患者的预后和降低宫颈癌复发率,但并不是所有患者都可从中获益[2,3]。研究发现,癌症化疗抵抗性的形成是导致化疗疗效下降的主要原因,但是具体的形成机制还不完全清楚[4]。但有研究表明,自噬可帮助癌细胞对抗化疗药物的毒性,促进癌细胞化疗抵抗的形成[5]。化疗药物长期应用可诱导癌细胞自噬[6]。因此,抑制癌症发展过程中的自噬可能有利于增强化疗药物的抗癌作用。双氢青蒿素(Dihydroartemisinin,DHA)是青蒿素的活性代谢产物,是治疗疟疾的重要药物。大量研究表明,DHA对乳腺癌、卵巢癌、结肠癌及宫颈癌等多种癌细胞具有细胞毒性,能通过调控癌细胞自噬诱导癌细胞凋亡及抑制癌细胞增殖[7],也可通过调控自噬增强癌细胞的化疗敏感性[8]。但DHA对宫颈癌化疗抵抗的作用还未见报道。因此,本文将探究DHA对宫颈癌HeLa细胞化疗抵抗性的作用,以期为增强化疗药物的抗癌作用提供新的潜力药物。
1 材料与方法
1.1材料
1.1.1主要试剂 DHA购自重庆华丽武陵山制药厂,生产批号为20140703-1,顺铂注射液购自齐鲁制药,生产批号为01201928B。CCK8试剂盒、BCA试剂盒及RIPA裂解液购自北京索莱宝生物科技公司。Annexin V-FITC试剂盒购自美国BD公司,DMEM细胞培养液、胎牛血清和胰酶均购自美国Gibco公司。Ki67、Cleaved Caspase-3、LC3、Beclin1一抗购自美国CST公司,P62、雷帕霉素靶蛋白(Mammalian target of rapamycin,mTOR)、p-mTOR、p-Ulk1、Ulk1和实验所用二抗均购自英国Abcam公司。
1.1.2细胞 人宫颈癌细胞系HeLa细胞购自中国科学院上海细胞库。
1.2方法
1.2.1细胞培养 用含有10%胎牛血清的DMEM培养液将细胞培养于细胞恒温培养箱中,培养环境为37℃、5%CO2和98%以上湿度。隔天换液,细胞密度达到85%以上时进行传代。
1.2.2细胞分组 预实验部分将细胞分为Control组、DHA(5 μmol/L)组、DHA(10 μmol/L)组和DHA(20 μmol/L)组或Cisplatin组、DHA(5 μmol/L)+ Cisplatin组、DHA(10 μmol/L)+ Cisplatin组和DHA(20 μmol/L)+ Cisplatin组,前者分别用0、5、 10、 20 μmol/L 的DHA处理细胞0、1、2、3和4 d后进行检测;后者用顺铂或顺铂联合不同浓度DHA处理细胞48 h,检测细胞活性。正式实验部分将细胞分为Control、DHA(20 μmol/L)、Cisplatin(10 μg/ml)和DHA+Cisplatin组,分别用等量溶媒、DHA、顺铂和DHA联合顺铂处理细胞,24 h后进行相应检测。
1.2.3CCK8检测细胞活性 将细胞接种于96孔板内,用不同浓度DHA或顺铂处理后,每孔加入10 μl 的CCK8试剂,于培养箱中孵育2 h后,用酶标仪于450 nm处检测各组细胞吸光度。
1.2.4流式细胞术检测细胞凋亡 用胰酶收集DHA和顺铂处理后的细胞,并将细胞密度调整为1×106个/ml。随后将细胞以1 000 r/min的转速离心5 min,加入195 μl结合缓冲液和5 μl 的Annexin V-FITC,避光孵育10 min后,加入5 μl的PI溶液,室温避光孵育15 min后,加入400 μl结合缓冲液并在1 h内上机检测。
1.2.5免疫印迹检测蛋白表达 用RIPA裂解液提取各组细胞蛋白,用BCA试剂盒测定蛋白浓度并调平。每组分别取30 μg蛋白用10%SDS-PAGE分离各组蛋白,转移蛋白到PVDF膜。用5%的脱脂牛奶室温封闭蛋白2 h,随后加入一抗(Ki67,1∶1 000;Cleaved Caspase-3,1∶1 200;Beclin1,1∶1 000;LC3,1∶1 000;P62,1∶1 100;mTOR,1∶1 200;p-mTOR,1∶900;Ulk1,1∶1 000;p-Ulk1,1∶1 000),4℃过夜。第二天用缓冲液洗去未结合一抗,加入二抗室温2 h并洗去未结合二抗后,滴加化学发光显色液于凝胶成像系统曝光显影。用软件Image J对蛋白质条带灰度值进行半定量分析。
1.2.6免疫荧光检测LC3表达 将细胞用DHA和顺铂处理后,用磷酸盐缓冲液洗净细胞,加入4%多聚甲醛室温固定30 min。洗去残留多聚甲醛,滴加0.5%的TritonX-100对细胞膜进行透膜处理。加入10%的封闭用正常山羊血清室温孵育细胞2 h,随后滴加LC3(1∶200)一抗,于4℃孵育过夜。第二天弃去一抗,滴加荧光二抗,室温孵育1 h后洗去未结合二抗,加入DAPI即用液室温染色10 min后,于荧光显微镜下观察LC3表达情况。
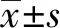
2 结果
2.1DHA对HeLa细胞生长的影响 如图1所示,当DHA浓度达到50 μmol/L及以上时,细胞活性降至80%以下,因此选择5、10、20 μmol/L浓度进行后续实验。不同浓度的DHA处理细胞4 d后,DHA(5、10、20 μmol/L)组HeLa细胞增殖速度显著降低(P<0.01,P<0.001),与Control组比较差异有统计学意义(图2),并具有量效关系,表明DHA能抑制宫颈癌HeLa细胞增殖。
2.2DHA对顺铂抑制细胞增殖作用的影响 与Cisplatin组比较,DHA(10 μmol/L)+ Cisplatin组和DHA(20 μmol/L)+ Cisplatin组细胞存活率显著降低(P<0.01,图3),差异有统计学意义,并以DHA 浓度为20 μmol/L时作用最强,因此选择20 μmol/L进行后续实验。免疫印迹实验结果表明,与Control组比较,Cisplatin组和DHA(20 μmol/L)组细胞Ki67表达水平明显降低(P<0.01,图4),DHA+Cisplatin组细胞Ki67表达水平与Cisplatin组比较明显降低(P<0.01,图4),表明DHA可增强顺铂对宫颈癌HeLa细胞增殖的抑制作用。

图1 DHA对HeLa细胞活性的影响Fig.1 Effect of DHA on cell viability of HeLa cells

图2 DHA对HeLa细胞增殖的影响Fig.2 Effect of DHA on HeLa cellsNote:The cell viability was determined by CCK8 assay.n=6,**.P<0.01,***.P<0.001 versus control group.
2.3DHA对顺铂促细胞凋亡作用的影响 流式实验结果表明,与Control组比较,DHA(20 μmol/L)组和Cisplatin组细胞凋亡率明显升高(P<0.01,图5);与Cisplatin组比较,DHA+Cisplatin组细胞凋亡率显著升高(P<0.01,图5),差异有统计学意义;此外,DHA(20 μmol/L)组和Cisplatin组细胞凋亡相关蛋白Cleaved Caspase-3(32 kD)的表达水平与Control组比较明显升高(P<0.01,图4),DHA+Cisplatin组Cleaved Caspase-3的表达水平明显高于Cisplatin组(P<0.01,图4),表明DHA能增强顺铂对HeLa细胞凋亡的促进作用。
2.4DHA对顺铂诱导自噬的影响 与Control组比较,DHA(20 μmol/L)组细胞自噬相关蛋白Beclin1表达水平和LC3Ⅱ/LC3Ⅰ明显降低,P62表达水平明显升高(P<0.01,图6); Cisplatin组Beclin1表达水平和LC3Ⅱ/LC3Ⅰ与Control组比较明显升高,P62表达水平明显降低(P<0.05,P<0.01,图6),表明DHA能抑制HeLa细胞自噬,顺铂可诱导细胞自噬。与Cisplatin组比较,DHA+Cisplatin组Beclin1表达水平和LC3Ⅱ/LC3Ⅰ明显降低,P62表达水平明显升高(P<0.01,P<0.001,图6),表明DHA能抑制顺铂诱导的HeLa细胞自噬。此外,DHA能显著降低LC3在HeLa细胞中的表达率(P<0.01,图7),顺铂能升高LC3在HeLa细胞中的表达率(P<0.01,图7);DHA还能减弱顺铂对LC3表达的促进作用(P<0.01,图7),进一步表明DHA能抑制顺铂诱导的宫颈癌HeLa细胞自噬。
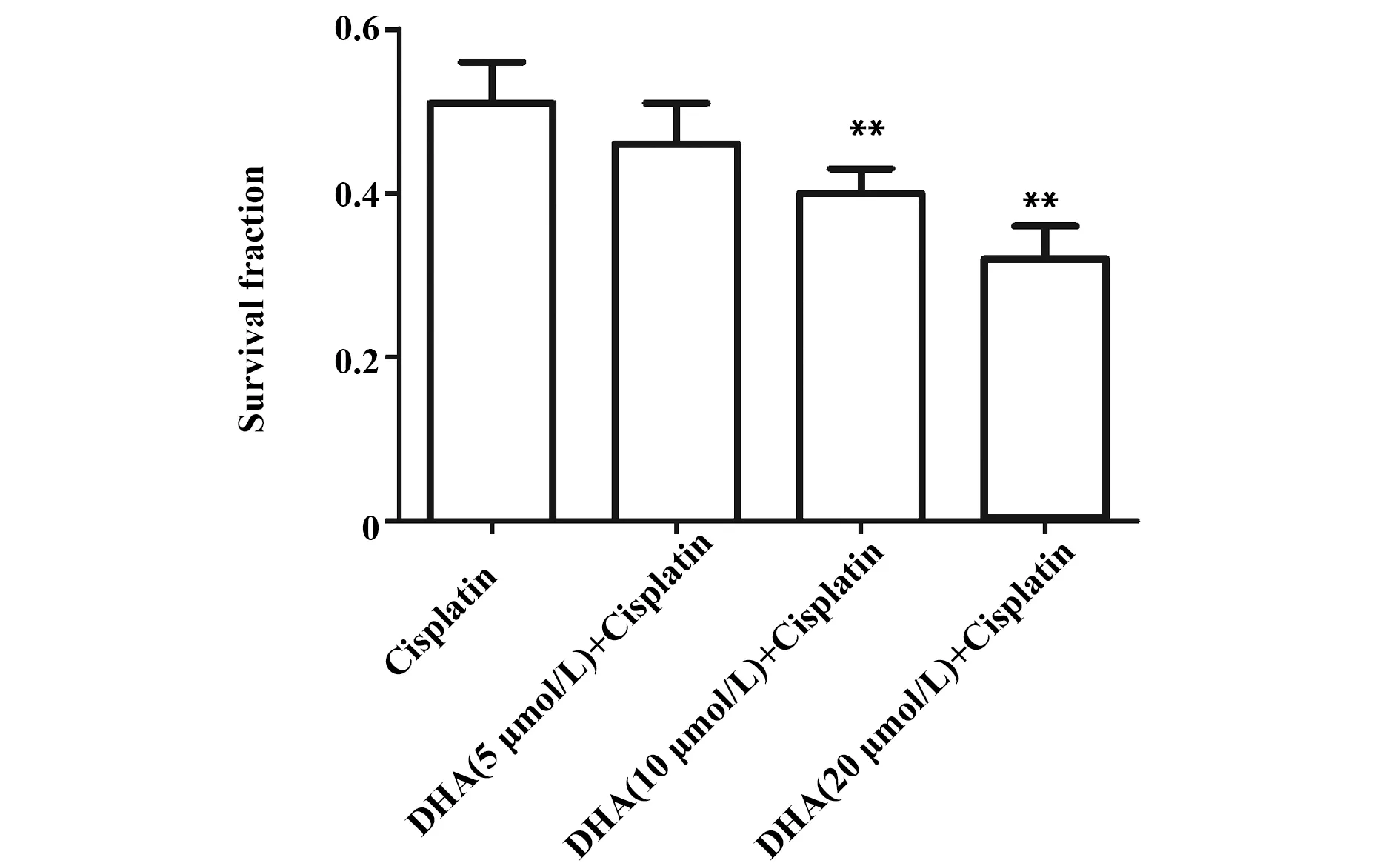
图3 DHA对顺铂抑制HeLa细胞增殖作用的影响Fig.3 Effect of DHA on inhibitory effect of cisplatin on proliferation of HeLa cellNote:Cell viability was measured by CCK8 assay.n=6,**.P<0.01 versus cisplatin group.

图4 DHA 对顺铂调控Ki67和Cleaved Caspase-3表达的作用Fig.4 Effect of DHA on regulatory effects of cisplatin on expressions of Ki67 and Cleaved Caspase-3Note:Protein levels of Ki67 and Cleaved Caspase-3 was determined by Western blot.GAPDH was used as control.n=6,**.P<0.01 versus control group;##.P<0.01 versus cisplatin group.

图5 DHA对顺铂诱导HeLa细胞凋亡作用的影响Fig.5 Effect of DHA on inductive effect of cisplatin on cell apoptosis of HeLa cellNote:Cell apoptosis was determined by flow cytometry.n=6,**.P<0.01 versus control group;##.P<0.01 versus cisplatin group.

图6 DHA对顺铂诱导HeLa细胞自噬的影响Fig.6 Effect of DHA on cisplatin-induced autophagy of HeLa cellNote:The protein levels was measured by Western blot.n=6,*.P<0.05,**.P<0.01 versus control group;##.P<0.01,###.P<0.001 versus cisplatin group.
2.5DHA对顺铂抑制mTOR/Ulk1信号通路激活作用的影响 实验结果表明,与Control组比较,DHA组mTOR磷酸化和Ulk1磷酸化水平升高,p-mTOR/mTOR和p-Ulk1/Ulk1显著升高(P<0.01,图8),差异具有统计学意义;Cisplatin组p-mTOR/mTOR和p-Ulk1/Ulk1与Control组比较明显降低(P<0.01,图8);与Cisplatin组比较,DHA+Cisplatin组p-mTOR/mTOR和p-Ulk1/Ulk1显著升高(P<0.001,图8),表明DHA能减弱顺铂对mTOR/Ulk1信号通路激活的抑制作用。
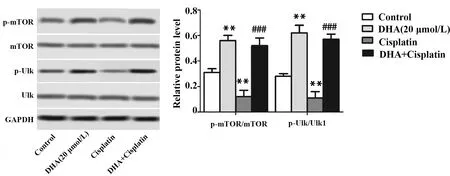
图8 DHA对顺铂抑制mTOR/Ulk1信号通路激活作用的影响Fig.8 Effect of DHA on inhibitory effect of mTOR/Ulk1 signaling pathwayNote:The expressions of p-mTOR,mTOR,p-Ulk1 and Ulk1 were measured by Western blot.n=6,**.P<0.01 versus control group;###.P<0.001 versus cisplatin group.
3 讨论
化疗是癌症治疗的常用方法,也是宫颈癌系统治疗的首选治疗方法。铂类药物是宫颈癌治疗的主要化疗药物,其中以顺铂最为常见。研究表明,顺铂可通过促进癌细胞DHA链断裂诱导癌细胞生长抑制和细胞凋亡,从而减缓癌症的发展甚至治愈癌症[9]。但长时间使用顺铂可诱导癌细胞化疗抵抗性的形成,减低癌细胞对顺铂的敏感性,从而导致顺铂化疗疗效降低甚至是治疗失效[10]。大量研究表明,自噬参与了癌细胞化疗抵抗性的形成,可帮助癌细胞逃避化疗药物的细胞毒性[11]。抑制自噬可增强癌细胞对化疗药物的敏感性,增强化疗药物对癌细胞的杀伤作用[12]。
DHA是疟疾治疗药物青蒿素的活性代谢产物,近年来研究发现DHA也具有广泛的抑癌活性。DHA能通过诱导癌细胞凋亡抑制结肠癌、乳腺癌及肺癌等癌细胞增殖,还能通过诱导细胞周期阻滞减缓癌症的发展[13-15]。本研究发现,用5、10和20 μmol/L 的DHA处理宫颈癌HeLa细胞4 d后,细胞增殖明显被抑制,表明DHA对HeLa细胞增殖有抑制作用。同时,研究发现DHA还能增强癌细胞对化疗药物的敏感性,作用机制与活性氧介导的死亡受体5的表达有关[16]。本研究也发现,DHA和化疗药物顺铂联用能显著增强顺铂对HeLa细胞增殖的抑制作用,并体现量效关系。DHA和顺铂联合处理细胞24 h后,还能显著增强顺铂抑制宫颈癌HeLa细胞增殖相关蛋白Ki67表达的作用。此外,DHA还能显著升高HeLa细胞的凋亡率,并增强顺铂对HeLa细胞凋亡的促进作用,提示DHA不仅能诱导宫颈癌细胞生长抑制和凋亡,还能增强宫颈癌HeLa细胞对化疗药物顺铂的敏感性。
自噬是机体自杀性死亡的一种形式,可通过清除受损蛋白和细胞器维持机体内环境稳定。研究表明,自噬在癌症的发生和发展过程中具有重要的调控作用[17]。自噬可通过抑制基因突变及癌症基因的表达抑制癌症的发生,在癌症早期可通过吞噬癌变细胞减缓癌症的发展,癌症发展后期自噬可通过为癌组织提供营养物质促进癌症的发展,还能帮助癌细胞抵抗化疗药物的细胞毒性[18]。近年来研究发现,多种药物可通过抑制癌细胞自噬增强化疗药物对癌症的治疗作用。Fukuda等[19]研究发现,抗疟药物氯喹可通过抑制自噬抑制子宫内膜癌细胞增殖并减弱癌细胞对顺铂的化疗抵抗性。辣椒素增强胆管癌对化疗药物的敏感性的作用也与抑制细胞自噬有关[20]。本文研究发现,顺铂能显著促进自噬相关蛋白Beclin1表达,上调LC3Ⅱ/LC3Ⅰ,并抑制P62的表达,表明顺铂能诱导HeLa细胞自噬。DHA能显著抑制HeLa细胞Beclin1的表达和LC3Ⅱ/LC3Ⅰ上调,并诱导P62表达,同时还能显著减弱顺铂对Beclin1、P62表达及LC3Ⅱ/LC3Ⅰ的调控作用,表明DHA可抑制顺铂诱导的宫颈癌HeLa细胞自噬。
mTOR/Ulk1信号通路是调控细胞自噬的重要通路。上游信号促进mTOR磷酸化从而激活mTOR,活化的mTOR可通过诱导Ulk1磷酸化而活化Ulk1,进而抑制自噬的发生[21]。白藜芦醇就可通过抑制mTOR/Ulk1信号通路的激活诱导自噬,抑制HeLa细胞增殖[22]。本研究发现,DHA能显著升高p-mTOR/mTOR和p-Ulk1/Ulk1,表明DHA能诱导HeLa细胞mTOR/Ulk1信号通路的激活。同时,DHA还能显著减弱顺铂降低p-mTOR/mTOR和p-Ulk1/Ulk1的作用,表明DHA可通过减弱顺铂对mTOR/Ulk1信号通路激活的抑制作用抑制宫颈癌HeLa细胞自噬,从而增强宫颈癌HeLa细胞对顺铂的化疗敏感性。
综上所述,DHA能抑制宫颈癌HeLa细胞增殖、诱导细胞凋亡,并抑制HeLa细胞自噬,促进mTOR/Ulk1信号通路激活。同时,DHA还能增强顺铂对HeLa细胞增殖的抑制作用及对细胞凋亡的诱导作用,同时抑制顺铂诱导的细胞自噬,减弱顺铂对mTOR/Ulk1信号通路的抑制作用,提示DHA可通过抑制顺铂诱导的自噬增强宫颈癌HeLa细胞对顺铂的化疗敏感性,并且作用机制与促进mTOR/Ulk1信号通路激活有关。本文首次探究了DHA对宫颈癌HeLa细胞化疗敏感性的作用及作用机制,可能为降低癌细胞化疗抵抗提供了新的潜力药物。
