青藤碱对人急性T淋巴细胞白血病细胞增殖与凋亡的影响及其机制①
2019-06-24范炎峰刘宽浩范金点邹梦梦
范炎峰 荆 玲 刘宽浩 范金点 邹梦梦
(黄河科技学院,郑州 450063)
急性白血病是儿童及青少年最常见的恶性肿瘤,其中急性淋巴细胞白血病(Acute lymphoblastic leukemia,ALL)在15岁以下人群最多发,发病率高峰在3~7岁,占儿童急性白血病的80%,其中约15%为急性T淋巴细胞白血病(T-ALL)[1]。尽管目前儿童ALL的化疗缓解率已达80%~90%,但传统化疗药物的毒副作用较强,且易出现多药耐药而导致化疗失败[2]。目前从天然植物中寻找高效低毒的抗肿瘤活性成分已成为获取新型抗肿瘤药物的重要途径之一。青藤碱(Sinomenine,SIN)是从中药青风藤中提取出的一种生物碱单体,具有抗炎、降压、镇痛、镇咳等药理作用。近年来研究发现,SIN对恶性胶质瘤、食管癌、乳腺癌、肺癌、骨肉瘤和纤维肉瘤等恶性肿瘤具有显著的抑制作用[3-8]。目前关于SIN对T-ALL是否具有抑制作用尚不明确。因此本研究以人T-ALL细胞株Jurkat和Molt-4以及人T淋巴细胞株H9为实验对象,旨在探索SIN影响T-ALL细胞增殖与凋亡的作用及机理,为SIN在T-ALL中的临床应用提供理论依据。
1 材料与方法
1.1材料 Jurkat和MOLT-4细胞株购自中国医学科学院基础医学研究所基础医学细胞中心;H9细胞株购自美国ATCC公司;SIN(批号110774-200507,规格20 mg/支,纯度≥99.5%)和长春新碱(Vincristine,VCR)购自中国药品生物制品检定所;胎牛血清(Fetal bovine serum,FBS)、RPMI1640培养基购自美国Hyclone公司;CCK-8试剂盒、Edu-555细胞增殖检测试剂盒、细胞周期检测试剂盒、AnnexinV-FITC凋亡检测试剂盒、RIPA裂解液和ECL化学发光试剂盒购自上海碧云天生物技术有限公司;Giemsa染料购自北京索莱宝科技有限公司;兔抗人ERK1/2、p-ERK1/2、Akt、p-Akt、细胞周期蛋白(Cyclin)B1、细胞周期蛋白依赖激酶(Cyclin-dependent kinase,CDK1)、Bcl-2、Bax、β-actin单克隆抗体和辣根过氧化物酶标记山羊抗兔IgG购自美国Abcam公司。
1.2方法
1.2.1细胞培养 H9、Jurkat和MOLT-4细胞用含10%FBS的RPMI1640培养液,在37℃、5%CO2条件下培养。每2~3 d传代1次。
1.2.2CCK-8法检测细胞活力 取对数生长期H9、Jurkat和MOLT-4细胞,以每孔5 000个接种于96孔板。培养24 h后,分别加入100 μl含不同剂量SIN(0.25、0.5、1、2、4、8 mmol/L)或VCR(0.25、0.5、1、2、4、8 nmol/L)的细胞培养液,每个浓度设5个复孔,同时设调零孔和对照孔。培养48 h 后,每孔加入10 μl CCK-8溶液,37℃孵育1 h,用酶标仪于450 nm波长处检测吸光度A值。细胞活力=(加药孔A值/对照孔A值)×100%。使用SPSS16.0软件利用Probit回归模型计算SIN对细胞的半数抑制浓度(Half maximal inhibitory concentration,IC50)。
1.2.3EdU掺入法检测细胞增殖 将取对数生长期Jurkat细胞,以每孔5×105个接种于6孔板,常规培养24 h后去上清,分别加入不同剂量SIN(0.5、1、2 mmol/L)或VCR(4 nmol/L)处理48 h后,每孔加入1 ml用细胞培养液按1∶500稀释的EdU溶液;继续孵育2 h后,PBS洗涤2次,加入1 ml固定液,室温固定15 min;PBS洗涤2次,加入1 ml通透液,室温孵育15 min;PBS洗涤2次,加入0.5 ml Click反应液,室温避光孵育30 min;PBS洗涤2次,使用流式细胞仪检测EdU标记的阳性细胞比例。实验重复3次。
1.2.4流式细胞术检测细胞周期 细胞处理同1.2.3,收集细胞,PBS洗涤2次,加入1 ml 70%冰乙醇于4℃固定24 h,PBS洗涤2次,加入碘化丙啶(Propidium iodide,PI)染色液,4℃避光染色30 min,使用流式细胞仪分析细胞周期。实验重复3次。
1.2.5流式细胞术检测细胞凋亡 细胞处理同1.2.3,收集细胞,用PBS洗涤3次,重悬于400 μl AnnexinV-FITC结合液中。先加入5 μl AnnexinV-FITC,4℃避光孵育15 min,再加入10 μl PI染色液,4℃避光孵育15 min。使用流式细胞仪分析检测细胞凋亡。实验重复3次。
1.2.6Western blot检测蛋白表达水平 取对数生长期Jurkat细胞,经不同剂量SIN(0.5、1、2 mmol/L)处理48 h后,收集细胞,用RIPA裂解各组细胞提取总蛋白,用紫外分光光度法测定蛋白质浓度,取25 μg 蛋白样品进行SDS-PAGE电泳并转移至PVDF膜,用封闭液(5%BSA/TBST)封闭1 h,加入一抗(ERK1/2、p-ERK1/2、Akt、p-Akt、Cyclin B1、CDK1、Bcl-2和Bax抗体均以1∶1 000稀释,β-actin抗体以1∶2 000稀释),4℃孵育过夜,TBST洗膜3次,加入二抗(1∶2 000稀释)室温下孵育1 h,TBST洗膜3次,加入ECL进行发光反应,暗室X胶片显影,拍照,使用Image J1.45s软件进行灰度分析。实验重复3次。
2 结果
2.1SIN对细胞活力的影响 如图1A所示,与对照组相比,不同剂量SIN(0.25、0.5、1、2、4、8 mmol/L)处理48 h后,Jurkat和Molt-4细胞活力明显下降(P<0.05),且随着SIN剂量的增加呈下降趋势,SIN作用Jurkat和Molt-4细胞48 h的IC50分别为1.49 mmol/L和3.08 mmol/L,而H9细胞活力从4 mmol/L开始才有所降低(P<0.05)。此外,相同条件下阳性对照药物VCR作用H9、Jurkat和Molt-4细胞48 h的IC50分别为1.56 nmol/L、4.73 nmol/L和3.32 nmol/L,见图1B。这表明SIN对H9细胞的毒性作用较小,但对Jurkat和Molt-4细胞具有较强的毒性作用,并呈剂量依赖性。
2.2SIN对Jurkat细胞增殖的影响 如图2所示,与对照组相比,不同剂量SIN(0.5、1、2 mmol/L)处理Jurkat细胞48 h后,EdU阳性率显著降低(P<0.05),且不同浓度间EdU阳性率的差异有统计学意义(P<0.05);此外,相同条件下对照药物VCR(4 nmol/L) 也使EdU阳性率显著降低(P<0.05)。这表明SIN可抑制Jurkat细胞增殖,且呈剂量依赖性。
2.3SIN对Jurkat细胞周期的影响 如图3所示,与对照组相比,不同剂量SIN(0.5、1、2 mmol/L)处理Jurkat细胞48 h后, G2/M期细胞比例逐渐升高(P<0.05),且各组间G2/M期细胞比例的差异有统计学意义(P<0.05),而G0/G1期和S期细胞比例有所降低(P<0.05);此外,4 nmol/L VCR组G2/M期细胞数量也明显升高(P<0.05),而G0/G1期和S期细胞比例均明显降低(P<0.05)。这表明SIN可诱导Jurkat细胞发生G2/M期阻滞,且呈剂量依赖性。

图1 H9、Jurkat和Molt-4细胞活力的变化Fig.1 Changes of cell viability in H9,Jurkat and Molt-4 cells.Note: A.SIN;B.VCR.*.P<0.05 vs control group.

图2 SIN抑制Jurkat细胞增殖Fig.2 SIN inhibits proliferation of Jurkat cellsNote: A.EdU assay;B.Statistical analysis.*.P<0.05 vs control group;#.P<0.05 vs 0.5 mmol/L SIN group;△.P<0.05 vs 1 mmol/L SIN group.
2.4SIN对Jurkat细胞凋亡的影响 如图4所示,与对照组相比,不同剂量SIN(0.5、1、2 mmol/L)处理Jurkat细胞48 h后,细胞凋亡率显著升高(P<0.05),且各组间细胞凋亡率的差异有统计学意义(P<0.05);此外,4 nmol/L VCR组细胞凋亡率也显著升高(P<0.05)。这表明SIN可剂量依赖性地诱导Jurkat细胞凋亡。

图3 SIN阻滞Jurkat细胞于G2/M期Fig.3 SIN arrests cell cycle of Jurkat cells at G2/M phaseNote: A.Cell cycle analysis;B.Statistical analysis.*.P<0.05 vs control group;#.P<0.05 vs 0.5 mmol/L SIN group;△.P<0.05 vs 1 mmol/L SIN group.

图4 SIN诱导Jurkat细胞凋亡Fig.4 SIN induces apoptosis of Jurkat cellsNote: A.Apoptosis detection;B.Statistical analysis.*.P<0.05 vs control group;#.P<0.05 vs 0.5 mmol/L SIN group;△.P<0.05 vs 1 mmol/L SIN group.
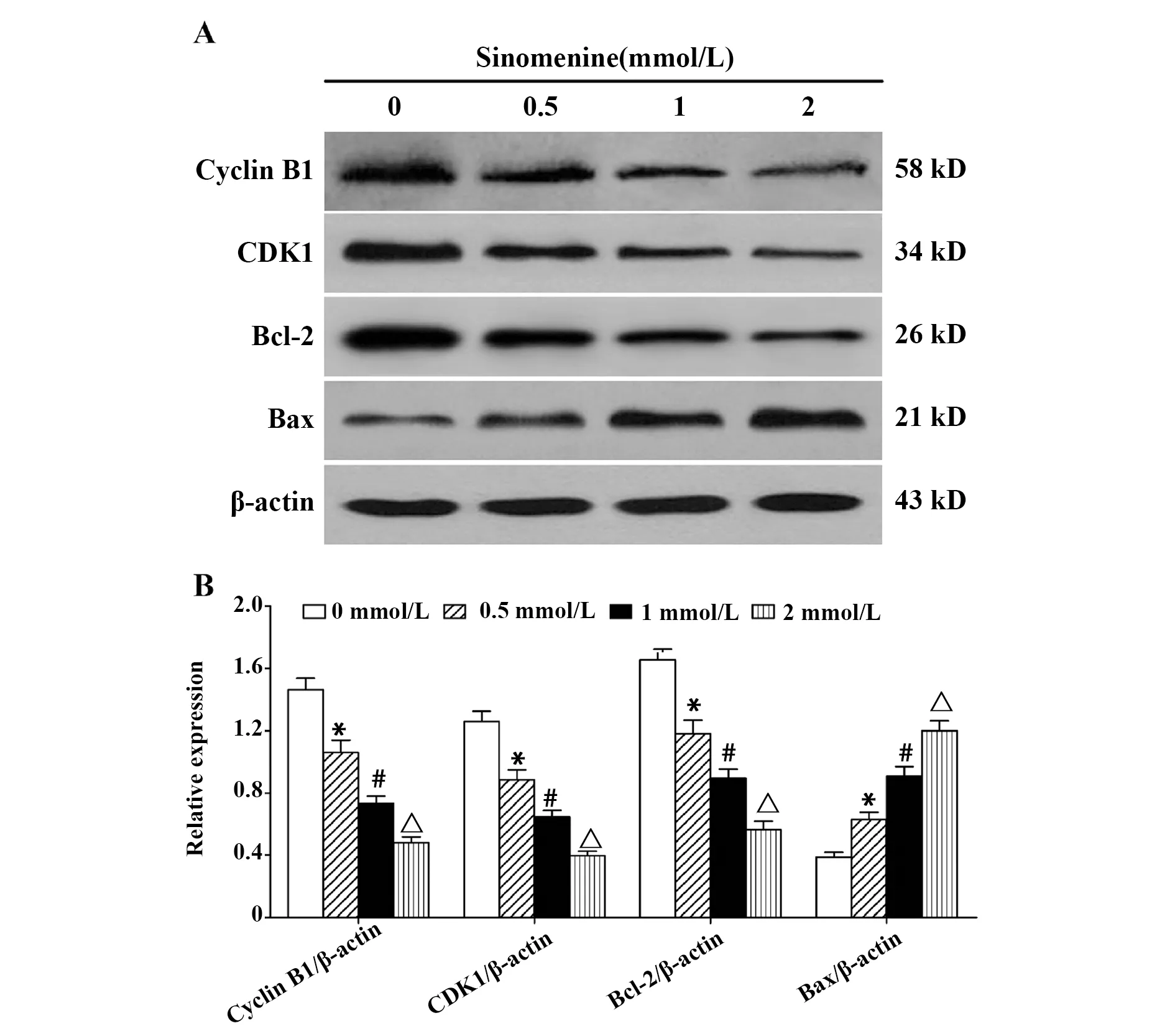
图5 SIN对Jurkat细胞Cyclin B1、CDK1、Bcl-2和Bax蛋白表达水平的影响Fig.5 Effect of SIN on protein levels of Cyclin B1,CDK1,Bcl-2 and Bax in Jurkat cellsNote: A.Western blot assay;B.Statistical analysis.*.P<0.05 vs control group;#.P<0.05 vs 0.5 mmol/L SIN group;△.P<0.05 vs 1 mmol/L SIN group.

图6 SIN抑制Jurkat细胞中ERK1/2和Akt磷酸化Fig.6 SIN inhibits phosphorylation of ERK1/2 and Akt in Jurkat cellsNote: A.Western blot assay;B.statistical analysis.*.P<0.05 vs control group;#.P<0.05 vs 0.5 mmol/L SIN group;△.P<0.05 vs 1 mmol/L SIN group.
2.5SIN对c-Myc、Cyclin B1、CDK1、Bcl-2和Bax蛋白表达水平的影响 如图5所示,与对照组相比,不同剂量SIN(0.5、1、2 mmol/L)处理Jurkat细胞48 h 后 ,细胞中Cyclin B1、CDK1和Bcl-2蛋白表达水平显著降低(P<0.05),而Bax蛋白表达水平显著升高,且各组间Cyclin B1、CDK1、Bcl-2和Bax蛋白表达水平的差异有统计学意义(P<0.05)。
2.6SIN对ERK1/2和Akt磷酸化的影响 如图6所示,与对照组相比,不同剂量SIN(0.5、1、2 mmol/L)处理Jurkat细胞48 h后,细胞中的ERK1/2和Akt蛋白的磷酸化水平显著降低(P<0.05),且各组间ERK1/2和Akt蛋白磷酸化水平的差异有统计学意义(P<0.05)。这表明SIN可剂量依赖性地抑制ERK1/2和Akt信号通路。
3 讨论
目前急性白血病的治疗以化疗为主,尽管化疗效果和预后都有显著改善,但化疗药物多为非选择性细胞杀伤剂,毒副作用大,且易出现多药耐药而限制其疗效。因此,寻找高效低毒的新型抗肿瘤药物成为研究的热点之一。青风藤为青藤或毛青藤等防己科植物的干燥藤茎,含有青藤碱、双青藤碱、木兰花碱、尖防己碱、异青藤碱、清风藤碱等多种生物碱。SIN具有镇痛镇静、镇咳局麻、降血压、抗炎等作用,临床上用于治疗风湿性关节炎和神经痛。近年来,SIN的抗肿瘤活性备受关注。在本研究中,CCK-8法检测结果显示SIN可显著抑制Jurkat细胞活力,并呈时间和剂量依赖性。流式细胞术结果进一步证实,SIN可剂量依赖性地抑制Jurkat细胞增殖并诱导其凋亡。
肿瘤细胞以有丝分裂的方式进行增殖,而从一次有丝分裂完成开始到下一次有丝分裂结束所经历的全过程称为细胞周期。细胞周期是多因子参与的、高度精确和有组织的时序调控过程。不同的细胞周期具有各自特征性的细胞周期蛋白,各期的Cyclin可激活特定的CDK,继而磷酸化相应的底物,使细胞周期顺序推进[9,10]。Jiang等[3]研究发现,SIN可阻滞人恶性胶质瘤U87和SF767细胞于G0/G1期,这可能与其下调Cyclin D1、Cyclin D3、Cyclin E和CDK4以及上调p21waf1/cip1和p27kip1蛋白表达有关。Fu等[4]研究证实,SIN可下调Cyclin B1和CDK1蛋白表达水平,使人食管鳞状细胞癌Eca109和EC9706细胞发生G2/M期阻滞。在G2期,Cyclin B1与CDK1形成的复合物称为成熟促进因子(Maturation promoting factor,MPF),使细胞从G2期进入M期[11]。本研究证实,SIN可剂量依赖地下调Cyclin B1和CDK1蛋白表达水平,从而导致Jurkat细胞发生G2/M期阻滞。
为探究SIN诱导Jurkat细胞凋亡的分子机制,本研究观察了SIN对Jurkat细胞Bcl-2和Bax蛋白表达水平的影响,结果发现SIN可下调Jurkat细胞中Bcl-2蛋白表达水平,同时上调Bax蛋白表达水平。Bcl-2家族在调控细胞凋亡过程中发挥着至关重要的作用[12,13]。Bcl-2家族根据结构和功能可以分为两大类:一类是抗凋亡蛋白,主要包括Bcl-2、Bcl-xl、Bcl-w、Mcl-1等;另一类是促凋亡蛋白,主要有Bax、Bak、Bad、Bid等。Bax即可插入线粒体外膜并聚合成孔道,也可与线粒体外膜的电压依赖性离子通道结合导致线粒体通透性转换孔持续开放,触发线粒体外膜透化(Mitochondrial outer membrane permeabilization,MOMP),释放出包括细胞色素(Cytochrome C,Cyt C)在内的多种促凋亡蛋白,最终导致细胞凋亡[14]。定位在线粒体外膜上的Bcl-2可与Bax形成异源二聚体,阻止Bax引起的MOMP和Cyt C释放,从而抑制细胞凋亡[12]。
此外,ERK1/2和Akt信号通路在肿瘤细胞的增殖和凋亡过程中也发挥着重要作用。磷酸化的ERK1/2进入细胞核后可作用Elk1、c-Fos、c-Myc和AP1等转录因子,后者进一步影响原癌基因的表达,以增强肿瘤细胞的增殖能力和存活能力[15]。多项研究证实,抑制ERK1/2信号通路可减弱Jurkat细胞的增殖能力,并引起细胞周期阻滞[16-18]。Wang等[19]研究发现,抑制Akt信号通路可通过上调p21waf1/cip1和Bad蛋白表达水平抑制Jurkat细胞增殖并诱导其凋亡。本研究表明,SIN可剂量依赖地下调ERK1/2和Akt蛋白的磷酸化水平,这可能是SIN抑制Jurkat细胞活力的重要机制之一。
综上所述,SIN可在体外剂量依赖性抑制Jurkat细胞增殖并诱导其凋亡和G2/M期阻滞,这可能与其下调Bcl-2、Cyclin B1和CDK1蛋白表达水平、上调Bax蛋白表达水平以及抑制ERK1/2和Akt信号通路有关。
