miR-144靶向PIK3CD基因影响结直肠癌细胞增殖和细胞因子表达的作用机制①
2019-06-24陈红跃杨萌萌张小路
陈红跃 杨萌萌 张小路 段 铮
(河南省中医院普外科,郑州 450000)
结直肠癌(Colorectal cancer,CRC)是世界第三大致死癌症,具有极高的发病率和致死率,据报道每年大约有600 000人死于CRC[1,2]。虽然随着诊疗技术以及医疗水平的提高,CRC的发病率和死亡率有所改善,但是目前主要采用的治疗手段仍为手术结合辅助治疗,在诊疗过后仍有过半的CRC患者发生转移,患者5年生存率不足10%[3,4]。因此,寻找一种新型、有效的诊疗手段对于减轻CRC患者痛苦和提高其生存率具有重大意义。
miRNA长度约为19~25 nt,能够与下游多个靶基因mRNA的3′UTR特异性结合,通过抑制靶基因翻译或者促进其发生降解从而发挥特定的生物学功能[5]。一般情况下,miRNA在生物体内的种类以及表达水平趋于稳态,正常参与调控细胞的增殖、分化、凋亡等代谢活性[6]。miRNA表达水平的失调通常在肿瘤发生以及癌变进程中发挥非常关键的作用[7]。研究表明,在CRC组织中有多种miRNA表达水平出现显著下调,包括miR-466、miR-126、miR-144等[8-10]。其中,miR-144被证实是一种红系特异性miRNA,与红系细胞存活和成熟息息相关,并且其表达下调能够激活mTOR通路并导致CRC患者的不良预后反应[11-13]。 然而,关于miR-144在CRC中的调控机制却鲜有报道。
磷脂酰肌醇-3激酶催化亚基δ(Phosphoinosit-ide-3 kinase catalytic subunit δ,PIK3CD)是重要的细胞生长调节因子[14,15],并且在细胞免疫和体液免疫中发挥重要作用[16,17]。本研究发现PIK3CD可能是miR-144的潜在靶标,并通过实验证实两者之间的靶向关系以及其在CRC中的具体作用机制。
1 资料与方法
1.1资料
1.1.1一般资料 选取2016年3月至2017年2月于本院进行治疗的CRC患者56例为研究对象,所有患者均经手术病理证实为CRC,男30例,女26例,年龄45~72岁,平均(53.67±5.59)岁,所有患者术前均未接受放疗或化疗及激素类药物治疗。本研究经本院伦理委员会批准,患者及家属知情且签署同意书。所有患者均行手术治疗,于术中切除CRC癌组织及相应癌旁组织标本,迅速放入液氮中,术后将其转移至-80℃超低温冰箱内保存。
1.1.2实验材料 本研究所选用的HCT116细胞购于北京北纳生物(货号BNCC337692),NCM460细胞购于上海纪宁生物(货号JN-3150),胎牛血清、DMEM/F-12培养基和0.25%胰蛋白酶购于Gibco(货号10099158、11320-033、25200056),MTT、BCA试剂盒购于碧云天生物(货号C0009、P0010),PIK3CD小鼠单抗购于美国Santa Cruz(货号sc-136032),β-action小鼠单抗购于美国Cell Signaling Technology(货号#3700),HRP羊抗鼠二抗购于Abcam公司(货号ab205719),PureLinkTMRNA Mini Kit RNA提取试剂盒、SuperScriptTMⅣ逆转录酶购于Invitrogen(货号12183018A、18091050),Lipofectamine 3000购于Thermo(货号L3000001),TB GreenTM购于TaKaRa(货号RR820A),双荧光素酶试剂盒购于北京华夏远洋科技有限公司(货号RG008),Human TNF-α、sIL-2R ELISA试剂盒(货号70-EK11392、85-BMS212-2),PIK3CD siRNA、miR-144模拟物和抑制剂由上海吉玛公司合成,引物由Invitrogen合成,TNF-α酶联免疫吸附(ELISA)试剂盒购自上海酶联生物科技有限公司(货号ml064303),人可溶性白介素2受体(sIL-2R) ELISA试剂盒购自上海晶抗生物工程有限公司(货号JLC5531),ECL化学发光试剂购自上海爱必信生物科技有限公司(货号abs920)。
1.2方法
1.2.1结直肠癌细胞的培养 NCM460、HCT116细胞使用含有100 mg/L的链霉素、100 U的青霉素和10%胎牛血清的DMEM/F-12培养基复苏以及培养,培养条件为90%相对湿度、5%CO2的37℃培养箱,2~3 d 换液1次。
1.2.2细胞的转染 待细胞融合度为70%左右时,采用高效率的Lipofectamine 3000方法,对HCT116细胞进行转染。其中,设置PIK3CD siRNA组、对照siRNA组以及加入等体积转染液的空白对照组,转染结束后正常培养;以miR-144模拟物、miR-144抑制剂、对照miRNA分别转染HCT116细胞,空白对照组加入等体积转染液,转染结束后正常培养。
1.2.3MTT实验 分别取处于对数生长期的各组HCT116细胞,置于96孔板中,细胞密度为5×104个/孔,加入20 μl的0.5%MTT溶液于37℃条件下孵育4 h,离心弃上清,加入150 μl DMSO溶解结晶后,使用酶标仪读取OD490处的数值并绘制HCT116细胞的增殖曲线。
1.2.4RT-qPCR实验 使用PureLinkTMRNA Mini Kit提取细胞内总RNA,并使用SuperScriptTMⅣ合成cDNA,具体操作参照说明书。反应体系体积为20 μl,包含10 μl TB GreenTM、0.4 μl 上游引物、0.4 μl下游引物、1 ng模板,ddH2O补足至20 μl。反应程序采用两步法,具体为98℃ 15 s、60℃ 30 s,40个循环。其中,PIK3CD上游引物为5′-TGCCAAACCACCTCCCATTCC-3′,下游引物为5′-CATCTCGTTGCCGTGGAAAAGC-3′;β-actin上游引物为5′-CAATGTGGCCGAGGACTTTG-3′,下游引物为5′-CATTCTCCTTAGAGAGAAGTGG-3′。以β-actin为内参,2-ΔΔCt法计算PIK3CD mRNA的相对表达量。
1.2.5Western blot实验 使用RIPA细胞裂解液处理HCT116细胞,离心收集可溶性蛋白并使用BCA法测定蛋白含量,具体操作参考说明书。取70 μg 蛋白在95℃条件下加热10 min后,利用浓度为12%的SDS-PAGE胶分离蛋白。使用转膜仪将蛋白从胶上转移至大小适宜的PVDF膜上,使用5%的脱脂奶粉于4℃条件下低温封闭过夜。第2天,使用PIK3CD一抗溶液(稀释比例为1∶1 000)室温孵育3 h,TBST洗膜3次,每次10 min,之后加入HRP标记的二抗溶液(稀释比例为1∶500)反应1 h,TBST洗膜4次,每次10 min。于黑暗条件下进行显色反应,并对蛋白条带进行灰度分析,实验以β-actin为内参。
1.2.6双荧光素酶报告实验 设计含有miR-144结合位点的PIK3CD WT-3′-UTR和MUT-3′-UTR片段,将其插入到检测质粒的报告基因下游,获得含有PIK3CD WT-3′-UTR以及MUT-3′-UTR片段的重组质粒。使用Lipofectamine 3000将miR-144模拟物与PIK3CD WT-3′-UTR和MUT-3′-UTR的报告基因质粒共转染,培养48 h后使用试剂盒检测荧光活性。
1.2.7ELISA实验 收集各组HCT116细胞的上清培养液,使用PBS稀释至适宜浓度后,添加至96孔板内,40℃孵育至液体全部挥发,再次使用PBS洗涤3~5次,之后添加2%的牛血清蛋白室温反应1 h,结束后使用PBS洗涤3次。使用0.05%的TBST溶液对TNF-α、sIL-2R 抗体进行稀释,并添加至96孔板内,37℃反应1 h。结束后,使用PBS洗涤3次,加入HRP标记的二抗溶液反应3 h。之后,再次使用PBS洗涤3次,加入反应底物,酶标仪读取450 nm吸光值。
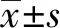
2 结果
2.1miR-144和PIK3CD在CRC和正常结肠组织及细胞中表达情况 本研究检测了CRC组织以及正常结肠组织中miR-144和PIK3CD表达水平,结果显示CRC组织中的miR-144表达水平显著下调(P<0.05),PIK3CD的mRNA以及蛋白表达显著上调(P<0.05),见图1A~C。为进一步探究miR-144和PIK3CD在结直肠癌细胞以及正常结肠细胞中的表达变化,RT-qPCR和Western blot技术检测了NCM460和HCT116细胞中两者的表达水平。结果显示,与正常结肠细胞NCM460相比,HCT116细胞中的miR-144表达显著下调(P<0.05),PIK3CD显著上调(P<0.05),与CRC组织结果一致,见图1D~F。
2.2miR-144对HCT116细胞增殖以及TNF-α和sIL-2R的表达具有抑制作用 RT-qPCR结果显示,miR-144模拟物能够显著提升HCT116细胞中miR-144的表达水平(P<0.05),见图2A。使用MTT法检测miR-144对细胞增殖能力的影响发现,转染miR-144模拟物组细胞生长受到抑制,显著低于对照组(P<0.05),见图2B。ELISA结果显示,过表达miR-144能够显著抑制TNF-α和sIL-2R的蛋白表达水平,差异具有统计学意义(P<0.05),见图2C。以上结果提示miR-144模拟物对HCT116细胞的生长增殖具有抑制作用,并且抑制TNF-α和sIL-2R蛋白的表达。
2.3敲低PIK3CD抑制细胞增殖以及TNF-α和sIL-2R的表达 为了探究PIK3CD与细胞增殖以及TNF-α和sIL-2R表达的关系,转染PIK3CD siRNA至HCT116细胞中,MTT法检测细胞增殖能力,ELISA检测TNF-α和sIL-2R的表达情况。结果显示,与对照组相比,si-PIK3CD组的PIK3CD mRNA和蛋白相对表达量显著降低(P<0.05),见图3A、B。MTT结果显示,PIK3CD siRNA对HCT116细胞生长具有明显的抑制作用(P<0.05),见图3C。ELISA结果表明,PIK3CD siRNA可抑制TNF-α和sIL-2R的表达(P<0.05),见图3D。

图3 PIK3CD siRNA对HCT116细胞增殖及TNF-α、sIL-2R表达的影响Fig.3 Effects of PIK3CD siRNA on HCT116 cell proliferation and TNF-α,sIL-2R expressionNote: A and B.Expression of PIK3CD in HCT116 cells was detected by RT-qPCR and Western blot;C.Proliferation of HCT116 cell was detected by MTT;*.P<0.05;D.Expression of TNF-α and sIL-2 was detected by ELISA;compared with the si-Control group,*.P<0.05,#.P<0.01.

图4 miR-144对PIK3CD的靶向调控作用Fig.4 Regulation of miR-144 targeting on PIK3CDNote: A.Target prediction of miR-144 and PIK3CD;B.Identification of target regulation by double Luciferase assay;C and D.Expression of PIK3CD mRNA and protein were detected by RT-qPCR and Western blot;compared with the miR-control,*.P<0.05;Compared with the anti-miR-control,#.P<0.05.
2.4miR-144靶向负调控PIK3CD 通过在线软件miRcode分析发现,miR-144能够与PIK3CD的3′UTR区特异性结合(图4A),为验证两者之间的靶向关系,本研究构建了含有PIK3CD 3′UTR片段的荧光素酶野生型和突变型报告质粒(PIK3CD-3′UTR-WT和PIK3CD-3′UTR-MUT),并与miR-144模拟物共转染至HCT116细胞以验证其作用关系。结果显示,与PIK3CD-3′UTR-MUT相比,PIK3CD-3′UTR-WT与miR-144共转染组的荧光素酶活性显著下降(P<0.05),表明miR-144与PIK3CD基因存在靶向调控关系,见图4B。将miR-144模拟物与抑制剂转入HCT116细胞中发现,miR-144模拟物使PIK3CD mRNA和蛋白表达水平下调,而miR-144抑制物对PIK3CD的mRNA以及蛋白表达具有显著的促进作用(P<0.05),以上说明miR-144对PIK3CD具有负调控作用,见图4C、D。

图5 miR-144靶向PIK3CD调控TNF-α、sIL-2R的表达和细胞增殖Fig.5 miR-144 regulates TNF-α,sIL-2R expression and cell proliferation by targeting PIK3CDNote: A.Proliferation of HCT116 cells was detected by MTT;B.Expression of TNF-α and sIL-2 was detected by ELISA;compared with the control,*.P<0.05.
2.5miR-144通过靶向PIK3CD调控细胞增殖和免疫功能 为探究miR-144和PIK3CD参与调控细胞增殖的具体机制,本研究将miR-144抑制剂与PIK3CD siRNA共转染至HCT116细胞,检测细胞的生长情况以及对TNF-α和sIL-2R表达水平的影响。MTT结果显示,miR-144抑制剂能够显著促进细胞增殖,而miR-144抑制剂与PIK3CD siRNA共转染则会抑制HCT116细胞增殖(P<0.05),见图5A。ELISA结果显示,miR-144抑制剂能够促进TNF-α和sIL-2R的表达,而miR-144抑制剂与PIK3CD siRNA共转染细胞后,TNF-α和sIL-2R表达水平与对照组相比增加,与miR-144抑制剂组相比表达水平下降(P<0.05),见图5B。以上结果提示,miR-144通过靶向负调控PIK3CD,进而参与调控HCT116细胞的增殖和免疫功能。
3 讨论
miRNA表达水平的异常与肿瘤的发生密切相关[7],因此阐明miR-144在CRC发展过程中的分子作用机制可以增加对CRC的认识,并为新的诊疗手段提供见解和依据,具有重要意义。miR-144的基因序列位于11号染色体,在多种癌症中均出现表达下调[10]。除此之外,Wang等[18]通过对28篇已发表的包括1 843例癌症样本以及1 097例正常样本的miRNA表达谱进行分析发现,在16种不同的癌症中有29种miRNA均出现表达下调,其中包括miR-144。研究表明,miR-144可通过靶向多种基因对癌细胞的生物学功能产生影响,其中Han等[19]指出miR-144可靶向RUNX1抑制卵巢癌细胞的增殖迁移,Ren等[20]和Ying等[21]提出miR-144作用于Pim-1原癌基因(PIM1)和环氧合酶-2基因可分别对胃癌以及食管鳞癌细胞产生抑制作用。本研究发现,miR-144在CRC组织以及HCT116细胞中表达显著下调,与上述结果一致。miRcode软件分析结果显示,细胞的重要调节因子PIK3CD的3′UTR含有与miR-144互补的种子序列,是miR-144的潜在靶标。当过表达miR-144时,HCT116细胞中PIK3CD的mRNA和蛋白表达水平均出现显著下调,并且双荧光素酶报告实验也证实了这种靶向关系。
PIK3CD是一个大小约为110 kD的催化亚基,与85 kD的调节亚基共同组成具有脂质激酶和蛋白激酶活性的PI3K分子,在细胞信号转导和细胞免疫功能中发挥重要作用[14]。Fransson等[22]发现PIK3CD在神经母细胞瘤中表达量增高;Christiane等[23]和Shi等[24]发现胶质母细胞瘤中PIK3CD表达水平出现显著上调;并且Sawyer等[25]指出PIK3CD对乳腺癌细胞表皮生长因子具有一定趋化性。本研究率先发现了miR-144与PIK3CD之间的靶向调控关系,并且也证实了PIK3CD在CRC中高表达的现象,与文献报道一致[26]。当降低PIK3CD基因表达水平后,HCT116细胞的增殖能力减弱,TNF-α和sIL-2R的表达水平均出现下调现象,与过表达miR-144结果一致。而TNF-α和sIL-2R表达水平的高低通常代表细胞免疫功能的强弱[27],以上结果提示PIK3CD基因可能直接参与了HCT116细胞的生长调节以及免疫调控。当敲低miR-144的表达水平时,PIK3CD的mRNA和蛋白表达水平均出现上调现象,并且促进HCT116细胞的增殖和TNF-α和sIL-2R的表达,结果表明miR-144通过靶向PIK3CD参与调控HCT116细胞的增殖以及免疫功能。
本研究主要探讨了miR-144在CRC患者中的表达水平以及miR-144与PIK3CD之间的作用关系和具体的分子机制,并且证实了miR-144通过靶向PIK3CD抑制HCT116细胞的免疫功能及其增殖能力,为CRC的治疗手段提供了新的靶点以及理论依据。然而,PIK3CD作为PI3K分子的主要亚基组成部分,在PI3K信号通路中具有重要作用,关于miR-144对细胞生物学功能产生的影响及其与PIK3CD以及信号通路之间的调控模式仍不是很清晰。除此之外,同一种miRNA通常同时参与多个下游靶基因的表达调控,细胞内部调控网络中miRNA对全局调控分配机制研究较少,在疾病、肿瘤等发生进程中不同靶基因调控模式的变化水平以及具体的分配机制仍需大量的科学研究。