IL-22对骨髓来源巨噬细胞相关炎症因子表达的影响①
2019-06-24冼小龙胡榜利覃山羽苏思标姜海行
冼小龙 罗 薇 胡榜利 覃山羽 苏思标 姜海行
(广西医科大学第一附属医院消化内科,南宁 530021)
肝纤维化是肝脏慢性炎症时引发持续性损伤修复反应,导致肝组织内细胞外基质异常沉积,进一步引发肝脏结构改变和肝功能异常的一种病理过程,严重者可发展为肝硬化[1]。巨噬细胞在肝纤维化发展过程中发挥着重要作用[2]。目前将巨噬细胞分成两型,即促炎型(M1型巨噬细胞)和抗炎型(M2型巨噬细胞)。由脂多糖(Lipopolysaccharides,LPS)或干扰素-γ(Interferon-γ,IFN-γ)活化可形成M1型巨噬细胞,M1型巨噬细胞能产生炎症细胞因子,如肿瘤坏死因子α(Tumor necrosis factor α,TNF-α)、IL-1β、IL-6等,招募集成纤维细胞和其他炎症细胞,进而促进肝纤维化的进程[3]。
IL-22属于IL-10家族,是新近发现的一种免疫介质,主要由激活的Th22、Th17、Th1、NK、NKT等细胞分泌[4]。已有研究证实,IL-22诱导肝星状细胞(Hepatic stellate cells,HSC)凋亡,抑制肝纤维化进展,具有保护肝细胞的作用[5,6]。目前IL-22在肝脏中的研究多集中于肝细胞和HSC,但对巨噬细胞的研究鲜有报道。因此,本研究重点探讨IL-22对LPS诱导的骨髓来源巨噬细胞相关炎症因子表达的影响。
1 材料与方法
1.1材料 C57BL/6小鼠(6~8周,雄性),体重18~22 g,SPF级,由广西医科大学实验动物中心提供,动物许可证号:SYXK(桂)2014-0002。细胞培养基DMEM,胎牛血清(美国Gibco);青链霉素(北京索莱宝);M-CSF,rmIL-22(美国R&D);脂多糖(美国Sigma);乳胶微球(1 μm,美国Sigma);ACCUTASE细胞消化液(加拿大StemCell);Stain Buffer(FBS),Fixation/Permeabilization Solution Kit,流式细胞仪FACSCantoⅡ(美国BD);FITC标记CD11b抗体,PerCP-Cyanine5.5标记F4/80抗体,PE标记iNOS抗体(美国ebioscience);总RNA提取试剂盒(上海生物工程);HiScript®Ⅱ One Step RT-PCR Kit(南京诺唯赞生物科技);小鼠IL1-β、TNF-α ELISA检测试剂盒(武汉华美生物工程)。
1.2方法
1.2.1骨髓来源巨噬细胞的获取及M1型巨噬细胞的体外诱导 参考Weng等[7]的方法,颈椎脱臼法处死小鼠,75%酒精浸泡5 min,尽快将股骨与肌肉组织分离,用冰冷的PBS反复冲洗,将股骨从中间剪成两段,用1 ml注射器吸取冰冷的PBS冲出骨髓,轻轻反复吹散细胞,以1 500 r/min离心5 min 弃上清,用2 ml 红细胞裂解液重悬以裂解红细胞,1 min后立即加入20 ml DMEM,充分混匀,过400目细胞筛,再以1 500 r/min 离心5 min,弃上清,沉淀用冰冷的PBS重悬清洗细胞2次,用含M-CSF(50 ng/ml)的DMEM完全培养基(含1%双抗和10%胎牛血清)重悬细胞,计数按1×106个/ml细胞接种于6孔板,培养3 d后,重新换含M-CSF(50 ng/ml)的DMEM完全培养基再培养4 d。第7天换不含M-CSF的DMEM完全培养基去除非贴壁细胞,贴壁细胞即为骨髓来源巨噬细胞(M0型巨噬细胞)。LPS(1 μg/ml)刺激M0型巨噬细胞24 h,诱导形成M1型巨噬细胞。光镜观察M0及M1巨噬细胞形态。
1.2.2吞噬功能实验 培养于6孔板内的骨髓巨噬细胞加入1 μl带荧光标记的乳胶微球,在细胞培养箱中继续培养2 h,用PBS洗掉未被骨髓巨噬细胞吞噬的乳胶微球,再用光镜和荧光显微镜观察骨髓巨噬细胞的吞噬功能。
1.2.3流式细胞术检测骨髓来源巨噬细胞的纯度及M1型巨噬细胞的比例 用ACCUTASE细胞消化液消化细胞并计数后,按1 ×106个/ml分装至EP管中,1 500 r/min离心5 min,PBS洗1遍,离心后弃上清,用FBS重悬细胞,加入FITC标记CD11b抗体和PerCP-Cyanine5.5标记F4/80抗体,4℃避光染色30 min,PBS洗1遍,1 500 r/min离心5 min,弃上清,加入Fixation/Permeabilization固定/破膜液500 μl,4℃固定15 min,加入3 ml Perm/Wash液洗1遍,1 500 r/min离心5 min弃上清,以Perm/Wash液重悬细胞,加入PE标记iNOS抗体,4℃避光染色30 min,PBS洗1遍,1 500 r/min离心5 min弃上清,用200 μl PBS重悬后用流式细胞仪检测。
1.2.4CCK8法检测IL-22对细胞活性的影响 骨髓来源巨噬细胞悬液(1×104个/ml)接种至96孔板(100 μl/孔),用不同浓度IL-22处理细胞36 h后,每孔加CCK8试剂10 μl,37℃温育2 h,酶标仪测定450 nm处的OD值,按以下公式计算细胞增殖率:细胞增殖率(%)=[A(加药)-A(空白)]/[A(未加药)-A(空白)]×100%。
1.2.5ELISA检测巨噬细胞上清液IL1-β、TNF-α的分泌水平 收集巨噬细胞培养上清液,检测IL1-β、TNF-α的分泌。按照试剂盒说明操作,加入配好的标准品和样品,37℃温育2 h,倒掉液体,加生物素标记抗体混匀,37℃温育1 h,洗3次,加辣根过氧化物酶标记的亲和素工作液,37℃温育1 h,洗5次,加TMB底物,37℃温育15~30 min,加终止液终止反应,5 min内读板,450 nm波长检测吸光度。
1.2.6RT-PCR检测巨噬细胞iNOS、IL-1β、TNF-α的mRNA表达水平 按总RNA提取试剂盒说明书提取细胞总RNA。按照HiScript®Ⅱ One Step RT-PCR Kit说明书进行实时荧光定量RT-PCR检测。扩增条件:逆转录95℃ 3 min(1个循环),预变性95℃ 5min(1个循环),95℃ 10 s 、60℃ 30 s (40个循环)。以GAPDH为内参照基因,采用2-ΔΔCt计算iNOS、IL-1β、TNF-α的mRNA相对表达量,引物序列见表1。

表1 目的基因引物序列Tab.1 Primers for target gene
1.3统计学处理 采用SPSS22.0软件对数据进行统计分析,两组间均数差异比较采用t检验,多组间比较采用单因素方差分析(One-way ANOVA),组间两两比较采用LSD法;P<0.05表示差异有统计学意义。
2 结果
2.1骨髓来源巨噬细胞的形态观察 M0型巨噬细胞形态较圆,高亮,部分不规则形,伪足较少,见图1A;M1型巨噬细胞体积略增大,胞质有空泡,颜色变深,伪足增多,呈煎蛋样,见图1B。
2.2骨髓来源巨噬细胞的吞噬功能 通过荧光显微镜观察骨髓来源巨噬细胞吞噬率达99%(吞噬率%=吞噬乳胶微球细胞数/细胞总数),说明诱导的骨髓巨噬细胞具备正常的吞噬功能,见图2。
2.3不同浓度IL-22对骨髓来源巨噬细胞活力的影响 分别以2.5、5、10、20、40、80、160 ng/ml浓度的IL-22干预骨髓来源巨噬细胞36 h后,计算半抑制浓度值(IC50),结果显示IL-22对骨髓来源巨噬细胞的IC50为88.1 ng/ml,因此本实验选择IL-22的作用浓度为20 ng/ml,处于安全药物浓度范围内,见图3。
2.4IL-22可抑制M1型巨噬细胞标志物的表达 经过7 d的诱导,CD11b+F4/80+细胞的比例为(99.3±0.4)%,成功获得高纯度的成熟M0型巨噬细胞,见图4A。用LPS(1 μg/ml)刺激M0型巨噬细胞24 h,检测M1型巨噬细胞标记物CD11b+F4/80+iNOS+,实验结果显示CD11b+F4/80+iNOS+细胞的比例为(85.9±4.1)%,成功获得M1型巨噬细胞。IL-22(20 ng/ml)干预M1型巨噬细胞36 h后,分别检测LPS组、LPS+IL-22组M1型巨噬细胞标记物,结果显示,LPS+IL-22组CD11b+F4/80+iNOS+细胞的比例为(68.8.9±2.6)%,低于LPS组(P<0.01),差异具有统计学意义,见图4B。
2.5IL-22可抑制M1型巨噬细胞IL-1β、TNF-α的分泌 IL-22干预M1型巨噬细胞36 h后,分别检测两组M1型巨噬细胞IL-1β、TNF-α分泌水平,结果显示,与LPS组相比,LPS+IL-22组促炎细胞因子IL-1β[(431±47)vs(296±55)pg/ml,t=3.214,P=0.032]和TNF-α[(629±74)vs(274±24)pg/ml,t=7.896,P=0.001]分泌水平均降低,差异具有统计学意义,见图5。
2.6IL-22可抑制M1型巨噬细胞iNOS、IL-1β、TNF-α的mRNA表达 IL-22不同时间(12、24和36 h)干预M1型巨噬细胞,分别检测M1型巨噬细胞相关炎症因子iNOS、IL-1β、TNF-α的mRNA表达水平,结果显示,与LPS组相比,LPS+IL-22组的促炎细胞因子iNOS、IL-1β、TNF-α的mRNA表达均有不同水平地降低,其中,TNF-α mRNA表达水平随着IL-22干预时间延长而下降(P<0.01);IL-1β和iNOS的24 h和36 h组mRNA表达水平降低(P<0.05);差异均具有统计学意义, 而iNOS 12 h组mRNA表达水平升高(P>0.05),差异无统计学意义。实验结果证实IL-22可抑制巨噬细胞相关炎症因子的分泌,抑制炎性反应,见图6。
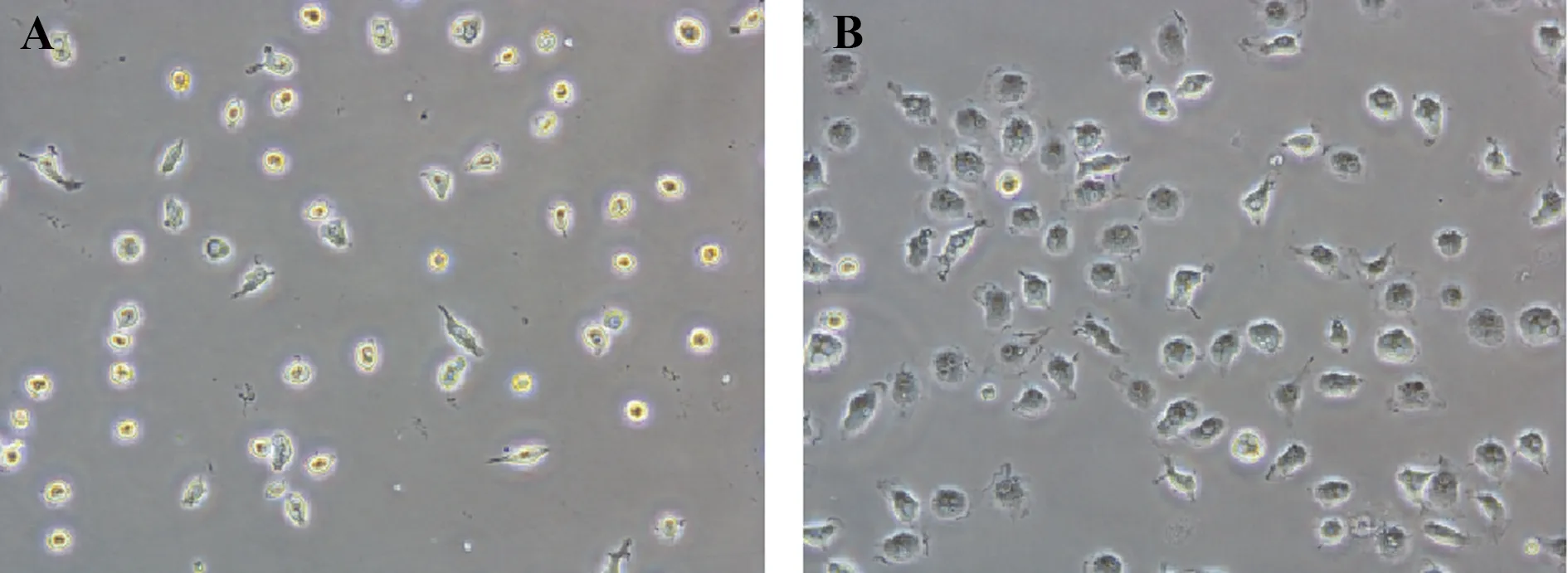
图1 骨髓来源巨噬细胞形态(×200)Fig.1 Morphology of bone marrow-derived macrophagesNote: A.M0 macrophages;B.M1 macrophages(×200).

图2 骨髓来源巨噬细胞吞噬乳胶微球(×200)Fig.2 Phagocytosis of latex beads by bone marrow-derived macrophages(×200)

图3 不同浓度IL-22对骨髓来源巨噬细胞活力的影响Fig.3 Effects of different concentrations of IL-22 on viability of bone marrow-derived macrophages

图4 骨髓来源巨噬细胞的流式细胞术分析Fig.4 Flow cytometry analysis of bone marrow-deriv-ed macrophagesNote: A.Bone marrow-derived macrophages were first gated on FSC and SSC to remove debris and conjugates,mature M0 macrophages were defined as CD11b+F4/80+ subpopulations;B.M0 macropha-ges were induced by LPS for 24 h,and then treated with IL-22 for 36 h,M1 macrophages were defined as CD11b+F4/80+iNOS+ subpopulations;Compared with LPS group,**.P<0.01.

图5 IL-22干预36 h对M1型巨噬细胞的IL-1β、TNF-α分泌水平的影响Fig.5 Effects of IL-22 on secretion of IL-1β and TNF-α in M1 macrophages after 36 h interventionNote: Compared with LPS group,*.P<0.05,**.P<0.01.
3 讨论
肝纤维化是一种肝内弥漫性细胞外基质过度沉积的病理过程[8]。肝纤维化的形成过程中,炎性反应发挥关键性作用。枯否细胞是位于肝窦内的巨噬细胞,与其它炎症细胞如浸润性巨噬细胞、T淋巴细胞、嗜中性粒细胞和树突状细胞都会导致肝脏炎症,炎症细胞激活HSC,进而导致肝纤维化[9,10]。在本研究中,从股骨分离得到的骨髓干细胞经过M-CSF7 d的分化培养,CD11b+F4/80+细胞的比例非常高,与Ying等[11]的结果一致。本研究还通过吞噬乳胶微球实验证实了M-CSF诱导的巨噬细胞具备正常的吞噬功能。巨噬细胞分为促炎型(M1)和抗炎型(M2)。由IFN-γ和LPS诱导并表达促炎症细胞因子如TNF-α、IL-6和IL-1β的M1型巨噬细胞参与肝纤维化的发病机制。M2型巨噬细胞由IL-4、IL-10和IL-13诱导并可分泌细胞因子IL-10、TGF-β、PDGF和EGF,M2型巨噬细胞具有抗炎作用,促进伤口愈合[12]。本研究用LPS刺激骨髓来源巨噬细胞后,得到高比例的CD11b+F4/80+iNOS+细胞,该细胞高度表达相关促炎因子iNOS、IL-1β、TNF-α的mRNA,同时IL-1β和TNF-α的分泌量增多,呈典型的M1型巨噬细胞炎症模型。

图6 IL-22不同的干预时间对M1型巨噬细胞的iNOS、IL-1β和TNF-α mRNA表达的影响Fig.6 Effects of different intervention time on expression of iNOS,IL-1β and TNF-α mRNA in M1 macrophagesNote: Compared with LPS group,*.P<0.05,**.P<0.01.
IL-22在调节炎性疾病相关的炎性反应中具有重要作用[13],在控制细菌感染、调节内稳态和对抗组织损伤等方面均具有重要作用[14]。在肝脏体内和体外的研究中,IL-22通过STAT3对酒精性肝损伤起保护作用,参与肝切除术后肝增殖再生,在急性肝脏炎症期间为肝细胞提供保护[5,15,16]。研究发现,IL-22与HSC上的IL-22R1受体结合后够诱导HSC的衰老,加速肝纤维化溶解,减轻纤维化程度;而STAT3、SOCS3、P53和Notch信号通路的激活可能是IL-22诱导HSC的凋亡、抑制肝纤维化进展的主要机制[6]。但在肝脏研究中,对IL-22与巨噬细胞炎症关系的研究少有报道。在本研究中,用IL-22干预M1型巨噬细胞,发现IL-22可不同水平抑制M1型巨噬细胞相关促炎因子iNOS、IL-1β和TNF-α的mRNA表达,而且抑制作用随着时间而递增,IL-22减少M1型巨噬细胞的比例,降低细胞TNF-α、IL-1β的上清分泌水平。这一结果表明,IL-22可以作用于巨噬细胞,减少其炎性反应。Luo等[17]的研究提示,肝纤维化组织中M1比M2型巨噬细胞数量多,IL-22可促进M0型巨噬细胞向M2型巨噬细胞分化,并上调STAT3表达水平,推测IL-22可能经STAT3通路调控巨噬细胞来抑制肝纤维化发生发展。结合本研究猜想,IL-22可能通过STAT3通路减少M1型巨噬细胞比例,促进M2型巨噬细胞的分化,从而减轻炎症和发挥抗炎修复作用。
综上所述,经LPS刺激的骨髓来源巨噬细胞,细胞炎症水平增高,IL-22可抑制其促炎症因子的表达,减少M1型巨噬细胞比例,发挥抑炎作用。
