人甲母质细胞无血清原代培养方法的建立
2019-06-24陈朝丰于波吕超刘晓云胡小平
陈朝丰 于波 吕超 刘晓云 胡小平
北京大学深圳医院皮肤科,深圳 518036
指(趾)甲是由外胚层分化而来的皮肤附属结构,对肢端具有保护、可协调完成精细动作等作用[1]。在胚胎第20周,甲单位发育完成[2]。甲板外观主要受甲母质细胞的特殊分化功能决定。目前关于甲器官的研究已取得一定的进展。如甲干细胞的识别[3]、甲器官分化和内稳态相关信号通路的研究[4]、甲干细胞再生潜能的探索[5]等,但这些研究基本局限于组织水平或动物实验阶段。因此,建立起人甲母质细胞无血清原代培养方法,有利于多种甲病机制的研究及治疗方法的探究。
材料与方法
一、标本来源
人甲母质组织选自北京大学深圳医院2016年1-12月就诊的9 例多指(趾)畸形、要求行指(趾)切除的患者或甲沟炎要求行甲床修整术的患者,所有行甲床修整术的患者均为择期手术,外用及系统服用抗生素治疗甲沟炎,在炎症消除后再进行手术。本研究通过北京大学深圳医院医学伦理委员会批准(批准号2016025),所有患者均签署知情同意书。
二、主要试剂及仪器
胎牛血清白蛋白、DEME 培养基、磷酸盐缓冲液(PBS)干粉、2.5%胰蛋白酶(美国Thermo 公司),无血清的角质形成细胞生长培养基(CnT-07,瑞士CELLnTEC公司),鼠抗人细胞角蛋白10(K10)单克隆抗体、兔抗人细胞K5单克隆抗体(英国Abcam公司),FITC488 标记山羊抗大鼠 IgG 二抗、DyLight 649 标记山羊抗兔IgG 二抗(上海英骏生物技术有限公司),FITC 标记的鼠抗人K10抗体(英国Novus公司),Triton X-100(德国Sigma公司),流式细胞仪(美国Beckman公司)。
三、甲母质细胞原代培养及传代
将手术中获得的指(趾)组织拔除甲板,尽量去除甲母质区的表皮及皮下组织,用手术刀切下远离甲床部位的甲母质组织,放入含有生理NaCl 溶液的无菌标本瓶中,剩余的废弃组织由手术室统一处理。取甲母质组织块用75%乙醇浸泡5 min,PBS冲洗5次,将甲母质组织分成约2 mm3的组织块,放置在60 mm 一次性培养皿中,每块组织块间隔2 cm,用无菌移液枪头轻压组织块,使其与塑料培养皿充分接触5 min。待组织块与皿底充分粘合后,加入2 ml 无血清DEME/F-12 培养基,浸没组织块。培养皿放置在37 ℃、5%CO2的饱和湿度培养箱中培养2~3 d,观察组织块边缘的细胞增长情况,培养5~7 d后换用无血清的角质形成细胞生长(CnT-07)培养基,2~3 d换液1次。原代单层细胞增长达60%~70%时,用含0.25%胰蛋白酶、0.03%EDTA 的PBS 消化,制备单细胞悬液用于传代培养。培养过程中采用倒置显微观察细胞形态。单细胞悬液的最终密度为5×106/ml~1×107/ml时用于后续实验,剩余细胞与含10%二甲基亚砜的胎牛血清冻存培养液1∶1 混合,分装在冻存管中,每管1.5 ml,置于-80 ℃冰箱中保存。
四、免疫荧光观察细胞角蛋白的表达情况
将单细胞悬液均匀接种到放置有15 mm 盖玻片的12 孔细胞培养板中,培养48 h,待细胞密度达到60%~70%去除培养液,PBS浸洗3次。用4%甲醛溶液固定15 min,PBS浸洗3次,用0.5%Triton X-100(PBS 配制)室温通透20 min,PBS 浸洗3 次,滴加1%牛血清白蛋白(BSA),37 ℃封闭30 min,加入K10 抗体和K5 抗体,放入湿盒于4 ℃孵育过夜。加入荧光二抗(FITC488标记山羊抗大鼠IgG二抗、DyLight649标记山羊抗兔IgG二抗,1∶100),室温湿盒中孵育2 h;滴加4,6二氨基-2-2苯基吲哚(4,6-diamino-2-phenyl indole,DAPI)对细胞进行核染,避光孵育5 min;PBS 浸洗玻片3 次,加入含抗荧光猝灭剂的封片液,中性树胶封片,在荧光倒置显微镜下采集图像及判定结果。
五、流式细胞仪检测甲母质细胞的纯度
取 1 × 106/ml 的单细胞悬液,1 000 r/min 离心5 min(离心半径15 cm),去除上清液,加入50 μl 1%的鼠抗人K10单克隆抗体混匀,4 ℃孵育30 min,PBS 清洗细胞,1 000 r/min 离心 5 min(离心半径15 cm),弃上清液,加入50 μl 1%的FITC488 标记山羊抗大鼠IgG 二抗混匀,4 ℃避光孵育30 min,PBS清洗细胞后,用细胞滤膜过滤2次,上机检测。
结 果
一、原代培养甲母质细胞时细胞的生长情况
甲母质组织块种植2~3 d后,有少量细胞从组织块边缘爬出,细胞形态小而圆或呈长梭形;第5~6 天,细胞继续增殖,局部形成小的细胞团块;第8天时,最外缘细胞距离甲母质细胞的距离不断增大;第10天时,在甲母质组织块周边形成了较大的细胞团块,部分细胞形态为上皮样细胞,呈铺路石样排列,细胞间紧密连接,也有部分细胞呈扁平状,形态为纺锤形或星形。见图1。培养2~3 周后,细胞生长到培养瓶底的70%~80%,呈单层生长。培养第20天时,大部分细胞呈铺路石样排列,也可见少量细胞呈纺锤形或星形,细胞的体积较大,大部分细胞的大小可达50~ 100 μm(图2)。当生长到培养瓶底的70%~80%,细胞密度达1 ×106~1×107/L时即可传代。
二、原代甲母质细胞角蛋白表达情况
倒置荧光显微镜下显示,K5、K10 均表达于细胞质中,K10 为绿色荧光,K5 为红色荧光,K10 与K5 共染时为黄色荧光。亦有部分细胞未见K5、K10。见图3。
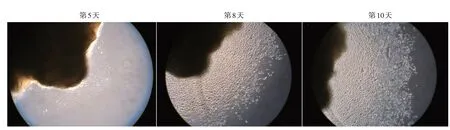
图1 甲母质细胞原代甲培养第5、8、10天时显微镜下的细胞形态(×100) 甲母质组织(不规则阴影部分)边缘的细胞团块随时间不断增大,部分细胞呈铺路石样外观,部分呈纺锤形及星形

图2 共聚焦显微镜下原代甲母质细胞的基本形态 少量细胞呈纺锤形或星形,细胞的体积较大,大部分细胞的大小可达50~100 μm。图中比例尺单位为200 μm

图3 荧光显微镜下原代甲母质细胞角蛋白5(K5)、K10表达情况 K10为绿色荧光,K5为红色荧光,K10与K5共染时为黄色荧光,亦有部分细胞未表达K5、K10
三、流式细胞仪观察原代甲母质细胞中K10的表达情况
流式细胞仪可检测到以K10 为标记的阳性甲母质细胞的存在,甲母质细胞的比例约37.6%。见图4。
讨 论
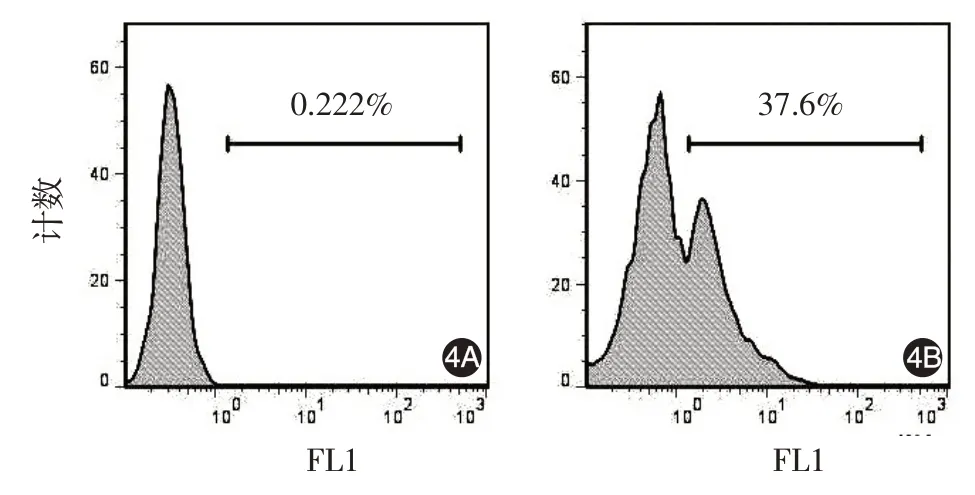
图4 流式细胞仪检测以角蛋白10(K10)为标记的甲母质细胞比例 4A:以生理NaCl 溶液代替FITC488 标记山羊抗大鼠IgG二抗作对照;4B:K10阳性的甲母质细胞的比例约37.6%
甲母质是甲器官的主要组成部分[6],可分化形成完全角质化的甲板[7],近端甲母质参与甲板表层的形成,而远端甲母质主要生成甲板深层,中间区域的甲母质生成了甲板的中间层[8]。当甲母质细胞受干扰时,病变可在甲板上表现出来。建立甲母质细胞的体外培养方法,有利难治疗性甲病的研究及临床治疗。
目前,国内外关于甲母质细胞原代细胞的报道甚少,本实验采用无血清培养基,可避免血清培养基能为细胞提供生长所需的生长因子、激素及营养物质等,但血清培养基的生产存在差异,不能保证批次间的差异,难以保证实验条件的标准化,无血清培养基能尽可能地减少以上干扰因素的影响,使细胞的性能更加一致,功能的评估更加精确,提高了实验结果的重复性。本研究选用无血清CnT-07作为培养基,细胞生长活性高,贴壁状态好。因此,认为该培养基可用于甲母质细胞体外培养。
角蛋白可分为软角蛋白和硬角蛋白,硬角蛋白是组成毛发及甲的主要结构[9]。根据凝胶双向电泳和分子量的差异,将软角蛋白分为酸性(Ⅰ型)角蛋白和碱性(Ⅱ型)角蛋白[10]。特定的酸性角蛋白和碱性角蛋白是等量配对分布的,K5、K14 是配对分布的[11],主要在复层鳞状上皮基底层和毛囊基质的角质形成细胞里表达[3],K1 和 K10 也是配对分布,主要存在于正常皮肤的基底层中,与角质形成细胞的角化相关[2]。角蛋白的表达表现出了在组织、部位和时空上的特异性[12]。既往研究发现,K1、K10 可在甲母质组织中表达,在甲床中未被检测到[13-14],K10 可做为甲母质细胞的标记物,K1、K10、K5、K14 可在甲母质细胞、正常皮肤及甲下皮中表达,而在甲床中不表达,K5、K10同时表达阳性的细胞只有甲母质、皮肤及甲下皮[13,15]。本研究中,我们在甲母质取材过程时选取了远离皮肤及甲下皮的甲母质组织进行培养,可排除甲下皮及皮肤细胞污染甲母质细胞,培养后细胞中K5、K10 阳性反应几乎是重叠的,可确定为甲母质细胞。
本研究采用组织块培养法,将甲母质细胞直接从组织中分离,传代数少,可最大限度保持人甲母质细胞特有的生物学特性。但因组织块组成复杂,少量成纤维细胞即可导致杂质细胞的出现。成纤维细胞在培养过程中易生长且生长速度快,结果中有部分细胞不表达K5、K10,采用K10对细胞标记,分析人原代甲母质细胞的纯度约37.6%。推测这部分杂质细胞主要为成纤维细胞。
本研究通过探索人原代甲母质细胞的培养,为进一步实验提供了基础及条件。虽然培养所得的人原代甲母质细胞仍有其他杂质细胞,在后续研究中可采用流式细胞仪分选和免疫磁珠分选法纯化细胞。本研究建立的人甲母质细胞原代培养的方法,可用于进一步了解人原代甲母质细胞的生物特性,并从细胞水平了解甲母质细胞受外界因素干扰下产生的不同反应,探索甲母质细胞生长及调控机制异常出现的生理生化反应,以期为阐明临床难治性甲病的发病机制及临床治疗提供理论基础。
利益冲突所有作者均声明不存在利益冲突
