干扰素γ和TRAIL联合对HaCaT细胞程序性坏死的影响及机制研究
2019-06-24寿艳红张臻骆肖群陈圣安李峰朱小华林尽染秦海红杜鹃陈荪奕杨永生徐金华
寿艳红 张臻 骆肖群 陈圣安 李峰 朱小华 林尽染 秦海红 杜鹃 陈荪奕 杨永生 徐金华
复旦大学附属华山医院皮肤科,上海 200040
程序性坏死是一种可调控的胱天蛋白酶(caspase)非依赖性细胞程序性死亡方式,细胞呈坏死样结构特点[1]。以往研究证实,肿瘤坏死因子α(TNF-α)诱导的程序性坏死可发生在小鼠成纤维细胞L929、人组织淋巴瘤细胞U937 和Fas 相关死亡域蛋白缺陷型人白血病T 细胞系Jurkat 细胞中[2-4],干扰素γ(IFN-γ)和TNF 相关凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)可分别诱导巨噬细胞和小鼠胚胎成纤维细胞程序性坏死[2,5]。较为公认的机制是受体相互作用蛋白1(receptor interaction protein kinase 1,RIP1)/RIP3/混合系激酶区域样蛋白(mixed lineage kinase domainlike protein,MLKL)通路传递死亡信号,活性氧参与死亡执行[6-7]。关于角质形成细胞(keratinocyte,KC)的程序性坏死研究较少,主要集中于中毒性表皮坏死松解症(TEN)和Stevens-Johnson 综合征(SJS)的发病机制研究[8-9]。TEN/SJS 是以 KC 广泛性坏死为特征的疾病,Saito等[9]用电镜发现TEN患者中KC 发生的坏死是程序性坏死,小鼠实验中通过抑制程序性坏死可以完全阻断TEN 样病变也证明了这一点。此外,以往研究证实,IFN-γ 在TEN患者疱液和外周血中浓度升高[7,10]。de Araujo等[11]还发现,疱液中TRAIL浓度有明显升高。由此我们推测,IFN-γ 和 TRAIL 是 SJS/TEN 发病中重要的细胞因子,因此我们探索应用IFN-γ 和TRAIL 诱导KC 程序性坏死,探讨程序性坏死在TEN/SJS 发病机制及治疗中的作用。
材料与方法
一、细胞、试剂和仪器
HaCaT 细胞来自美国ATCC 细胞库;高糖DMEM、胎牛血清、0.25%胰酶产自美国Gibco公司;细胞凋亡检测试剂盒产自美国BD 公司;反转录试剂盒、实时荧光定量PCR 试剂盒产自日本TaKaRa公司;RIP3、MLKL 引物由生工生物工程(上海)股份有限公司合成;兔抗人RIP1、RIP3、MLKL和磷酸化 RIP1(pRIP1)、RIP3(pRIP3)、MLKL(pMLKL)抗体产自美国 CST 公司;IFN-γ、TRAIL 产自美国PeproTech 公司。活性氧检测试剂盒、辣根过氧化物酶标记的山羊抗兔IgG、Alexa Fluor 488标记的山羊抗兔IgG、Alexa Fluor 555标记的山羊抗兔IgG产自上海碧云天生物技术公司。
二、细胞培养
将HaCaT细胞接种于含1%青链霉素和10%胎牛血清的高糖DMEM,37 ℃、5% CO2培养箱中培养,取对数生长期细胞用于各项实验。
三、噻唑蓝(MTT)法检测细胞增殖
取对数生长期HaCaT 细胞按1×104/孔接种于96孔板,在37 ℃及5%CO2环境中培养24 h,去上清液,分别加入12.5、25、50、100 μg/L IFN-γ或1、2、4、8 μg/L TRAIL,或同时加入不同浓度的 IFN-γ 和TRAIL,对照组不加IFN-γ和TRAIL,空白孔不加细胞,只加培养基,每种处理设5 个复孔,培养48 h后,每孔加入10 μl MTT溶液,在37 ℃、5%C02环境中孵育4 h,弃上清液,加入二甲基亚砜溶液110 μl,置摇床上充分振荡10 min,在酶标仪490 nm波长下测量各孔吸光度(A值)。细胞存活率=[各处理组平均A490 值-空白组平均A490 值)/(对照组平均A490 值-空白组平均A490 值)]×100%。预实验发现,50、100 μg/L IFN-γ或4、8 μg/L TRAIL均可抑制细胞生长,但 50 μg/L IFN-γ 和 4 μg/L TRAIL 及更高浓度IFN-γ、TRAIL 同时作用可显著抑制细胞存活,因此选择 50 μg/L IFN-γ、4 μg/L TRAIL 进行后续实验。此外,为了确定caspase 抑制剂zVAD(美国Pepro Tech 公司)作用时间及浓度,分别加入10、20、40、60、80 μmo/L zVAD 预处理0.5、1、1.5 h,再加入 50 μg/L IFN-γ 和 4 μg/L TRAIL 处理48 h 后检测各孔A值,发现 ≥ 40 μmo/L zVAD 预处理 1、1.5 h 均可显著抑制细胞存活,因此选择40 μmo/L zVAD预处理1 h作为实验条件。
四、实验分组
取对数生长期HaCaT 细胞按1 × 106/孔接种于6 孔板,预培养24 h;去上清液,阴性对照组不加IFN-γ 或TRAIL,处理组分别加入50 μg/L IFN-γ(IFN-γ 组)、4 μg/L TRAIL(TRAIL 组)、50 μg/L IFN-γ +4 μg/L TRAIL(细胞因子联合组)或40 μmol/L zVAD预处理1 h后同时加入50 μg/L IFN-γ及4 μg/L TRAIL(zVAD 联合组),作用48 h,光镜下观察细胞形态后用于以下实验。
五、流式细胞仪检测细胞坏死
收集细胞,用含有乙二胺四乙酸(EDTA)的胰酶溶液消化,移至流式检测管,PBS洗涤2次,1×结合缓冲液洗涤1次,重悬细胞,加入5 μl膜联蛋白V混匀后,加入5 μl碘化丙锭,混匀,室温下避光孵育15 min;每管加入400 μ1结合缓冲液,混匀,流式细胞仪检测细胞坏死率。
六、qPCR检测RIP3、MLKL mRNA相对表达量
收集细胞提取RNA,使用反转录试剂盒合成cDNA,进行定量PCR。应用Primer5.0设计引物,引物由生工生物工程(上海)股份有限公司合成。RIP3 正向引物 5′-TGTACAAGTCTAGAGCTAGCAT GTCGTGCGTCAAGTTA-3′,反向引物5′-CGCGGCC GCGGATCCTTATTTCCCGCTATGATT-3′;MLKL:正向引物5′-GGATTGCCCTGAGTTGTTGC-3′,反向引物 5′-AACCGCAGACAGTCTCTCCA-3′;GADPH 正向引物5′-GAAGGTGAAGGTCGGAGTC-3′,反向引物 5′-GAAGATGGTGATGGGATTTC-3′。PCR 反应体系20 μl,分别为绿色荧光染料 SYBR 10 μl,正反向引物各 0.04 μl,参比染料 ROX 0.4 μl,cDNA 2 μl,ddH2O 7.52 μl,反应条件为95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火延伸30 s,共40个循环。反应结束后,确认各个基因的阈值循环数(Ct),利用GAPDH 校正。△△Ct =(实验组 Ct目的基因-Ct管家基因)-(阴性对照组Ct目的基因- Ct管家基因),计算RIP3、MLKL基因的相对表达水平(2-△△Ct)。
七、Western印迹检测RIP1、pRIP1、RIP3、pRIP3、MLKL、pMLKL、caspase 8蛋白水平
收集阴性对照组、IFN-γ组、TRAIL组、细胞因子联合组细胞,向HaCaT 细胞中加入裂解液,冰上裂解5 min 后,将细胞刮下做超声处理,4 ℃12 000×g离心15 min,吸取上清液分装并保存。用BCA法测定蛋白浓度,以20 μg 蛋白样品上样,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,聚偏氟乙烯(PVDF)转膜,5%牛血清白蛋白(BSA)室温封闭1 h,加入兔抗人RIP1、pRIP1、RIP3、pRIP3、MLKL、pMLKL 蛋白抗体,4 ℃孵育过夜后,加辣根过氧化物酶标记的山羊抗兔IgG室温孵育1 h,ECL发光法检测反应条带。以GAPDH 为内参,用ImageJ 软件分析条带灰度。
另取zVAD 联合组、阴性对照组、细胞因子联合组细胞重复上述步骤,检测各组上述各蛋白表达水平。
八、免疫荧光染色观察pRIP3、pMLKL 在细胞中的表达分布
HaCaT细胞爬片,预培养24 h后,去上清液,分为阴性对照组、IFN-γ组、TRAIL组和细胞因子联合组,处理同以上实验分组,作用48 h 后,4%多聚甲醛固定15 min,0.2%Triton X-100破膜15 min,5%牛血清白蛋白封闭30 min,加兔抗人pRIP3(1∶500)、兔抗人 pMLKL(1∶500)一抗,4 ℃孵育过夜;加Alexa Fluor 488 标记的山羊抗兔 IgG(1∶200)、Alexa Fluor 555标记的山羊抗兔IgG(1∶200)避光室温下孵育1 h,4′,6-二脒基-2-苯基吲哚(4′,6-imidino-2-henylndoleDAPI)染核5 min,每步骤间均PBS漂洗3次,50%甘油封片,荧光显微镜下观察。
九、以2′,7′-二氯荧光素二乙酸酯(DCFH-DA)为荧光探针检测HaCaT细胞内活性氧
用无血清培养液稀释DCFH-DA,使其终浓度为10 μmol/L。将HaCaT细胞接种在24孔板中预培养24 h 后,去上清液,加入适当体积稀释好的DCFH-DA,37 ℃孵育20 min。用无血清培养液洗涤细胞3 次,将细胞分为阴性对照组、IFN-γ 组、TRAIL组和细胞因子联合组,处理方法同以上实验分组,刺激1.5 h,收集细胞用流式细胞仪检测活性氧水平。
十、统计分析
用SPSS 22 进行统计学分析。实验重复3 次,数据均以±s表示,不同组间观察指标的比较采用单因素方差分析,两两多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
结 果
一、不同处理对HaCaT细胞形态的影响
光镜下观察发现,阴性对照组HaCaT细胞形态无变化,细胞生长密集,呈上皮样贴壁生长。不同细胞因子作用48 h 后,细胞形态均发生变化。IFN-γ组、TRAIL 组细胞数减少;细胞因子联合组、zVAD联合组细胞数减少,出现坏死样形态特征,如细胞膜破裂、细胞器肿胀、核皱缩等。
二、不同处理对HaCaT细胞存活率的影响
作用48 h后,阴性对照组HaCaT细胞存活率为100%,但 IFN-γ 组、TRAIL 组、细胞因子联合组、zVAD 联合组分别为 73.16% ± 5.71%、81.46% ±4.68%、72.18%±2.93%、69.67%±3.24%,单因素方差分析显示,差异有统计学意义,F= 24.34,P<0.001。两两多重比较显示,IFN-γ 组、细胞因子联合组、zVAD 联合组HaCaT 细胞存活率显著低于阴性对照组,差异均有统计学意义(t值分别为26.83、27.82、30.32,均P< 0.05),细胞因子联合组与zVAD联合组间差异无统计学意义,t=2.51,P>0.05。
三、不同处理对HaCaT细胞坏死的影响
IFN-γ组、TRAIL组、细胞因子联合组、zVAD联合组HaCaT 细胞坏死率分别为6.42% ± 1.36%、6.35% ± 1.91%、9.86% ± 1.31%、10.33% ± 2.16% ,阴性对照组为5.26%±0.91%,5组间差异有统计学意义,F=6.17,P< 0.01(图1)。细胞因子联合组、zVAD 联合组均显著高于阴性对照组,t值分别为4.61、5.07,均P< 0.05,细胞因子联合组与zVAD 联合组间差异无统计学意义(t=0.47,P> 0.05)。
四、不同处理对HaCaT 细胞RIP3、MLKL mRNA表达的影响
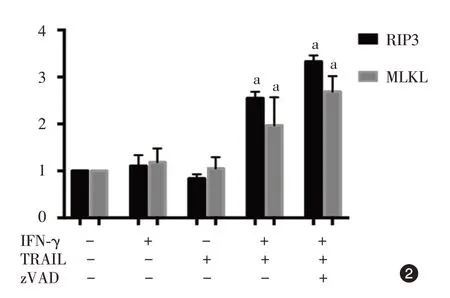
图2 IFN-γ、TRAIL、zVAD 单独或联合作用 48 h 后 HaCaT 细胞RIP3、MLKL mRNA 表达情况 n=3。a:与阴性对照组比较,差异有统计学意义(P < 0.05)。IFN-γ:干扰素γ;TRAIL:肿瘤坏死因子相关凋亡诱导配体;zVAD:胱天蛋白酶抑制剂;RIP3:受体相互作用蛋白3;MLKL:混合系激酶区域样蛋白

图3 干扰素γ、TRAIL 单独或联合作用48 h 后HaCaT 细胞RIP1、pRIP1、RIP3、pRIP3、MLKL、pMLKL 蛋白表达情况 TRAIL:肿瘤坏死因子相关凋亡诱导配体;RIP:受体相互作用蛋白;MLKL:混合系激酶区域样蛋白
作用 HaCaT 细胞 48 h 后,IFN-γ 组、TRAIL 组、细胞因子联合组、zVAD 联合组及阴性对照组间RIP3、MLKL mRNA水平差异均有统计学意义(F值分别为9.16、28.49,均P< 0.05,图2)。两两多重比较显示,细胞因子联合组、zVAD 联合组RIP3 mRNA 水平明显高于阴性对照组(t值分别为0.99、1.84),MLKL mRNA亦高于阴性对照组(t值分别为1.51、2.17),均P< 0.05,细胞因子联合组与zVAD联合组间RIP3、MLKL mRNA水平差异无统计学意义(t值分别为0.84、0.65,均P> 0.05)。
五、不同处理对HaCaT细胞程序性坏死相关蛋白等表达的影响
作用 48 h 后,IFN-γ 组、TRAIL 组 RIP1、RIP3、MLKL 蛋白表达水平与阴性对照组相比无明显变化,但细胞因子联合组RIP1、RIP3、MLKL、pRIP1、pRIP3、pMLKL 蛋白表达水平高于阴性对照组(图3,表1,均P< 0.05)。zVAD 联合组与细胞因子联合组相比,caspase 8 表达降低,RIP1、RIP3、MLKL、pRIP1、pRIP3、pMLKL 蛋白表达水平升高(图4,表2,均P< 0.05)。

图4 干扰素γ与TRAIL联合及共同与zVAD联合对HaCaT细胞pRIP1、RIP1、胱天蛋白酶8、pRIP3、RIP3、pMLKL、MLKL 蛋白表达的影响 TRAIL:TNF 相关凋亡诱导配体;zVAD:胱天蛋白酶抑制剂;RIP:受体相互作用蛋白;MLKL:混合系激酶区域样蛋白
表1 干扰素γ、TRAIL单独或联合作用对HaCaT细胞RIP1、RIP3、MLKL蛋白及其磷酸化蛋白表达的影响(±s)
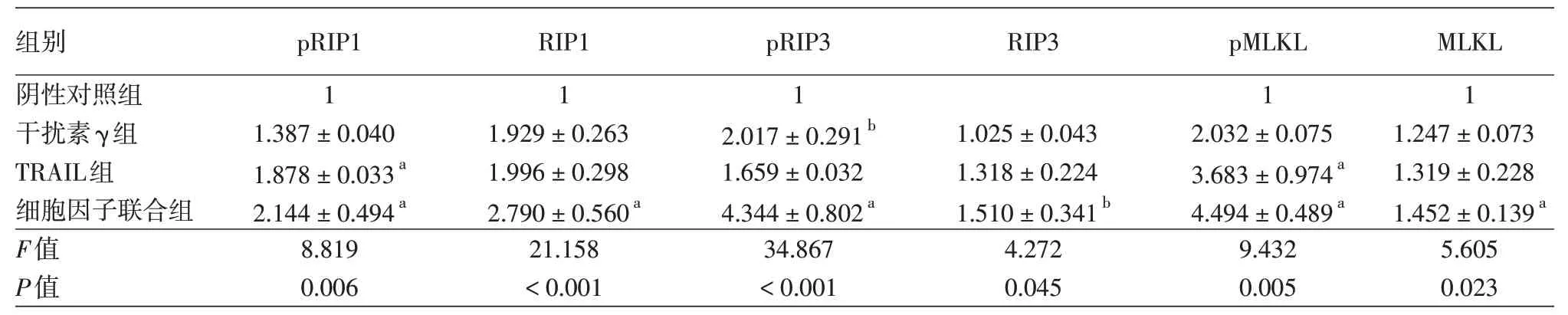
表1 干扰素γ、TRAIL单独或联合作用对HaCaT细胞RIP1、RIP3、MLKL蛋白及其磷酸化蛋白表达的影响(±s)
注:n=3。与阴性对照组(不用干扰素γ、TRAIL或zVAD处理)比较,a P < 0.01,b P < 0.05。TRAIL:TNF相关凋亡诱导配体;RIP:受体相互作用蛋白;MLKL:混合系激酶区域样蛋白
组别阴性对照组干扰素γ组TRAIL组细胞因子联合组F值P值pRIP1 1 1.387±0.040 1.878±0.033a 2.144±0.494a 8.819 0.006 RIP1 1 1.929±0.263 1.996±0.298 2.790±0.560a 21.158<0.001 pRIP3 1 2.017±0.291b 1.659±0.032 4.344±0.802a 34.867<0.001 RIP3 1.025±0.043 1.318±0.224 1.510±0.341b 4.272 0.045 pMLKL 1 2.032±0.075 3.683±0.974a 4.494±0.489a 9.432 0.005 MLKL 1 1.247±0.073 1.319±0.228 1.452±0.139a 5.605 0.023
六、pRIP3、pMLKL在细胞中的表达及分布
1.pRIP3 在细胞中的表达及分布:HaCaT 细胞经细胞因子联合作用48 h 后细胞质可见强绿色点状或团块状绿色荧光斑点,IFN-γ组、TRAIL组作用48 h后细胞质可见浅绿色荧光斑点,阴性对照组细胞未见明显的绿色荧光斑点,见图5。
2.pMLKL 在细胞中的表达及分布:经细胞因子联合作用48 h后,HaCaT细胞膜可见明显红色荧光斑点,IFN-γ组、TRAIL组细胞膜仅见浅红色荧光斑点,阴性对照组细胞未见明显荧光斑点,见图6。
七、不同处理对HaCaT细胞活性氧产生的影响
作用 48 h 后,IFN-γ 组、TRAIL 组、细胞因子联合组活性氧平均荧光强度分别为494.33 ± 63.59、434.67 ± 16.57、901.33 ± 64.49,阴 性 对 照 组 为199.01±4.04,4组间差异有统计学意义,F=26.81,P<0.001。细胞因子联合组与阴性对照组比较,差异有统计学意义,t=702.00,P< 0.05。
讨 论
本研究显示,IFN-γ 和 TRAIL 共同作用可导致细胞存活率明显下降、坏死率升高,说明IFN-γ 和TRAIL 可诱导细胞坏死。zVAD 为caspase 抑制剂,当其预处理HaCaT细胞 1 h 后 ,联合 IFN-γ 和TRAIL(zVAD 联合组)可致细胞存活率进一步下降、坏死率进一步升高,但细胞存活率、坏死率在细胞因子联合组与zVAD 联合组之间差异均无统计学意义,提示IFN-γ和TRAIL诱导的细胞死亡类型与zVAD 联合组诱导的类似。光镜下观察发现,细胞因子联合组和zVAD 联合组均出现坏死样形态特征。提示 IFN-γ 和 TRAIL 联合对 HaCaT 细胞程序性坏死具有一定影响。
表2 干扰素γ与TRAIL联合及共同与zVAD联合对HaCaT细胞pRIP1、RIP1、caspase 8、pRIP3、RIP3、pMLKL、MLKL蛋白表达的影响(±s)
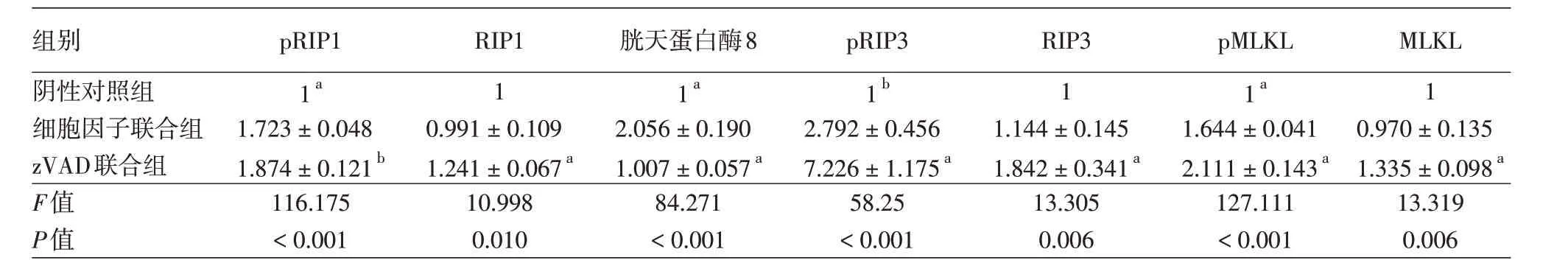
表2 干扰素γ与TRAIL联合及共同与zVAD联合对HaCaT细胞pRIP1、RIP1、caspase 8、pRIP3、RIP3、pMLKL、MLKL蛋白表达的影响(±s)
注:n=3。与细胞因子联合组(干扰素γ+TRAIL)比较,a P <0.01,b P <0.05。TRAIL:TNF相关凋亡诱导配体;zVAD:胱天蛋白酶抑制剂;RIP:受体相互作用蛋白;MLKL:混合系激酶区域样蛋白
组别阴性对照组细胞因子联合组zVAD联合组F值P值pRIP1 1a 1.723±0.048 1.874±0.121b 116.175<0.001 RIP1 1 0.991±0.109 1.241±0.067a 10.998 0.010胱天蛋白酶8 1a 2.056±0.190 1.007±0.057a 84.271<0.001 pRIP3 1b 2.792±0.456 7.226±1.175a 58.25<0.001 RIP3 1 1.144±0.145 1.842±0.341a 13.305 0.006 pMLKL 1a 1.644±0.041 2.111±0.143a 127.111<0.001 MLKL 1 0.970±0.135 1.335±0.098a 13.319 0.006

图5 pRIP3 免疫荧光检测(×400) 绿色荧光斑点表示pRIP3蛋白,阴性对照组未见明显绿色荧光斑点,干扰素γ组、TRAIL组细胞质可见浅绿色荧光斑点,细胞因子联合组细胞质可见强绿色荧光斑点。pRIP3:磷酸化受体相互作用蛋白3 图6 pMLKL 免疫荧光检测(×400) 红色荧光斑点表示pMLKL蛋白。阴性对照组细胞无明显荧光斑点,干扰素γ组、TRAIL组细胞膜可见浅红色荧光斑点,细胞因子联合组细胞膜可见明显红色荧光斑点。pMLKL:磷酸化混合系激酶区域样蛋白
在程序性坏死中,RIP1 可能通过自身磷酸化实现对 N 端激酶的调控[11-12],激活 RIP3,构成“RIP1-RIP3 坏死体”,同时在刺激因子作用下,RIP3 也发生自磷酸化,激活下游MLKL 使其磷酸化[3],pMLKL 通过自身寡聚化后逐渐转移至膜上[13-14],可能通过对细胞膜的渗透、破坏,导致细胞死亡。本研究显示,在阴性对照组、IFN-γ 组、TRAIL组之间 ,RIP3、MLKL基因表达及 RIP1、RIP3、MLKL 蛋白表达无明显差异,细胞因子联合组RIP3、MLKL 基因表达和RIP1、RIP3、MLKL 蛋白及其磷酸化蛋白表达均较阴性对照组明显升高,证实 IFN-γ 和 TRAIL 联合作用下 RIP1/RIP3/MLKL 信号通路被激活。zVAD 联合组中,经过zVAD 预处理,caspase 8 表达降低,RIP1、RIP3、MLKL 及其磷酸化蛋白表达较细胞因子联合组进一步上升,其程序性坏死程度进一步加深。考虑到IFN-γ和TRAIL也可以参与炎症反应、细胞凋亡等[6],推测当caspase 8 被抑制时,IFN-γ 和 TRAIL 更易诱导程序性坏死发生。通过荧光显微镜可见,pMLKL 主要分布在细胞膜上,说明pMLKL 可能是HaCaT 细胞程序性坏死的执行者,通过对细胞膜完整性的破坏导致细胞死亡。既往研究发现,在人组织淋巴瘤细胞U937 和Fas 相关死亡域蛋白缺陷型人白血病T细胞系Jurkat 中,活性氧在MLKL 活化的上游和下游都起作用,一方面,活性氧促进“RIP1-RIP3 坏死体”稳定,并在程序性坏死过程中启动正反馈扩增循环[15],此外,活性氧可以特异性氧化 RIP1 上 3 个关键半胱氨酸[4],从而促进S161自磷酸化和坏死体形成;另一方面,过度产生的活性氧可以损伤脂类、蛋白、DNA 等,影响 Ca2+浓度,引起细胞坏死[4,16]。本研究显示,IFN-γ 和TRAIL 联合作用可导致大量活性氧产生,说明在HaCaT 细胞程序性坏死中,活性氧也可能起重要作用,但这些仍需进一步研究。
本研究中,IFN-γ 单独作用后细胞存活率明显下降,但坏死率无明显变化,其原因可能是IFN-γ单独作用可诱导HaCaT 细胞发生凋亡[7],而与TRAIL联合作用时促程序性坏死作用明显,考虑可能是IFN-γ 和TRAIL 细胞因子间相互作用所致。研究发现,药物特异性CD8+T 细胞可产生IFN-γ,募集单核细胞/巨噬细胞和树突细胞,进一步促进其他促炎细胞因子如 TRAIL 等表达[10,17]。此外,IFN-γ 可通过上调 KC 死亡受体 4、5 的表达,使 KC结合更多的TRAIL[11],该机制可能也参与程序性坏死过程。还有研究发现,IFN-γ 可以打破细胞对TRAIL的耐受,增强细胞对TRAIL的敏感性[18]。
我们通过形态学分析以及细胞存活率、坏死率和程序性坏死相关基因和蛋白表达的检测,证实IFN-γ 和 TRAIL 联合可诱导 HaCaT 细胞发生程序性坏死,同时伴随着活性氧产生,这些将有助于进一步理解SJS/TEN 中发生的KC 程序性坏死机制,以IFN-γ、TRAIL作为靶点的治疗也许可减少KC大量坏死,缓解病情。鉴于SJS/TEN发病机制的复杂性,SJS/TEN中KC发生的程序性坏死是否有TNF-α等其他细胞因子参与以及RIP1/RIP3/MLKL通路与活性氧的具体作用等还需要深入研究。
利益冲突所有作者均声明不存在利益冲突
