维格列汀对大鼠脊髓损伤后神经细胞凋亡及运动功能恢复的影响
2019-06-22徐天臻王臣健汤呈宣
徐天臻,王臣健,汤呈宣
(温州医科大学附属第三医院 瑞安市人民医院 脊柱外科,浙江 温州 325200)
脊髓损伤(spinal cord injury,SCI)是临床常见的严重创伤,常导致永久性感觉和运动功能丧失,引起瘫痪甚至威胁生命[1-2]。SCI的病理过程可分为2个阶段:原发性损伤由机械损伤引起,难以逆转;继发性损伤则由血管损伤、氧化应激、炎性反应、谷氨酸兴奋性毒性、细胞凋亡和坏死等引起的复杂病理级联反应,最终引起神经细胞的凋亡,导致脊髓进一步损伤[3-5]。因此,限制继发性损伤进程从而减轻神经元凋亡或许可以促进SCI之后的功能恢复[6]。
维格列汀(vildagliptin,Vilda)是口服二肽基肽酶-4(dipeptidyl peptidase 4,DPP4)抑制剂类降糖药物,已在110余个国家批准使用[7]。近来有研究指出Vilda除降糖作用外,还具备抗氧化应激、维持线粒体功能、抗炎、抗凋亡等作用[8-9]。其神经保护作用已在大鼠阿尔茨海默症(Alzheimer's disease,AD)模型中提及[10-11],但其在大鼠SCI模型中的作用报道较少,因此,本实验研究Vilda对SCI后大鼠运动神经元凋亡及运动功能的影响。
1 材料和方法
1.1 材料
1.1.1 动物及分组:选用雌性SD大鼠48只,清洁级,体质量200~250 g,由温州医科大学实验动物中心提供,实验动物许可证号:SYXK(浙)2014-0006,给予足量的水和饲料,在23~25 ℃的环境下喂养。采用随机数字表法将适应性喂养1周后的大鼠分为3组:假手术组(Sham组)、手术组(SCI组)、Vilda治疗组(SCI+Vilda组),每组16只。
1.1.2 主要试剂与仪器:Vilda购自美国MCE公司,使用时将药物按2 mg/mL的浓度在超声波帮助下溶于0.9%氯化钠溶液;制备压迫型大鼠SCI模型器械由温州医科大学附属第二医院骨科实验室提供(血管夹夹持应力:30 g);凋亡相关蛋白Bcl-2单克隆抗体购自英国Abcam公司,Bax、Cleaved Caspase 3单克隆抗体均购自美国CST公司;山羊抗鼠抗体、山羊抗兔抗体均购自上海翊圣公司;尼氏染色液(焦油紫法)购自北京索莱宝公司。全自动酶标仪购自美国Thermo公司,电泳仪和自动凝胶成像仪购自美国Bio-Rad公司,荧光显微镜购自日本奥林巴斯公司,组织匀浆机购自上海净信公司。
1.2 方法
1.2.1 模型的制备及术后处理:将SD大鼠以8%水合氯醛按3.5 mL/kg剂量行腹腔注射麻醉。麻醉满意后取俯卧位,固定大鼠四肢,T9节段附近备皮并消毒。Sham组仅去除棘突和椎板,暴露脊髓,不进行血管夹压迫;SCI组和SCI+Vilda组使用血管夹(30 g)制备压迫型SCI模型[12-14],压迫点为T9节段,血管夹压迫时间为1 min。大鼠SCI模型建立成功的标准:脊髓局部充血、水肿,行为学可观察到大鼠后肢痉挛,尾巴痉挛抽动,苏醒后BBB评分(Basso-Beattie-Bresnahan scale)为0 分[15]。术后处理:麻醉苏醒后,立刻给药1次,按10 mg·kg-1·d-1的剂量通过灌胃方式给药,SCI组和SCI+Vilda组分别同时给予等体积的0.9%氯化钠溶液和Vilda溶液,连续给药7 d,之后每3 d给药1次;分别在术后第3、第7、第14、第28天处死取标本。术后大鼠自由进食和饮水,饲养环境维持在23~25 ℃,每2 d换次垫料,保持干燥通风;同时辅助SCI组和SCI+Vilda组大鼠排尿、排便,每日3次,做好会阴部护理。
1.2.2 后肢运动功能恢复的行为学评估:在术后第1、第3、第7、第14、第21、第28天分别运用0~21 分制BBB量表评估大鼠后肢运动功能恢复的情况[15],评估采取双盲法,由熟悉BBB评分量表的实验人员进行;此外,在术后第28天,对各组大鼠进行足印迹步态分析[16-17],每只大鼠前爪用红墨水染色,后爪用蓝墨水染色,放置于2 m×10 cm的白纸上自由行走,获得足印迹。
1.2.3 脊髓组织尼氏染色检测前角运动神经细胞:术后第7天,处死大鼠,完整剥离出损伤处(T7~T10)的脊髓组织,置于4%多聚甲醛中固定,之后用石蜡包埋,用切片机切成5 μm厚的薄片黏附在载玻片上。根据试剂盒说明书进行染色:切片常规脱蜡至水,然后将切片置于染色工作液中,并将染缸于56 ℃温箱浸染1 h,之后取出切片,去离子水冲洗3次(冲洗时注意防止脱片),将切片置于尼氏分化液中分化30 s,之后乙醇梯度脱水,二甲苯中透明30 min,中性树胶封固,最后在显微镜下观察。
1.2.4 脊髓组织免疫荧光染色检测凋亡蛋白的表达:术后第3天,处死大鼠,完整剥离出损伤处(T8~T10)的脊髓组织,置于4%多聚甲醛中固定,之后用石蜡包埋,用切片机切成5 μm厚的薄片黏附在载玻片上。根据组织免疫荧光染色步骤进行操作:切片常规脱蜡至水,PBS漂洗3次,每次5 min(漂洗时注意防止脱片);37 ℃水浴箱中胰酶法抗原修复30 min,PBS漂洗3次,每次5 min;37 ℃水浴箱中用10%山羊血清封闭1 h;孵育一抗:将Cleaved Caspase 3抗体用1% BSA按1:400的比例稀释,滴到切片上将脊髓组织完全覆盖,之后将切片放入湿盒中4 ℃孵育过夜;孵育二抗:一抗孵育结束之后,将切片取出,在37 ℃水浴箱中复温1 h,之后PBS漂洗3次,每次5 min,用1% BSA按1:1 000浓度稀释二抗抗体,滴到切片上将组织覆盖,置于37 ℃水浴箱孵育2 h(孵育二抗全程避光);DAPI染核:二抗孵育结束之后,取出切片,PBS漂洗3次,将DAPI染液滴到组织上,室温下静置1 min(避光操作);封片:将切片用PBS漂洗3次,每次5 min,去除多余PBS,滴加抗荧光猝灭剂,封片,暗室显微镜下观察。
1.2.5 Western blot检测凋亡相关蛋白的表达:术后第3天,处死各组大鼠,完整剥离出T8~T10节段的脊髓组织,加入组织裂解液(按10 mg组织加100 μL裂解液的比例添加,裂解液按100:1 的比例混合组织裂解液和PMSF),用组织匀浆机研磨(50 Hz,5 min);研磨之后离心10 min(3 000 r/min),吸取上清液,超声波裂解3 次,每次10 s,然后离心30 min(12 000 r/min),吸取上清液(全程在冰上进行);使用BCA蛋白浓度检测试剂盒测定蛋白浓度,配制蛋白样品时保证20 μL样品中含80 μg蛋白;12%的SDS-PAGE凝胶电泳、转膜,5%脱脂牛奶封闭2 h;孵育一抗:将硝酸纤维素膜放入相应的抗体孵育盒中(Bcl-2、Bax、Cleaved Caspase 3抗体按1:1 000的比例稀释),摇床上4 ℃环境下孵育过夜;孵育二抗:一抗孵育结束之后,将膜用TBST漂洗3次,每次5 min,再将膜转入二抗孵育盒,放于摇床上,室温孵育2 h;曝光:二抗孵育结束之后,将显色液均匀敷在膜上,在凝胶成像仪上曝光成像;图像分析:利用Image Lab3.0软件对曝光结果进行灰度分析。
1.3 统计学处理方法 使用GraphPad Prism 7.0软件进行数据统计处理,数据以s 表示,每组实验均重复进行3次,多组比较采用单因素方差分析,采用广义线性混合模型分析BBB评分的组间差异。P<0.05为差异有统计学意义。
2 结果
2.1 Vilda促进大鼠SCI后运动功能的恢复 大鼠建模成功后,BBB评分为0分,仅依靠前肢拖行,爬行时身体不稳易倾斜、转圈,随着时间的推移,SCI组与SCI+Vilad组大鼠BBB评分开始提升,但SCI+Vilad组大鼠BBB评分的提升较SCI组更为显著,从术后第14天开始,差异有统计学意义(P<0.05),见图1A;从足印迹步态分析实验结果来看,在术后第28天,与SCI组大鼠相比,SCI+Vilad组大鼠后肢运动功能恢复得更好,步态更为一致,爬行时身体更稳定,后肢动作更为协调,见图1B。
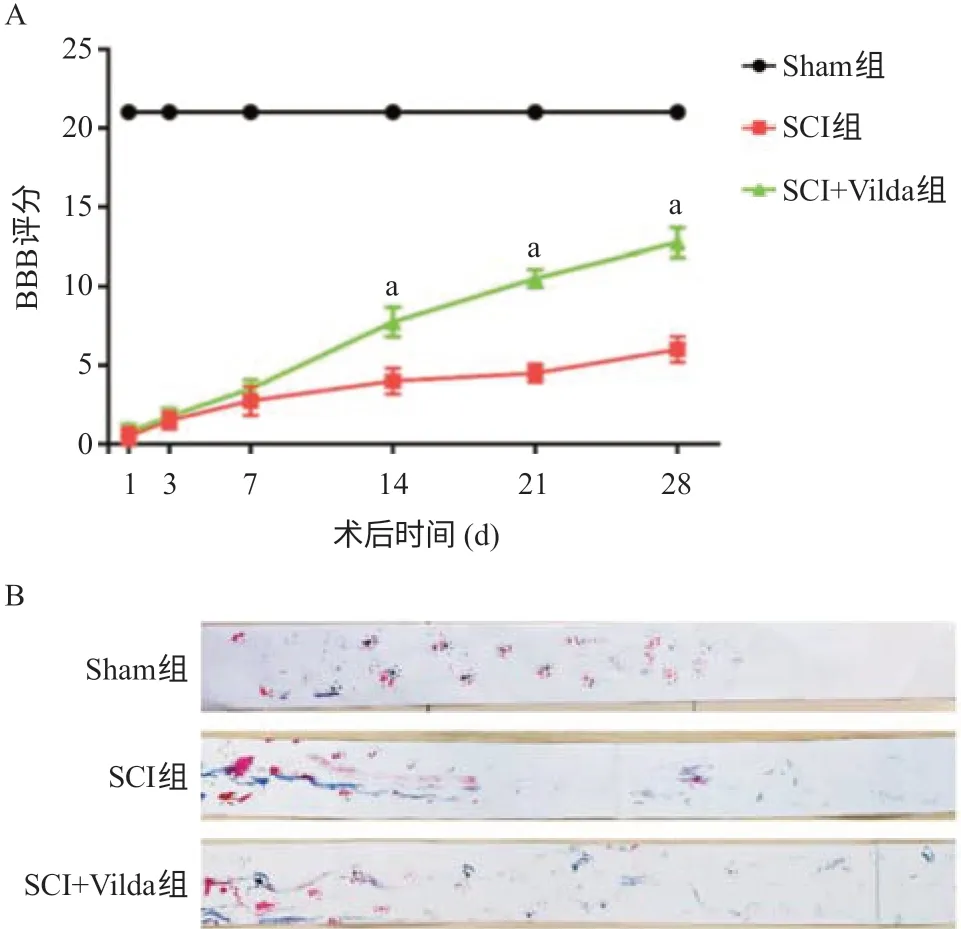
图1 Vilda促进大鼠SCI后运动功能的恢复
2.2 Vilda减少SCI后脊髓前角运动神经元的损失
脊髓前角区域尼氏染色结果显示,Sham组脊髓组织染色阳性前角运动神经元数量多、分布均匀;SCI组大鼠前角运动神经元数量明显减少(P <0.01),损失严重,分布不均匀;而SCI+Vilad组大鼠情况较SCI组大鼠有所改善,前角运动神经元数量增多(P<0.01),分布较为均匀,见图2。
2.3 Vilda抑制凋亡相关蛋白的表达 脊髓组织免疫荧光染色结果显示,术后第3天,与Sham组相比,SCI组脊髓组织内凋亡相关蛋白Cleaved Caspase 3的表达增强,而在SCI+Vilad组大鼠中,这种情况得到改善,凋亡相关蛋白Cleaved Caspase 3的表达减弱(见图3)。Western blot结果显示,在术后第3天,与Sham组比,SCI组凋亡相关蛋白Bax、Cleaved Caspase 3 的表达明显上升(P <0.01),而Bcl-2蛋白表达明显下降(P <0.01);而与SCI组相比较,SCI+Vilda组大鼠中Bax蛋白表达明显下降(P<0.01),Cleaved Caspase 3蛋白表达也下降(P <0.05),而Bcl-2蛋白表达明显上升(P<0.05),见图4。
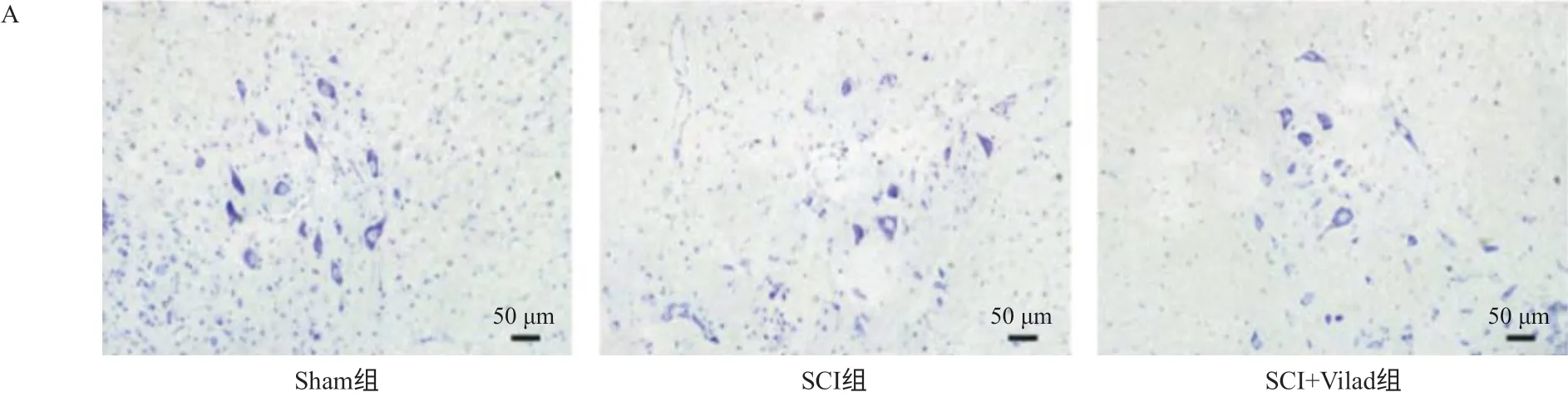
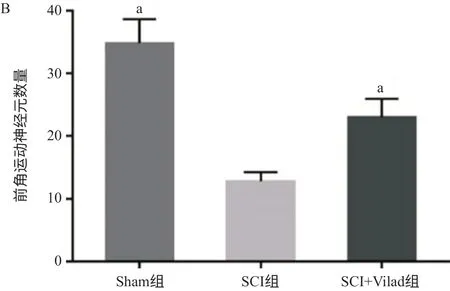
图2 Vilda减少SCI后脊髓前角运动神经元的损失
3 讨论
SCI影响着全世界成千上万的人,公开的数据显示在美国每年大约新增SCI患者10 000例,主要致病因素包括机动车事故(占36%~48%)、暴力(占5%~29%)、摔倒(占17%~21%)、体育损伤(占7%~16%),并常常伴随着终身的残疾以及高昂的治疗费用[18-19]。目前,SCI病理过程分为原发性损伤和继发性损伤2个过程已得到普遍认同,其中继发性损伤会持续数周时间,运动神经元凋亡在继发性损伤中扮演了重要的角色,并且最终导致肌肉失神经性无力和萎缩[20-22]。当前临床治疗SCI的方式主要有手术治疗和药物治疗。手术治疗指外科手术解除脊髓压迫、恢复脊柱稳定性;药物治疗主要包括糖皮质激素冲击疗法减轻过氧化和创伤后炎症反应,以及一些神经营养性药物(神经节苷脂、利鲁唑等),近来低温疗法以及细胞移植疗法也在探索中但尚未进入临床应用[23]。但目前的疗法都未能有效逆转运动神经元的凋亡,促进运动功能的恢复。因此,探索新的治疗策略,抑制脊髓损伤之后运动神经元的凋亡,从而促进脊髓损伤后运动功能的恢复是目前研究的热点。
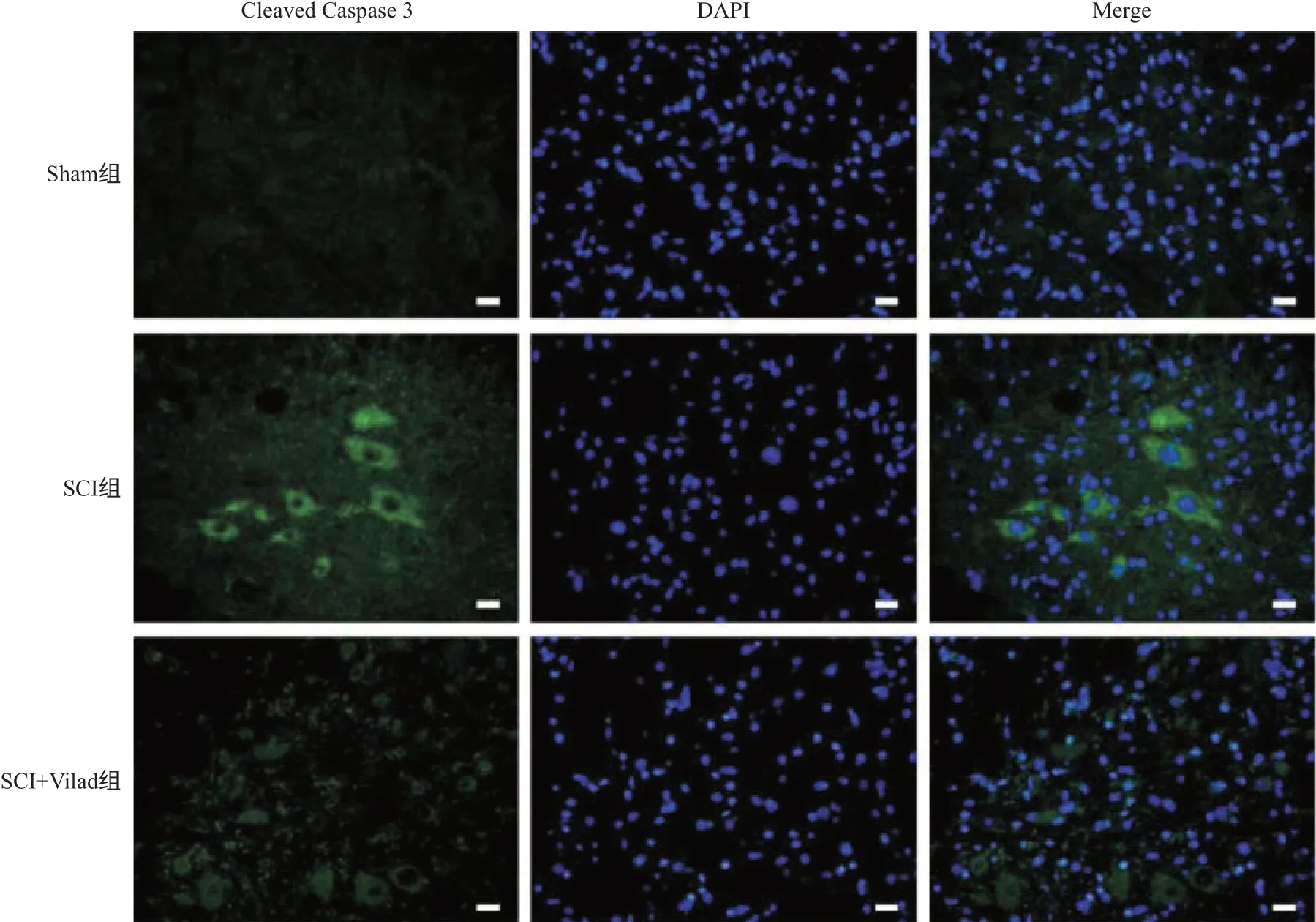
图3 Vilda抑制凋亡相关蛋白Cleaved Caspase 3的表达(比例尺:20 μm)
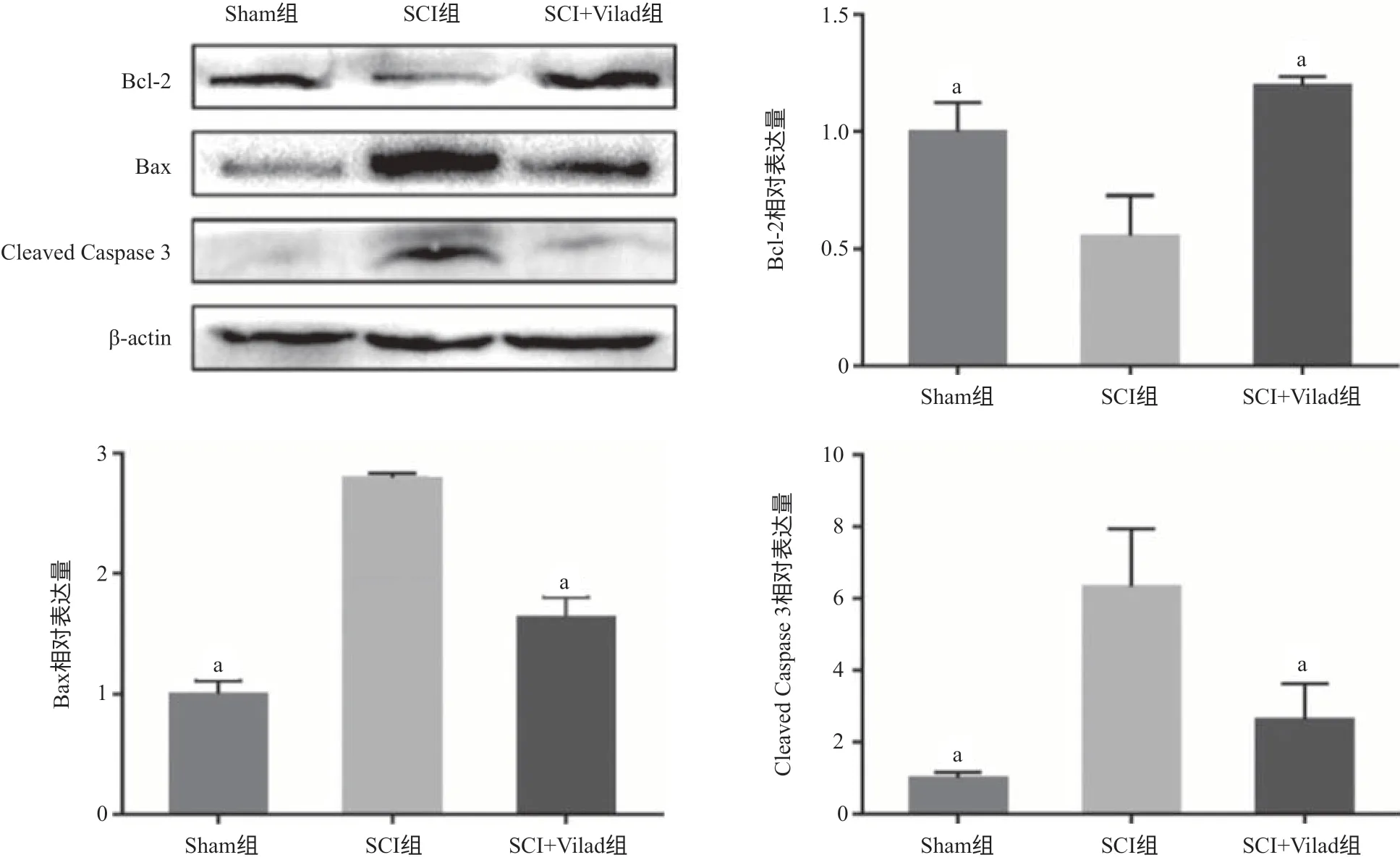
图4 3组大鼠凋亡相关蛋白相对表达量比较
本研究探讨了DPP4抑制剂类降糖药物Vilda对大鼠脊髓损伤之后神经细胞、特别是运动神经元细胞凋亡的影响及运动功能恢复的作用。在细胞凋亡过程中,Caspase家族、Bcl-2家族和Bax因子是常被研究的对象,其中Cleaved Caspase 3是凋亡执行因子,Bcl-2是凋亡抑制因子,Bax是凋亡促进因子[24-26]。在本研究中,我们采用免疫荧光法和Western blot法检测凋亡相关蛋白的表达,采用尼氏染色法检测脊髓中运动神经元的存活情况。从结果来看,与Sham组相比,SCI组凋亡蛋白Bax和Cleaved Caspase 3 表达增加,而凋亡抑制蛋白Bcl-2表达减少,在尼氏染色结果中相对应的表现为阳性神经元数目减少且分布不均;而SCI+Vilda组大鼠在接受Vilda干预之后,与SCI组相比较,凋亡蛋白表达减少,凋亡抑制蛋白表达回升,相应的尼氏染色结果显示阳性神经元数目较SCI组多且分布较为均匀。这些结果提示大鼠SCI之后应用Vilda干预之后,脊髓运动神经元的凋亡减弱,存活情况得到改善,并且提示这种作用与Caspase 3凋亡通路的调控相关。伴随着脊髓运动神经元凋亡的抑制,脊髓损伤后大鼠的运动功能也得到了改善,与SCI组相比,SCI+Vilad组大鼠的BBB评分显著升高,足印迹步态显示用药干预后的SCI+Vilad组大鼠表现为更加一致、稳定、协调的步态,提示经Vilda治疗后,伴随着运动神经元凋亡的抑制以及数目的恢复,SCI后大鼠的运动功能得到显著恢复。
综上所述,Vilda在大鼠SCI中表现出神经保护作用,这种作用与Vilda可抑制神经细胞凋亡有关,并最终促进大鼠SCI后运动功能的恢复。
