HOXB7基因在胃癌中的表达及预后价值
2019-06-21方红艳张江洲
方红艳,王 群,张江洲,黄 慧
方红艳,王群,张江洲,黄慧,武汉市第五医院肿瘤科 湖北省武汉市 430050
核心提要:本文利用国外公共数据库分析了HOXB7在胃癌(gastric cancer,GC)中的表达及临床意义,提示HOXB7在GC中可能是一种可靠的生物标志物.同时,本文所使用的研究方法,也为其它疾病中生物标志物的挖掘提供了借鉴.
0 引言
胃癌(gastric cancer,GC)是全球常见的恶性肿瘤,并且预后较差.根据国际癌症研究机构的统计数据,2012年全球GC新发病例约95.1万例,因GC死亡病例约72.3万例,分别位于恶性肿瘤发病率第5位、死亡率第3位[1],据我国国家癌症中心统计,2015年约有66.7万GC新发病例,是我国癌症患者死亡的主要原因[2],严重危害人类的健康.
同源异形盒基因HOXB7定位于17q21.3人类染色体,属于同源异形盒HOX家族B簇,其编码的同源蛋白可作为转录调节因子,在正常情况下参与相关细胞分裂周期的DNA修复,与细胞或器官的正常发育和分化相关.而其在异常情况下,如过度表达则可促使上皮细胞发生恶性转化[3],HOXB7因此被认为是一种原癌基因.目前,已有研究表明在结直肠癌[4]、胰腺癌[5]、骨肉瘤[6]中,HOXB7表达异常增高,并与恶性肿瘤进展及预后不良相关.尽管既往研究表明HOXB7在多种肿瘤组织中表达增高,但是在GC组织中鲜有系统研究.
目前生物信息学正飞速发展,肿瘤研究处于信息大爆炸时代.各种高通量技术产生了大量的细胞系和组织生物学表达谱数据及高通量测序数据,存储在各大数据库中.Oncomine数据库(http://www.oncomine.org)是由美国密歇根大学创建的用于分析基因表达、基因共表达、突变、耐药、预后等的重要的肿瘤数据库,目前共包含715个数据集,86733个样本[7].Kaplan-Meier Plotter数据库(KM Plotter,http://kmplot.com/analysis/)中包含10461个肿瘤样本,可以评估54675个基因对生存的影响[8].利用数据挖掘可分析靶基因在肿瘤组织及其相应正常组织中的表达差异,同时也可获得靶基因表达与患者的总生存时间等临床资料的关系,供学者挖掘潜在的肿瘤标志物[9-12].
本研究利用国外公共基因芯片数据库分析HOXB7在GC中的表达和预后价值,为后续HOXB7作为GC诊治标志物提供依据.
1 材料和方法
1.1 材料 利用Oncomine数据库分析GC及正常胃黏膜组织HOXB7基因表达情况.共3个数据集(GSE19826、GSE13861和GSE13911)纳入此次研究.利用KM Plotter数据库的GC数据集进行生存分析.共5个数据集(GSE14210,GSE15459,GSE22377,GSE29272,GSE51105)纳入此次研究中.
1.2 方法 利用Oncomine数据库分析GC及正常胃黏膜组织HOXB7基因表达情况.共3个数据集(GSE19826、GSE13861和GSE13911)纳入此次研究.基因表达差异倍数大于2且P值小于0.05视为差异具有统计学意义.
利用KM Plotter数据库的GC数据集进行生存分析.根据HOXB7表达量的中位值,GC病人被分为高表达组和低表达组,通过计算logrankP值和HR及95%区间来估算总体生存期,以P<0.05为差异有统计学意义.在这项研究中,由于GSE62254数据集和其他数据集有明显不同的特征,因此被排除.
统计学处理正常组织与GC病例组之间HOXB7表达的差异采用t检验.HOXB7表达与GC预后的关系采用Kaplan-Meier模型分析,采用log-rank检验法.以双侧P<0.05为差异有统计学意义.
2 结果
2.1 HOXB7基因在不同GC研究芯片中的差异表达 利用Oncomine数据库分析HOXB7的表达,发现HOXB7基因在GC组织中的表达显著高于正常胃黏膜组织(P=9.08E-06,FC=4.894)(图1A).
对不同类型GC中HOXB7的表达进行分析,发现HOXB7在弥漫型GC(P=5.69E-05,FC=2.293)和肠型GC(P=9.31E-07,FC=2.801)中的表达均显著高于正常胃黏膜组织(图1B和C).
2.2 HOXB7基因与GC患者预后的相关性 KM Plotter数据结果显示:HOXB7基因的高表达与GC患者总生存呈负相关,HOXB7表达越高,GC患者总体生存期越短(HR= 1.38,95%CI:1.14-1.68,P=0.00087),见图2A.
进一步分析发现,HOXB7高表达在弥漫型GC患者(HR=2.03,95%CI:1.21-3.39,P=0.0059)和肠型GC患者(HR=1.56,95%CI:1.05-2.32,P=0.027)中均有预后价值(图2B和C).
3 讨论
HOXB7基因编码的同源蛋白作为转录调节因子,不仅与细胞或器官的正常发育和分化相关,还在肿瘤细胞或组织中高表达,并对肿瘤的发生发展起着关键作用.目前,已有研究表明在结直肠癌[4]、胰腺癌[5]、骨肉瘤[6]中,HOXB7表达异常增高,并与恶性肿瘤进展及预后不良相关.在结直肠癌中,HOXB7可加速G0/G1向S期转化,并上调cyclin D1的表达水平,进而调控细胞周期[4].在胰腺癌中,对HOXB7进行基因沉默后细胞凋亡显著增加[5].在骨肉瘤中,HOXB7表达的下调显著抑制细胞活力,增殖,迁移和上皮-间质的转化,以及MG63细胞系中的基质金属蛋白酶MMP2和MMP7蛋白水平[6].
为探索HOXB7基因在GC中的表达和临床意义,我们选择了目前世界上最大的基因芯片数据库Oncomine数据库,研究分析了186例GC芯片样本,发现HOXB7在GC组织的表达明显高于正常胃黏膜组织,这与Tu等[13]的RT-PCR和蛋白质印迹结果相一致.进一步分析发现HOXB7基因在肠型GC和弥漫型GC中的表达均显著高于正常胃黏膜组织,提示HOXB7的表达程度与Lauren分型无关.我们再通过KM Plotter数据库分析HOXB7在GC中的预后价值.结果显示,HOXB7的表达量与GC总体生存呈负相关(HR=1.38,95%CI:1.14-1.68,P=0.00087),高表达组的死亡风险是低表达组的1.38倍.进一步分析发现HOXB7对不同亚型GC患者(Lauren亚型)的预后均有一定的指导意义.由此看来,HOXB7基因在GC中可能作为一个癌基因的角色.研究[14,15]显示HOXB7基因可能通过调节PTEN-PI3K/AKT信号通路活性促进GC细胞发生周期阻滞,诱导细胞发生凋亡,降低GC的侵袭、迁移和增殖能力.He等[16]研究表明HOXB7的高表达可能在促进GC发展中起重要作用,其可能通过激活AKT和MAPK通路进行增殖,迁移和侵袭导致GC进展和预后不良.
总之,我们通过对GC组织HOXB7相关信息的深入挖掘,提出HOXB7在GC组织中高表达,且与GC预后相关.结合目前已有的研究结果我们可以推知HOXB7在GC的发展中起癌基因的作用,有望成为GC治疗的新靶点和预后的新标志.关于HOXB7在GC疾病发展中的具体作用机制,未来尚需要更多的实验来探索证明.
文章亮点
实验背景
寻找胃癌(gastric cancer,GC)治疗的新靶点和预后的新标志对改善患者预后至关重要.
实验动机
目前,HOXB7在GC中的表达情况及预后价值鲜有报道.
实验目标
明确HOXB7在GC中的表达及对预后的影响,为GC患者预后以及治疗策略提供新的靶点做铺垫.

图1 HOXB7在胃癌中的表达.A:HOXB7在胃癌(gastric cancer,GC)与正常胃黏膜组织中的表达;B:HOXB7在弥漫型GC与正常胃黏膜组织中的表达;C:HOXB7在肠型GC与正常胃黏膜组织中的表达.
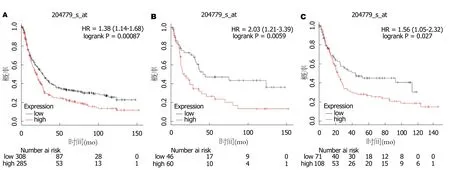
图2 HOXB7在胃癌患者的预后价值.A:HOXB7高表达在所有胃癌(gastric cancer,GC)患者中的预后模式;B:HOXB7高表达在弥漫型GC中的预后模式;C:HOXB7高表达在肠型GC中的预后模式.
实验方法
首先,我们利用基因芯片数据,分析HOXB7在GC与正常组织中的表达差异,然后分析了HOXB7表达水平与GC预后的关系.
实验结果
HOXB7在GC组织中高表达,且与GC预后负相关.
实验结论
HOXB7在GC中具有较大的临床意义.
展望前景
HOXB7在GC中具有较大临床意义,值得进一步深入研究.
