单核细胞趋化蛋白-1细胞间黏附分子-1及核转录因子-kappa在人颅内动脉瘤中的表达及临床意义
2019-06-21黄孝宇
黄孝宇
河南省第二人民医院病理科,河南 郑州 450000
颅内动脉瘤(intracranial aneurysm,IA),一种病发于Willis环动脉分叉处的疾病,是引起蛛网膜下腔出血(subarachnoid hemorrhage,SAH)的常见病因,全球范围患者比例达5%左右,且致残率和病死率高达50%[1-3]。IA的危害性在于其后期的破裂病发症,一旦出现此种情况,患者往往有较高的病死率,而IA患者瘤破裂出血的概率仅次于脑血栓和高血压脑出血[4-6]。目前针对IA的病发,医学界并没有一个准确的定义,仅是模糊定义是由于局部血管的非正常变化而造成的恶性囊性膨胀引起,但是其病症、恶化过程较为复杂,研究证明,随着患者年龄增加、身体状况改变引起的高血压、高血脂、动脉粥样硬化等症状的出现以及环境的变化,都可引起IA的破裂[7-9]。随着近年来动物IA模型建立方法的不断完善,IA逐渐成为医学界研究的热点,医学工作者就其形成机制、病发过程等不断临床试验,以期望找到有效解决方法[10-12]。本实验通过总结学者研究资料,通过免疫组化技术检测单核细胞趋化蛋白-1(MCP-1)、细胞间黏附分子-1(ICAM-1)及核转录因子-kappa(NK-KB)蛋白质的表达,观察颅内动脉瘤临床发病机制。
1 资料与方法
1.1一般资料选取2011-05-2016-05于河南省第二人民医院就诊的颅内动脉瘤患者手术切除30例临床标本,均在确保患者生命安全的前提下获取。男28例,女12例,年龄25~60(35.3±12.2)岁。纳入标准:经数字减影血管造影(DSA)、磁共振血管成像(MRA)确诊为IA患者,排除标准:就诊前接收动脉瘤夹闭手术或者血管治疗。所有标本经河南省第二人民医院病理科确认是颅内动脉瘤。选用正常颅动脉标本12例作为对照组,其中颅前动脉、颞浅动脉、皮层动脉、颅动脉分支分别2、4、4、2例。不同组别基本资料无显著性差异(P>0.05)
1.2临床症状28例IA患者出现SAH症状,2例表现自发性颅内血肿:1次23例,2次5例,3次2例。手术前经Hunt-Hess诊断分级,Ⅰ级8例,Ⅱ级14例,Ⅲ级6例,Ⅳ级2例。
1.3方法
1.3.1 ICAM-1和NF-KB免疫组化检测:将30例IA患者颅动脉瘤组标本和12例正常颅动脉组标本用4%多聚甲醛固定后,石蜡包埋,常规切片;二甲苯、不同梯度乙醇进行常规脱水;3%双氧水消除过氧化物酶活性,10 min;枸盐酸盐缓冲液对切片进行抗原热修复;37 ℃下10%山羊血清封闭10 min;PBS缓冲液清洗后,分别滴加ICMA-1兔抗人抗体、NF-KB兔抗人抗体(均购买于博美生物工程科技有限公司),比例均为1:100,于4 ℃下过夜;PBS缓冲液冲洗,滴加二抗(购买于博美生物工程科技有限公司),37 ℃下湿盒孵育40 min;PBS缓冲液冲洗后,滴加DAB显色液,于显微镜下观察,至出现棕黄色或黄色反应后PBS冲洗;苏木素复染后,PBS冲洗,梯度乙醇脱水,二甲苯透明,中性树胶封片;显微镜下观察阳性反应,采集图像系统随机选取10~15张不同视野下图片,LaserPix图像分析系统分析图像,检测平均光密度(Mean Density,MD)。
1.3.2 阴性对照:将一抗替换为PBS缓冲液,其余步骤同步骤2.1。
1.3.3 阳性对照:选择博美生物工程科技有限公司提供的ICMA-1和NF-KB阳性对照片作为阳性对照组。
1.4Western-blot法检测MCP-1蛋白表达参考文献检测颅动脉瘤组和正常颅动脉组MCP-1中蛋白表达[9]。配制裂解液,提取颅动脉瘤组标本和正常颅动脉组标本中总蛋白,一抗稀释比例1:200,二抗1:1 000,在电泳缓冲液中电泳,在转移缓冲液中将MCP-1蛋白转移至NC膜,脱脂奶粉封闭,一抗4℃过夜,二抗孵育2 h,在暗室中用ECL发光,X胶片曝光,显影,定影。
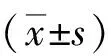
2 结果
2.1ICAM-1免疫组化检测图1为颅动脉瘤组标本和正常颅动脉组标本ICAM-1蛋白免疫组化检测结果。由图可以看出,ICAM-1在颅动脉瘤中阳性反应明显,多处均有表达,而正常动脉瘤标本中仅有微弱的表达。统计结果发现,ICAM-1在颅动脉瘤中MD值为(0.294±0.035),而正常颅动脉中ICMA-1的MD值仅为(0.083±0.020),差异有统计学意义(P<0.05)。
2.2NF-KB免疫组化检测结果图2为颅动脉瘤组标本和正常颅动脉组标本NF-KB蛋白免疫组化检测结果,NF-KB在颅动脉瘤中阳性表达较为明显,图片中区域几乎均有黄色反应,相比之下常动脉瘤标本阳性表达较少,且NF-KB在颅动脉瘤中MD值达(0.354±0.025),而正常颅动脉中ICMA-1的MD值仅为(0.092±0.041),差异有统计学意义(P<0.05)。
2.3Western-blot法检测MCP-1蛋白图3为Western-blot法检测MCP-1蛋白结果,可以看出颅动脉瘤组标本中MCP-1蛋白表达较正常颅动脉多;表3为MCP-1表达值,颅动脉瘤组达(1.80±0.25),正常颅动脉组为(0.30±0.32),差异有统计学意义(P<0.05)。与正常颅动脉组比较,P<0.05。
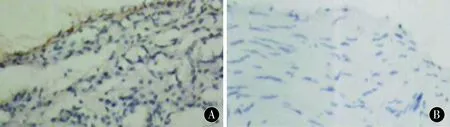
图1 ICAM-1免疫组化检测 A:颅动脉瘤;B:正常颅动脉(×400)Figure 1 Immunohistochemical examination figure of ICAM-1 A:cranial aneurysm;B:normal cranial artery (×400)

图2 NF-KB免疫组化检测 A:颅动脉瘤;B:正常颅动脉(×400)Figure 2 Immunohistochemical examination figure of NF-KB A:cranial aneurysm;B:normal cranial artery (×400)

图3 MCP-1蛋白Western-blot法检测 A正常颅动脉;B颅动脉瘤(×400)Figure 3 Western-blot analysis figure of MCP-1 protein A:cranial aneurysm;B:normal cranial artery (×400)
3 讨论
作为导致SAH疾病的“主要凶手”,IA在全球范围内有着较高的感染患者,其中出现动脉瘤破裂症状的患者比例达到了2%左右[13-15],而其中由于首次出血导致患者死亡的几率达到了20%,且50%以上的幸存患者伴留肢体麻木、瘫痪等后遗症[16-17]。对此,医学界学者对其具体病发机制及病情进行深入研究。血流动力学导致的血管重塑功能改变、血管壁弹力降低以及患者的身体机体改变(炎症、动脉粥样硬化等)等因素的影响,均对IA的形成和破裂有着一定的影响[18-21]。BOUSSEL等[22]研究发现,IA在整个病程中,动脉瘤的血流方式较为复杂,其中血流的不稳定更是容易引发其破裂。一旦血流动力学的改变超出了血管重塑的能力,患者颅动脉瘤的血管壁就会逐步的降解,并且膨胀,导致IA破裂。KANEMATSU等[23]研究发现巨噬细胞对颅内动脉瘤的形成有着极为关键的作用。
ICAM-1是免疫球蛋白超基因家族主要成员之一,在多种细胞表面均有表达[24-26],研究发现,其在腹主动脉瘤血管内皮细胞的表达水平远远高于正常内皮细胞表达水平[27-29],在腹主动脉的炎症发作和破裂中占据重要作用[30-32],且在脑动脉瘤劈裂出血患者的脑脊液和血液中的含量显著增高[33-35];MCP-1是一种具有较强作用的单核巨噬细胞趋化因子[36-38],对单核巨噬细胞、T淋巴细胞有一定的趋化作用[39-41],并且同时也是一种重要的组胺释放因子[42-46]。单核巨噬细胞作为动脉瘤中的重要炎性细胞之一,对多种活性物质可以分泌基质金属蛋白激素[47-51],除此之外,MCP-1可以促进单核巨噬细胞向病变部位移动、促进,并且随着MCP-1的水平提升[52-56],单核巨噬细胞不断增多聚集,导致动脉瘤炎性症状[57-62],动脉血管本身弹性不断降低,结果导致动脉瘤破裂[63-64]。NF-KB是一种多极性基因调控蛋白,参与许多与免疫、炎症等反应相关基因的表达[65-67],是炎症反应的调控因子[68-69]。本实验结合IA病发机制和相关因子表达关系,选择ICAM-1、MCP-1、和NF-KB作为检测指标,观察三种蛋白质在颅动脉瘤中的表达。免疫组化结果发现,ICAM-1、NF-KB两种蛋白在颅动脉瘤组均有显著的阳性反应,且MD值分别达到了(0.294±0.035)、(0.354±0.025),而正常颅动脉组免疫组化图片显示了较微弱的阳性反应,且MD值分别仅为(0.083±0.020)、(0.092±0.041),相比之下,存在显著性的差异(P<0.05);Western-blot法检测结果显示,颅动脉瘤组标本中MCP-1蛋白表达明显较正常颅动脉组多,MCP-1值为(1.80±0.25),与正常组比较差异有统计学意义(P<0.05)。
相比于正常颅动脉,MCP-1、ICAM-1和NF-KB三种蛋白在颅动脉瘤中有着较高的表达,水平含量均明显高于正常组,可推测这三种蛋白的高表达可导致IA的形成以及破裂,为临床诊断提供一定的依据。
