多学科诊治可切除性结直肠癌肝转移一例报道
2019-06-21周建凤周炜洵高鑫杜顺达吴斌
周建凤 周炜洵 高鑫 杜顺达 吴斌
结直肠癌肝转移治疗策略的制定是晚期肠癌研究的热点和难点,其中可切除的同时性肝转移患者如何根据具体情况制定个体化治疗策略更是具有争议的话题。本文将就一例结肠癌术后可切除性肝转移合并直肠癌的患者在多学科诊疗中的一些体会和大家来分享。
一、病例简介
男性,65岁,主诉“左半结肠癌术后31个月,肝转移21个月,诊断为直肠癌18个月”。患者既往有高血压、高血脂、脑出血和脑梗塞史,遗留右侧肢体麻木。患者于2014年9月因大便习惯改变、体重下降就诊于外院,查CEA30.3 ng/mL,结肠镜及活检病理提示降结肠腺癌、直肠远端多发腺管状腺瘤,影像评估未见远处转移。2014年9月下旬于外院行腹腔镜乙状结肠癌根治术,术后病理示左半结肠中低分化腺癌,pT3N2a,基因检测提示:KRAS第2外显子12、13密码子野生型,BRAF V600E野生型。术后CEA降至正常,至2015年1月XELOX辅助化疗3周期后自行停药。2015年7月CEA升高至7.8 ng/mL,腹部超声提示右肝转移瘤,患者未进一步诊治。
二、诊治经过
2015年12月就诊北京协和医院,查CEA 44.4 ng/mL,胸腹盆增强CT示右肝4.7 cm转移瘤,双肺多个微小结节,直肠肠壁无明显增厚。肠镜及活检病理示直肠距肛门10 cm处中分化腺癌、直肠远端多发腺管状腺瘤。诊断:(1)左半结肠癌Ⅲb期根治术后肝转移,(2)上段早期直肠癌cTxN0。建议多学科诊治,患者因家事未采纳。至2016年8月,患者因排便次数增多伴体重下降再次就诊,查CEA 133.7 ng/mL,胸腹盆增强CT示右肝9.8 cm转移瘤、双肺微小结节较前无变化、直肠壁局部增厚,肠镜及活检病理仍示直肠距肛门10 cm处腺癌。2016年9月初经本院第一次结直肠癌多学科协作团队讨论,考虑患者诊断Ⅲb期结肠癌术后单发9.3 cm肝转移,同时合并局部分期早的直肠癌,患者ECOG评分1分,技术层面肝转移和直肠癌均属可切除性,治疗目标为治愈意向的无瘤状态,结合患者意愿建议FOLFOX新辅助治疗4周期后进行评估和决定局部治疗方式。2016年9月底至11月中行FOLFOX化疗4周期。化疗前,9月中旬,患者CEA进一步升至177.7 ng/mL,CT较8月原肝转移灶增大至10 cm,其附近新见一直径1 cm转移瘤。4周期化疗后CEA降至75 ng/mL,CT示新发小转移灶消失、原10 cm病灶缩小至6.4 cm,评估疗效部分缓解(PR)。2016年12月初多学科协作团队随诊建议完善直肠、肝脏核磁,除外局部晚期直肠癌和肝脏其他转移病灶后手术治疗。2016年12月19日直肠核磁考虑直肠病变T1N0,2017年1月11日肝核磁证实仅存右肝6.2 cm转移灶。在术前准备期间又进行FOLFOX化疗3周期。患者于1月18日行腹腔镜探查转开腹右肝联合肝段切除术,术后病理右肝转移性中低分化腺癌,CDX2(+)。术后恢复好,CEA降至5.4 ng/mL。2月23日行开腹直肠癌扩大根治、乙状结肠腹壁造口术,术中见腹腔粘连严重,术后病理示直肠中分化腺癌ypT2N0。两次病理中肿瘤退缩分级AJCC/CAP均为Ⅲ级、反应差。术后CEA降至正常,胸腹盆增强CT及肝脏核磁未见转移灶,考虑无瘤状态,完成围手术期FOLFOX化疗后,随诊观察。见图1。
三、讨论
本例患者属于可切除的结直肠癌肝转移,治疗目标应是治愈目的的无瘤状态,外科手术是其最重要的根治方法。然而,并非所有患者都能长期生存,尤其是术后早期复发的患者整体生存明显低于远期复发人群。
新辅助治疗能否减少术后复发、延长生存目前还存在一定争议。新辅助化疗理论上具备以下价值:(1)缩小肿瘤、杀灭微小转移,降低肿瘤的早期复发率;(2)检验治疗方案的有效性,为术后治疗提供参考;(3)筛选肿瘤生物学行为,避免无效手术。临床研究方面,在新辅助化疗对比单纯手术治疗可切除性结直肠癌肝转移患者的随机临床试验EPOC研究中[1],围手术期化疗较对照组提高3年无疾病生存率,但5年总生存率没有差异。但该试验入组的大部分为低复发风险患者,对照组中位总生存率达到54.3个月,在这样预后相对良好的患者人群中新辅助化疗获益不会太明显,而且该研究中化疗完成率偏低,可能也是最后总生存率结果阴性的原因之一,因此试验总生存结果阴性并不令人意外。而不少回顾性研究和荟萃分析结果提示对复发风险评估高危的患者新辅助治疗可改善预后。临床上对可切除的肝转移患者通常采用纪念斯隆-凯特林癌症中心(MSKCC)的临床危险评分法[2]。2015年欧洲的一项回顾性分析中[3],对高危患者(临床危险评分3~5分)新辅助化疗可显著延长无疾病生存率和总生存率。2016年北京大学肿瘤医院的一项荟萃分析中[4],不区分复发风险程度时新辅助治疗未能改善患者预后,但对于复发风险高的患者,新辅助治疗后降低死亡风险31%。因此,应根据可切除性肝转移患者复发风险评估来决定是否需要新辅助治疗,高危患者应行新辅助治疗。而本例患者最大转移灶远大于5 cm、原发灶术后12个月内肝转移、原发灶淋巴结阳性,临床危险评分3分,属于高危,因此我们多学科协作团队建议新辅助治疗。而事实上,患者2016年8月至9月短短1个月内出现新病灶,如果此期间直接手术,患者会因短期内出现新发病灶而属于早期复发治疗失败的患者。
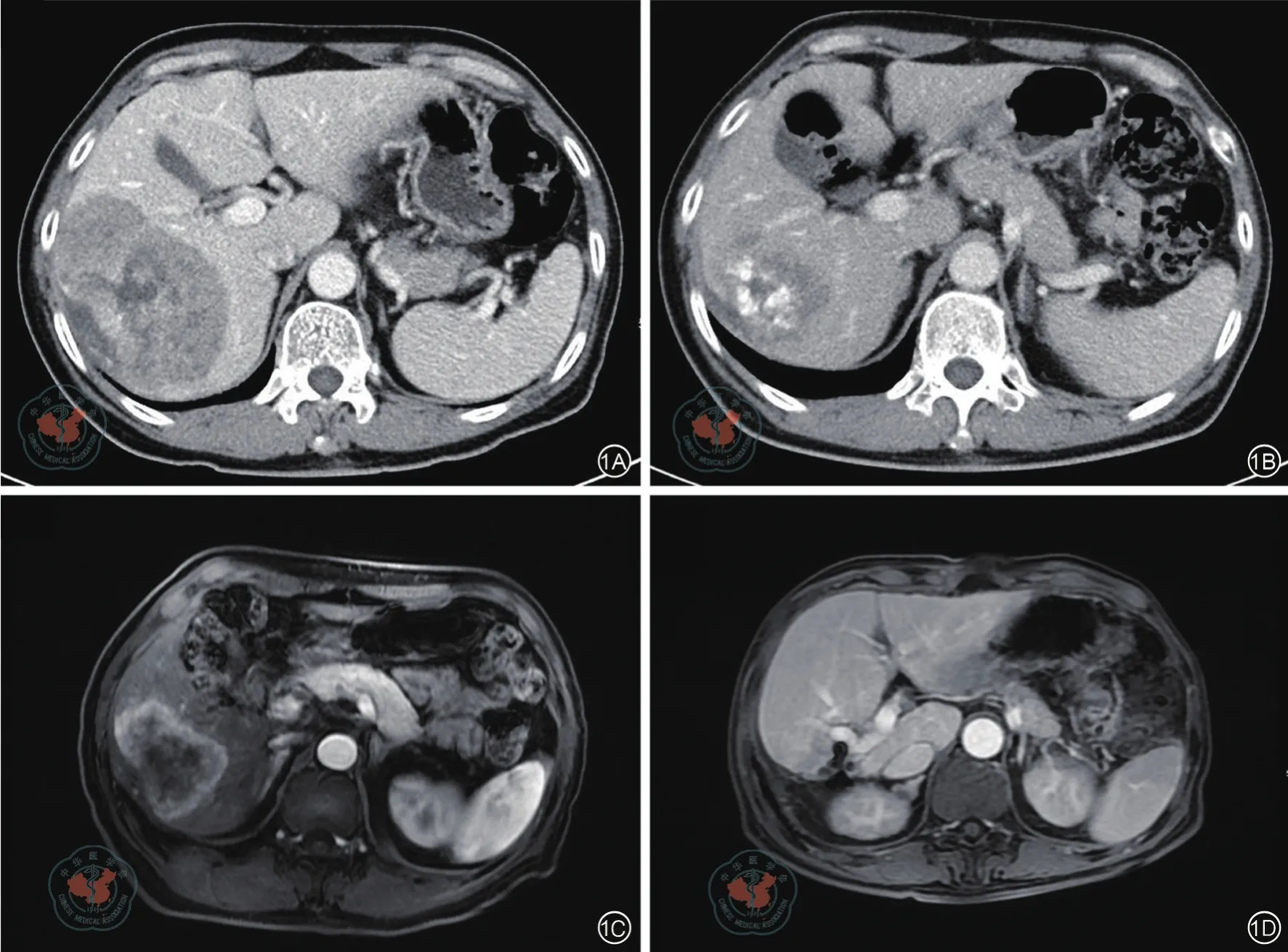
图1 肝脏影像。1A:2016年9月(化疗前)增强CT门脉期,1B:2016年11月(化疗4周期后)增强CT门脉期,1C:2017年1月(肝脏术前)肝脏增强MRI T1加权相;1D:2017年3月(肝脏术后)肝脏增强MRI T1加权相
新辅助治疗方案中,是否在化疗基础上加靶向药物更是比较有争议的话题。对比围手术期应用西妥昔单抗联合化疗和单纯化疗的NEW EPOC试验[5],西妥昔单抗联合组反而结果更差,但是该研究在纳入人群、数据完整性、肝外手术质控等方面存在争议,结果应谨慎看待。NCCN2017年指南删除了新辅助治疗中联合靶向药物,而2016年ESMO共识指南文字部分指出对可切除的预后差的患者可考虑联合了靶向药物的高效方案[6]。由于这方面缺乏循证医学证据,加之本例患者因自身经济上没有应用靶向药物条件,多学科协作团队仅建议新辅助化疗。患者最终取得了影像上PR的疗效,但是肿瘤病理退缩反应差。这种影像和病理学评估结果不一致现象随着新辅助和转化治疗应用越来越广泛而逐渐受到重视。比利时的一项回顾性研究发现一半左右影像学缓解患者病理无缓解,而病理学分级是影响总生存率的独立因素[7]。反思本例,如果新辅助治疗联合靶向药物,或许能最大程度获得更好的肿瘤病理退缩,进一步改善预后。
在结直肠癌的诊治过程中,还要警惕肿瘤多中心起源的情况,这类患者的比例似有增高的趋势。从整体病程中我们可以判断本例患者肝转移为乙状结肠癌转移的可能性大,而直肠癌为第二肿瘤。
综上,本例患者为高复发风险的可切除性结肠癌肝转移,同时合并早期直肠癌,经新辅助化疗和分次手术后达到了无瘤生存的预期目标,诊治中充分体现了多学科协作的重要性和优势。
