低位直肠癌切除术后影响功能因素分析及对策
2019-06-21朱晓明张卫
朱晓明 张卫
结直肠癌是常见的消化系统恶性肿瘤,全球每年新发病例120万;结直肠癌的发病率在西方发达国家位于恶性肿瘤第2位,在我国位于第3位[1]。我国以直肠癌为多见,占结直肠癌发病率的60%,且多数是位于腹膜返折以下的低位直肠癌。全直肠系膜切除术(total mesorectal excision,TME)理念的提出和远切缘理论的发展使得越来越多的结直肠外科医师能够在根治肿瘤的同时为患者保留肛门,然而保肛患者术后的生活质量却常常被忽视。已有研究显示,低位吻合的患者易出现大便频繁、大便急迫感、控便功能差等前切除综合征[2],严重影响患者生活质量。在专科化程度越来越高的今天,如何在追求根治性的前提下提高保肛患者术后肛门功能、改善生活质量必须成为结直肠外科医师的治疗理念。
笔者认为,正常的排便机能取决于3个方面:(1)直肠壶腹的储存功能;(2)完整且功能正常的肛门括约肌;(3)直肠的神经支配。但无论何种手术方式都会对上述功能造成一定损伤,从而影响肛门功能。那么如何尽可能降低手术对上述功能的影响,笔者有如下几点思考。
一、保留更多的直肠及齿状线
在低位直肠癌手术中保留更多的直肠及齿状线,远切缘至关重要。一方面足够的远切缘是保证肿瘤学安全性的基础,另一方面笔者又想要远切缘尽量远离肛门从而保留更多的直肠及齿状线。然而远切缘安全距离的争论从未停止:Dixon[3]提出的直肠癌经腹前切除术使得很多直肠癌患者得以保留肛门,但基于Grinnell[4]提出的“直肠癌远端侵犯5 cm”原则,教科书规定距肛缘7 cm~8 cm以内的直肠癌仍需行经腹会阴联合切除术(abdominoperineal resection,APR)。后来研究发现直肠癌很少向远端浸润,并且远切缘2 cm与5 cm的局部复发率和总体生存率差异无统计学意义[5-6],因而远切缘2 cm成为金标准。进一步的研究发现,绝大部分低位直肠癌向远端浸润的距离小于1 cm,认为远切缘1 cm已经足够[7]。Bujko等[8]对17项随机研究的荟萃分析结果显示,远切缘<1 cm(948例)与>1 cm(4 626例)的局部复发率和总体生存率差异无统计学意义。笔者认为,对于低位特别是极低位直肠癌,靠近齿状线处的远端肠管可谓“寸土寸金”,在遵循TME原则的前提下保证远切缘1 cm已经足够。正是由于远切缘的深入研究,低位直肠癌保肛术式才会丰富起来,但由于各种原因,目前在临床中广泛开展的低位保肛术式主要是低位前切除术(low anterior resection,LAR)和经括约肌间切除术(intersphincter resection,ISR)。学者Rullier等[9]为规范低位直肠癌的手术方式,根据肿瘤与肛门括约肌的关系将低位直肠癌分为4型。Ⅰ型:肿瘤下缘距肛管直肠环>1 cm;Ⅱ型:肿瘤下缘距肛管直肠环<1 cm;Ⅲ型:肿瘤侵犯肛门内括约肌;Ⅳ型:肿瘤侵犯肛门外括约肌或肛提肌。针对上述4种类型分别采取LAR、pISR、tISR及APR手术(图1),随访结果提示在局部复发率、远处转移率、总体生存期及无病生存期等肿瘤学安全性方面,前3种保肛术式间的差异无统计学意义。但ISR本身切除部分甚至全部内括约肌的手术方式对术后肛门功能有一定影响,多项研究显示ISR术后患者的控便能力及生活质量明显不如LAR[10-11]。如何在此基础上保留更多的直肠及齿状线以改善术后肛门功能呢?笔者认为,对于Ⅱ、Ⅲ型低位直肠癌,未受到肿瘤侵犯的对侧肠管及内括约肌可予以保留。在此理念的指导下,笔者总结了多种术式的优势后开展了“拖出式适形切除术”这一低位保肛新术式,即经腹部按TME原则将直肠分离至括约肌间沟,再将肠管翻出肛门,在直视下保证肿瘤远切缘至少1 cm,然后根据肿瘤位置设计切除线,总体是从肿瘤侧斜行向上到达对侧,使对侧远端保留更多的括约肌和齿状线。吻合时,将近端结肠吻合在直肠保留较多的一侧,使吻合口尽量远离齿状线(图2)。目前初步随访的肿瘤学效果较为满意,局部复发率及远处转移率分别为3.45%和10.34%,与同期行LAR及APR的患者差异无统计学意义(P值分别为0.519和0.434),同时肛门功能与行LAR的患者差异无统计学意义[12]。曾有学者对本术式中斜行切除的距离提出疑问,他们通过病理学研究发现[13],低位直肠癌沿肠壁侧方浸润的距离极少超过5 mm,而笔者术中的斜行切除线距肿瘤至少1 cm,完全可以保证侧切缘的阴性。事实证明,这种保留更多齿状线和内括约肌的适形切除术是可行的。
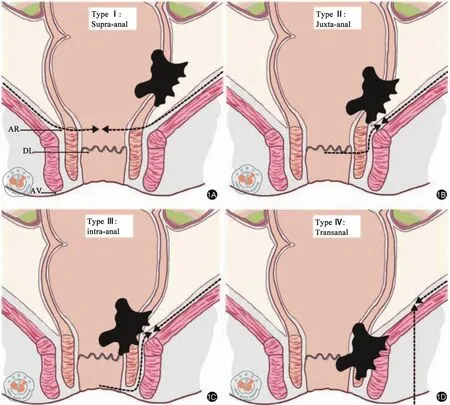
图1 Rullier低位直肠癌外科学分型。1A:Ⅰ型:肿瘤下缘距肛管直肠环>1 cm;1B:Ⅱ型:肿瘤下缘距肛管直肠环<1 cm;1C:Ⅲ型:肿瘤侵犯肛门内括约肌;1D:Ⅳ型:肿瘤侵犯肛门外括约肌或肛提肌

图2 极低位直肠癌拖出式适形切除示意图。2A:将肠管翻出肛门,在直视下保证肿瘤远切缘至少1 cm,根据肿瘤位置设计斜行切除线,总体是从肿瘤侧斜行向上到达对侧,使对侧远端保留更多的括约肌和齿状线。2B:间断缝合残端。2C:吻合时,将近端结肠吻合在直肠保留较多的一侧,使吻合口尽量远离齿状线
二、更好地保护神经
日本学者在1983年就提出了保留盆腔自主神经的直肠癌根治术[14],特别是在男性患者中,狭小的骨盆增加了手术难度,盆腔自主神经的损伤还易引起术后泌尿生殖系统功能障碍。随着腹腔镜在直肠癌手术中的广泛应用,借助腹腔镜技术的优势,行TME的同时保护盆腔自主神经已在学界形成共识[15]。众所周知,在腹主动脉分叉稍下方的上腹下丛发出左、右腹下神经向下进入盆腔,然后与来自S2、S3、S4的副交感节前纤维和骶交感干的节后纤维共同在下1/3段直肠的侧方所组成的“神经板”即是下腹下丛,也称为盆丛。盆丛发出的神经纤维及来自髂内动脉的血管穿过盆内筋膜从后外侧进入精囊腺、前列腺。直肠后方的神经保护较为简单,即按照TME原则在直肠固有筋膜与骶前筋膜之间的间隙中进行游离,可清晰地见到左右两侧腹下神经在骶前筋膜的后方进入盆腔。而直肠前方的神经保护则尚存在争议,争议的焦点在于Denonvilliers筋膜。笔者通过尸体解剖发现,打开腹膜返折后,在精囊腺和直肠前壁之间存在一个无血管无神经的天然间隙,其间可见“发丝样”的纤维组织。间隙的后方是包绕直肠系膜的直肠固有筋膜,前方就是Denonvilliers筋膜,它在精囊腺后方较为游离,向下则与前列腺贴合紧密(图3)。再从前方移除精囊腺和部分前列腺,打开Denonvilliers筋膜后笔者发现,来自两侧的神经和血管均位于Denonvilliers筋膜的前方,并且左右神经之间还各自存在交通支(图4)。可见Denonvilliers筋膜是在精囊腺和前列腺后方保护这些神经血管的重要屏障,在直肠前方的游离应在直肠固有筋膜和Denonvilliers筋膜之间的直肠前间隙中进行,这样才能实现对神经的保护。但在实际手术过程中,笔者很难直接进入直肠前间隙,由于Denonvilliers筋膜在精囊腺后方较为游离,且两者之间并无神经及血管,故通常笔者先在Denonvilliers筋膜的前方游离,然后在接近精囊腺尾部时打开Denonvilliers筋膜进入直肠前间隙。
三、个体化新辅助放疗
新辅助放疗在直肠癌的治疗中的作用非常重要,它能使肿瘤降期从而获得更好的临床肿瘤学效果[16]。2016年NCCN指南对于cT3N0的患者就开始推荐使用术前短程放疗。除了提高肿瘤学安全性,新辅助放疗还能使肿瘤退缩从而远离肛门,增加了低位直肠癌的保肛率。但是,不能忽视新辅助放疗对肛门功能的影响。20世纪90年代就有学者指出,放疗对肠壁及肛门括约肌的损伤会导致控便能力下降[17]。Stephens的CR07研究结果显示新辅助放疗对患者术后控便能力的影响较为显著[18]。笔者曾对比接受新辅助放疗患者与未接受新辅助放疗患者肛门括约肌的大体形态及超微结构,发现两者的大体形态虽无明显区别,但接受新辅助放疗患者肛门外括约肌肌肉的超微结构均受到不同程度的破坏[19](图5)。对于接受一些超低位直肠癌保肛手术的患者,其肛门内括约肌会被部分或全部切除,因而肛门外括约肌在术后维持肛门自制方面会起到非常重要的作用,而新辅助放疗对括约肌的损伤可能会使这部分患者术后面临控便能力不佳的情况。所以对于新辅助放疗后行保肛手术的患者一方面需要术前充分评估其肛门功能,另一方面改进放疗方法,适当地保护肛门括约肌势在必行。

图3 直肠前间隙。打开腹膜返折后,可见位于覆盖在直肠表面的直肠固有筋膜和其前方的Denonvilliers筋膜,两者之间是一无血管神经的“裸区”(直肠前间隙),是行TME时应走行的平面。1:直肠固有筋膜;2:Denonvilliers筋膜;3:精囊腺;4:腹膜返折;5:髂内动脉前干分支血管;6:闭孔动脉分支;7:来自盆丛的神经纤维。5、6、7共同构成位于前列腺后外侧、直肠系膜前外侧的神经血管束

图4 Denonvilliers筋膜前方的神经交通支。在前方移除精囊腺和部分前列腺后,可见来自盆丛神经在Denonvilliers筋膜前方发出分支支配前列腺和精囊腺,并有着细小的交通支。1:前列腺;2:两侧盆丛;3:Denonvilliers筋膜;4:位于Denonvilliers筋膜前方的神经交通支

图5 新辅助治疗组与对照组EAS的超微结构观察。新辅助治疗组中可见:5A:大片肌纤维、肌节、线粒体溶解,糖原颗粒分布不均(×2 000);5B:肌节排列紊乱,线粒体嵴消失(×3 000);5C:Z线、M线、A带、I带消失(×3 000);5D:肌纤维和肌节坏死后被胶原纤维填充(×5 000),对照组则未见上述改变;5E:肌纤维、肌节排列整齐(×1 000);5F:Z线、M线、A带、Ⅰ带清晰可见(×3 000);5G-H:糖原分布均匀,线粒体嵴及外膜完整(×5 000)
四、开展保直肠治疗
近年来,根治性手术所带来的术后并发症及肛门功能问题引发了人们对保直肠治疗的思考和关注。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南就推荐对cT1N0的直肠癌患者可采用局部切除+长期随访的治疗方法。由于辅助治疗手段的丰富,许多cT2-3、N+的患者在经过新辅助治疗后原发肿瘤能够达到缓解甚至完全临床缓解,这部分患者是否有必要行根治性手术值得思考。Lezoche等[20]及Garcia-Aguilar等[21]研究发现cT2期患者经新辅助治疗后肿瘤的缓解率较高,且局部切除的肿瘤学效果与经腹行TME手术相当。笔者认为,局部切除的风险主要在于无法进行区域淋巴结清扫,为肿瘤的复发及转移埋下隐患,为此笔者分析了自己所在医院的576例T1和T2期直肠癌患者的临床病例资料,发现肿瘤分化差、术前CEA水平异常、溃疡性肿块的T1期直肠癌发生淋巴转移的风险较高,可作为判断是否适宜行局部切除的参考指标[22]。Habr-Gama等[23]还采取了更为积极的“Watch and Wait”策略,即对经过新辅助治疗后达到完全临床缓解的低位直肠癌患者(cT2-4N0-2M0),以密切的观察随访取代根治性手术,其研究结果显示在完全临床缓解的患者中,51%的患者在无需手术的情况下无病存活超过12个月。虽然这项研究还需要更大的样本量及更长的随访时间来验证其安全性及可行性,但这种“Watch and Wait”的策略在低位直肠癌的治疗中不失为一条值得探索的道路。
综上,笔者认为,在低位直肠癌保肛治疗中笔者还有很多需要解决的问题。在目前的治疗理念和手段下,应充分发挥多学科诊疗的优势,为患者制定最佳的个体化治疗方案,同时普及肠癌筛查,做到早发现、早诊断、早治疗,探索保器官、保直肠领域的研究,最大程度降低手术引起的功能影响。
