“起源胃壁强化征”辅助CT诊断胃外生型胃肠间质瘤
2019-06-21付佳唐磊李健李子禹李英李晓婷孙应实沈琳
付佳 唐磊 李健 李子禹 李英 李晓婷 孙应实 沈琳
胃肠间质瘤(gastrointestinal stromal tumor,GIST)是胃最常见的间叶组织来源肿瘤[1]。影像学检查是胃GIST疗前诊断和评估的重要手段,其中CT因兼顾循证证据与可及性、普适性,作为GIST定性定位、诊断与鉴别诊断的常规方法[2]。胃GIST在CT上根据与胃壁的相对位置关系分为四型:I型为壁间型,Ⅱ型为腔内型,Ⅲ型为腔外型,IV型为哑铃型[2-3]。当Ⅲ型GIST腔外生长明显且与临近脏器间脂肪间隙消失时,可能导致起源脏器判断的偏差,进而出现误诊的结果。Kim等[4]于2014年JCAT杂志发文提出通过CT判断肿瘤供血来源的方法鉴别小肠GIST与其他腹腔间叶源性肿瘤。本文拟通过回顾分析一组Ⅲ型胃GIST与周围脏器(主要是胰腺)脂肪间隙消失而需鉴别的病例,初步探讨GIST起源胃壁强化特征在鉴别诊断中的意义。
材料与方法
一、临床资料
回顾分析本院经手术病理证实的Ⅲ型胃GIST病例18例,及与胃壁脂肪间隙消失的邻近脏器来源肿瘤16例(胰腺神经内分泌瘤6例,胰腺实性假乳头状8例,肝癌2例)。
入选条件:(1)上腹部肿瘤,经手术切除且有确切的术后病理;(2)术前行腹部CT双期增强扫描,扫描范围包含肿瘤及邻近脏器整体;(3)肿瘤同时与胃及胃周至少一个脏器脂肪间隙消失且关系密切,造成起源判断困难,术前影像学未能给出确切诊断。
符合GIST入组条件者18例,其中男性9例,女性9例,中位年龄54岁,范围21~75岁,肿瘤最大直径中位值9.4 cm,范围3.4 cm~28.4 cm。对照组16例,术前影像诊断均不除外GIST,手术病理证实为胃周围脏器起源的肿瘤性病变,其中男性7例,女性9例,中位年龄42岁,范围21~72岁,平均最大直径为9.3 cm,范围5.6 cm~13.4 cm。
二、CT扫描方案
扫描前处置:禁食水8 h以上,怀疑胃部病变者,如无禁忌证则在检查前10~15 min肌注盐酸消旋山莨菪碱(654-2,杭州民生药业)10 mg,确认低张起效后口服发泡剂3~6 g,之后立即转为仰卧扫描体位;快速呼吸训练1~2次,保证吸气末屏气效果。
常规仰卧位采用多排螺旋CT扫描,扫描范围自膈顶至盆底。扫描参数:管电压120 kV,管电流采用自动毫安技术,探测器准直64 mm×0.625 mm,螺距0.984:1,扫描层厚5 min,重建层厚0.625 mm。经肘正中静脉注射非离子型碘对比剂,根据患者体重调整注射量(2 mL/kg),浓度300 mgI/mL,注射速率3.5 mL/s,于注射后40 s及70 s分别行动脉期及静脉期扫描。
三、图像后处理及征象分析
薄层图像传输至影像后处理工作站,由两名医师盲法评估。联合轴位、冠状位及矢状位观察病变影像学征象并记录。薄层图像观察记录与肿瘤贴邻的胃壁是否存在“起源胃壁强化征”及“坏死囊变极性”。“起源胃壁强化征”定义为动脉期肿块相邻的胃壁强化增高,主观判断高于周围正常胃壁的强化程度。“坏死囊变极性”指坏死囊变成分分布的偏向性,观察囊性坏死成分主体偏向胃侧或偏离胃侧,抑或无极性分布特征。动态调窗扩大胃壁及肿块内部强化成分的对比显示。
四、统计学分析
统计数据用SPSS 22.0统计软件进行处理。连续变量采用非参数分析(Mann-Whitney U test),非连续变量的差异采用Fisher确切概率法比较,双侧P<0.05有统计学意义。
结 果
两组间影像学特点如表1所示。GIST平扫实性成分平均CT值约44.2 HU,范围41~58 HU,对照组平均CT值约41.9 HU,范围31~63 HU。两组间肿瘤的长径(Z=-0.587,P=0.570)、动脉期(Z=-0.829,P=0.412)及静脉期(Z=-1.450,P=0.147)平均CT值的差异均不具有统计学意义。CT显示胃与胰腺、脾及肝脏脂肪间隙均消失者3例,均为对照组。3例GIST口服了阳性造影剂,遮蔽胃壁无法判断强化情况,排除出组;其余病例起源胃壁强化征出现率的比较发现,GIST动脉期肿块相邻胃壁局限高强化比例(9/15)高于其他脏器来源肿瘤(0/16)(图1),差异具有统计学意义(χ2=12.857,P=0.007)。坏死囊变极性观察,GIST组较非GIST组坏死囊变成分更多分布于偏离胃壁较远的肿瘤组织内,但差异无统计学意义(χ2=5.947,P=0.051)。

图1 起源胃壁强化征及坏死囊变极性在胃及胰腺肿瘤的分布特征。病例1,1A:胃脾之间肿块,不均匀强化,与胃及脾脂肪间隙均消失;1B:病变局部放大图像,显示增强扫描动脉期肿块相邻胃壁线样高强化,强化幅度高于邻近正常胃壁;另见变性低强化成分偏离胃壁侧分布为著;1C:术后病理诊断GIST。病例2,1D:胃胰之间肿块,不均匀强化,与胃及胰腺脂肪间隙均消失;1E:病变局部放大图像,显示增强扫描动脉期肿块相邻胃壁未见明确强化增高征象,强化幅度与邻近正常胃壁同步;坏死低强化成分分布未见明确极性;1F:术后病理诊断胰腺实性假乳头状瘤SPT。病例3,1G:胃胰之间肿块,不均匀强化,与胃及胰腺脂肪间隙均消失,与胰腺接触面积较广、大于与胃壁接触面;1H:矢状位病变局部放大图像(厚层MIP重建图像),显示增强扫描动脉期肿块相邻胃壁线样高强化,强化幅度高于邻近正常胃壁;坏死低强化成分偏离胃壁侧分布为著;lI:术后病理诊断GIST
讨 论
胃肠间质瘤可发生于胃肠道的各个部位,其中胃部最为常见[5]。研究总结GIST的CT典型征象包括:类圆形实性软组织肿块,边界清晰锐利,可突向腔内外生长,富血供,增强扫描呈明显强化,静脉期延迟强化,肿瘤内部常发生坏死、出血、囊变等导致强化不均[6-8]。胃周围毗邻脏器众多,包括胰腺、脾脏、肝脏、肾上腺等[9],GIST外生为主且体积较大时,压迫邻近脏器,脂肪间隙消失,可能会导致起源判断的困难[8]。本组资料显示,胃外生型GIST常需与胰腺来源肿瘤(n=14/16)鉴别,尤其同样呈肿块样形态,可出现坏死囊变的实性假乳头状瘤SPT及胰腺神经内分泌肿瘤NEN。
Kim等[4]在一组GIST研究中发现,肿瘤的供血动脉起源及可辅助辨别腹盆腔肿瘤的脏器起源,译为本源供血动脉征。本研究发现肿瘤相邻胃壁出现高强化者,全部发生于胃GIST,推测可能胃GIST为富血供肿瘤,肿瘤对血供需求高导致供血量增加;而GIST起源于胃壁肌层的Cajal细胞[4,10-12],其初始血供来源于胃壁内血管,供血量增加继而导致起源区域胃壁内血管的扩张增粗,明显者便会出现CT上肉眼可辨的强化升高,高于邻近正常胃壁的征象。而对照组胰腺和肝脏起源的肿瘤均未观察到此征象,说明该征象区分GIST和邻近脏器起源肿瘤时具有较高的特异性。本研究中有6例GIST并未观察到胃壁强化,考虑可能与供血动脉扩张程度较轻有关,导致鉴别诊断的敏感性不高,结合双能CT或MRI多期动态增强可能会提高这一征象的显示率(图2)。
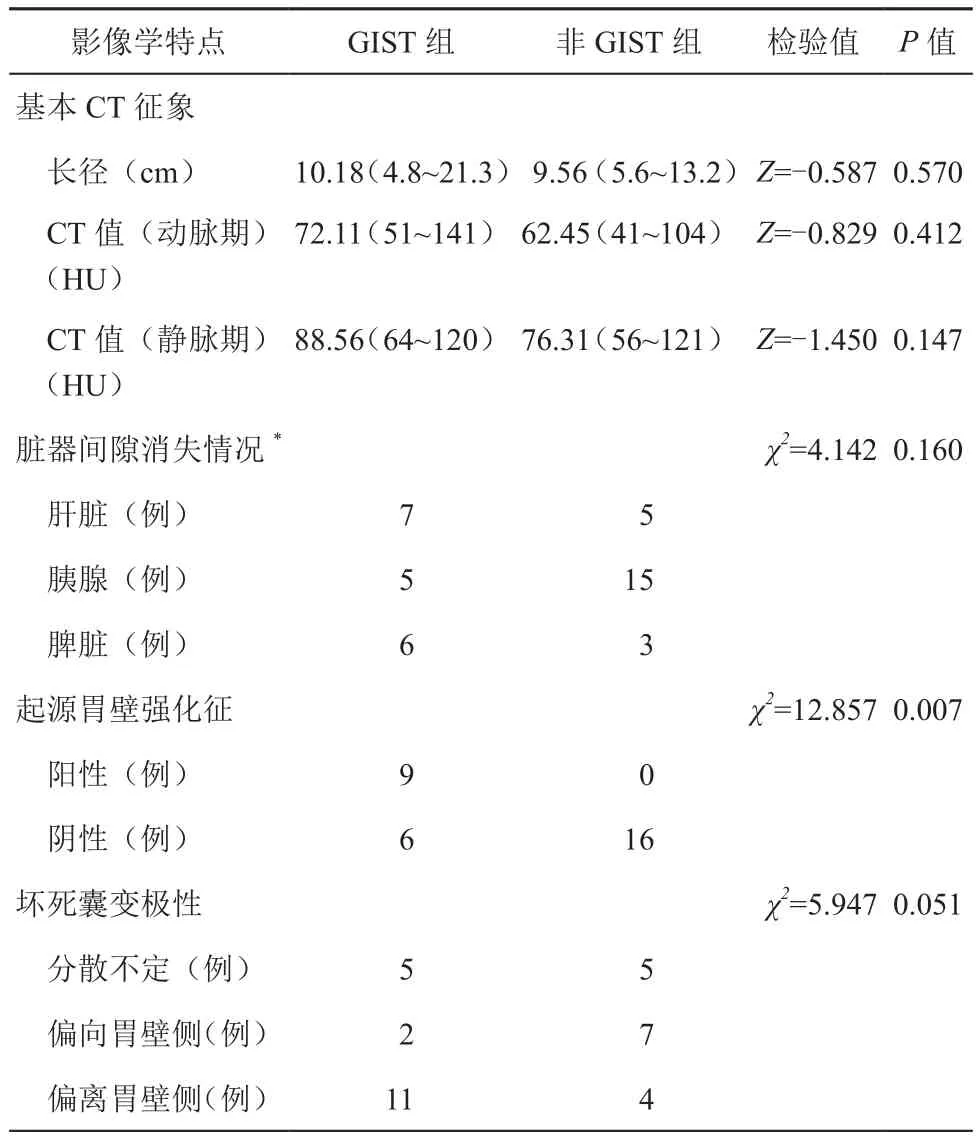
表1 GIST组与对照组的影像学特点
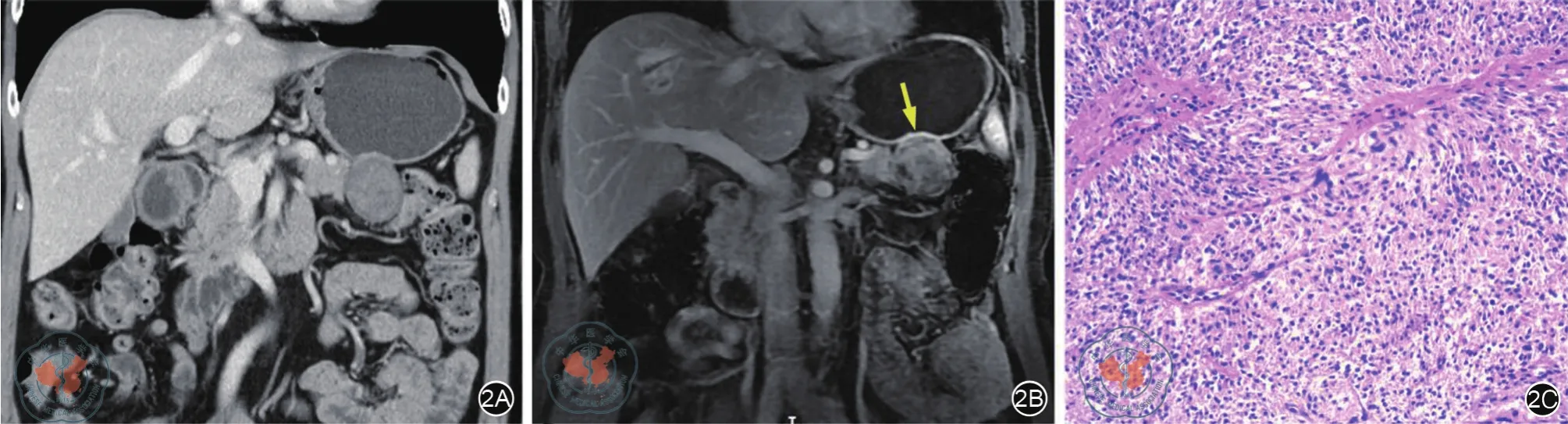
图2 CT及MRI对起源胃壁强化征显示能力的比较。2A:增强CT冠状位示胃胰之间肿块,相邻胃壁未见明确高强化;2B:同一患者相同层面MRI冠状位增强扫描,显示相邻胃壁明显高强化,强化幅度高于邻近正常胃壁;2C:术后病理诊断GIST
本研究同时探索了GIST和其他脏器来源肿瘤坏死囊变成分极性分布的差异,结果发现GIST坏死囊变成分多偏离胃壁侧。坏死囊变的形成可能和肿瘤生长速度与血供不平衡有关[12]。胃GIST多由胃壁侧动脉供血,理论上越接近胃壁的区域则血供相对丰富,肿瘤因缺血导致变性的概率相对较小;而远离胃壁侧血供相对较少,肿瘤实质与血供不匹配而易于出现坏死囊变。但本组数据差异无统计学意义,推测一方面与数据量少相关;另一方面可能与GIST本身生物学行为特性相关[13-14]。
本研究存在局限性:首先,由于充盈后正常胃壁菲薄,多小于5 mm,导致无法准确测量CT值,只能通过主观判断的方式评价起源胃壁高强化征象,可能导致一定的判断误差;第二,本研究样本量较少,可能是导致部分征象如囊变极性在两组间未出现统计学差异的原因,后续还需扩大样本进一步验证;第三,作为回顾性分析,部分前处置准备不够严格,有3例因口服阳性对比剂,胃壁遮蔽效应导致强化程度判断不清,否则起源胃壁强化征的比例可能更高。
