miR-9-5p通过靶向FOXO1基因调控食管癌细胞增殖、侵袭和迁移
2019-06-21时军利王春青何培元李炳庆
时军利, 王 磊, 王春青, 李 萍, 何培元, 李炳庆
承德医学院附属医院消化内科,河北 承德 067000
食管癌是世界范围内最常见的消化道恶性肿瘤,其死亡率较高,是癌症死亡的第六大原因。食管癌在确诊时通常处于晚期,患者预后不良,5年生存率低于10%[1]。越来越多的研究表明,食管癌患者的生存率较低,与局部侵袭和远处转移密切相关[2-3]。因此,深入探讨食管癌的发病机制有助于食管癌早期诊断和临床治疗相关分子靶点的开发。微小RNA(microRNA,miRNA)是一类内源性、小的非编码RNA分子,其通过与靶基因3′UTR互补配对结合调节靶基因mRNA降解或抑制基因表达。最近研究数据表明[4-5],异常的miRNA表达通常参与癌症的发展,从包括食管癌在内的各种癌症的发病到转移。目前研究显示[6],miR-9-5p在食管癌组织中呈高表达,其可能作为抑癌基因参与食管癌的发生和进展,但其在食管癌中的作用机制目前尚不清楚。叉头框转录因子O1(forkhead box transcription factor O1,FOXO1)是forkhead家族中一类重要的转录因子,其主要调控细胞凋亡、氧化应激、脂质代谢等[7]。有报道显示,FOXO1在食管癌组织中呈低表达,与患者预后不良密切相关[8]。最近有研究显示,miR-9通过直接靶向FOXO1增强宫颈癌的侵袭和迁移[9]。然而,在食管癌中miR-9-5p是否靶向调控FOXO1的研究鲜有报道。因此本实验探究miR-9-5p对FOXO1的调控作用及对食管癌细胞增殖、侵袭和迁移的影响,以期为食管癌的早期诊断和临床治疗提供新的分子靶点。
1 材料与方法
1.1 材料人食管癌Eca-109细胞系(美国ATCC细胞库,目录号:FS-0228);RPMI 1640培养基(美国Hyclone公司,目录号:61870044);DMEM培养基(美国Hyclone公司,目录号:10569044);胎牛血清(美国Gibco公司,目录号:12483020);RNA提取试剂盒(北京康为世纪生物科技有限公司,目录号:CW0560S);反转录试剂盒(大连宝生物工程有限公司,目录号:6210A);实时荧光定量PCR试剂盒(大连宝生物工程有限公司,目录号:RR086A);Lipofectamine 2000转染试剂(美国Invitrogen公司,目录号:11668027);miR-9-5p inhibitor、NC-inhibitor、miR-9-5p mimics和NC-mimics由广州锐博生物科技有限公司合成;MTT试剂(美国Sigma公司,目录号:96992);Transwell小室(美国Corning公司,目录号:Scipu002273);Matrigel基质胶(BD公司,目录号:356235);荧光素酶报告基因载体pGL3质粒(美国Promega公司,目录号:E1741);Dual-Luciferase荧光素酶报告基因检测试剂盒(美国Promega公司,目录号:E7110);RIPA裂解液(上海碧云天生物科技有限公司,目录号:P0013K);BCA蛋白浓度测定试剂盒(上海碧云天生物科技有限公司,目录号:P0012S);PVDF膜(美国Abcam公司,目录号:ab133411);ECL化学发光检测试剂盒(美国Thermo Fisher公司,目录号:34094);鼠抗人FOXO1抗体(美国CST公司,目录号:9454);鼠抗人GAPDH抗体(美国CST公司,目录号:8884);辣根过氧化物酶标记的山羊抗鼠IgG(北京中杉金桥生物技术有限公司,目录号:A24512)。
1.2 细胞培养及转染食管癌Eca-109细胞使用质量浓度为100 g/L的灭活胎牛血清的RPMI 1640培养基(含100 U/ml的青霉素和100 g/L链霉素双抗)培养,置于体积分数为5% CO2、37 ℃培养箱中培养。观察细胞生长状态,及时更换新鲜培养液,待细胞贴壁生长汇合度为80%以上时使用质量浓度为2.5 g/L胰蛋白酶消化细胞,进行传代培养。取对数生长期的Eca-109细胞用于转染实验,即转染前1 d将Eca-109细胞接种到6孔板中,置于体积分数为5% CO2、37 ℃培养箱过夜培养,待细胞汇合率达50%时,按照Lipofectamine 2000转染试剂说明书进行转染操作。将转染miR-9-5p inhibitor的Eca-109细胞设置为anti-miR-9-5p组,将转染NC-inhibitor的Eca-109细胞设置为NC组,将未进行转染的Eca-109细胞设置为对照即Blank组。转染后各组细胞放置于37 ℃培养箱继续培养,6 h后更换为正常完全培养液,于37 ℃培养箱继续培养。
1.3 qRT-PCR检测miR-9-5p和FOXO1 mRNA表达水平分别收集转染48 h后各组Eca-109细胞,使用RNA提取试剂盒分别提取各组Eca-109细胞中总RNA,参照逆转录试剂盒说明书合成cDNA,使用实时荧光定量PCR检测试剂盒进行PCR扩增。检测miR-9-5p表达水平的反应条件设置如下:95 ℃预变性3 min,95 ℃变性15 s,60 ℃退火20 s,72 ℃延伸15 s,共设置40个循环。检测FOXO1 mRNA表达水平的反应条件设置如下:95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸20 s,共设置40个循环。采用2-ΔΔCt方法分别计算miR-9-5p和FOXO1 mRNA的相对表达水平。其中以β-actin为内参计算FOXO1 mRNA的相对表达水平,以U6为内参计算miR-9-5p的相对表达水平。
1.4 MTT法检测Eca-109细胞体外增殖能力分别收集Blank组、NC组和anti-miR-9-5p组Eca-109细胞,接种至96孔板中,接种密度为2×103个/孔,置于37 ℃培养箱常规培养,分别于转染0、24、48、72 h时在各孔细胞中加入10 μl MTT溶液,置常规培养箱继续培养4 h,取出细胞培养板,除去上清培养液,再在细胞中加入150 μl二甲基亚砜,振荡反应10 min,使用酶标仪测定450 nm波长处各孔细胞的光密度值(OD值)。每个时间点设置3个复孔,实验重复3次,取均值。
1.5 Transwell实验检测Eca-109细胞体外侵袭和迁移能力将Matrigel胶置于4 ℃冰箱进行溶解,在冰上以不含血清的培养基稀释Matrigel胶,将稀释的Matrigel胶加入到Transwell小室的上室,使其均匀铺满小室底部,置于超净工作台中过夜风干。细胞迁移实验Transwell小室的上室不以Matrigel胶包被。Blank组、NC组和anti-miR-9-5p组Eca-109细胞培养24 h后用胰酶消化,并以不含血清的培养液重悬细胞,取200 μl细胞悬液加入到Transwell小室的上室,接种密度为1.5×105个/小室,下室中加入600 μl质量浓度为100 g/L胎牛血清的RPMI 1640培养液,置37 ℃培养箱培养48 h,取出Transwell小室,棉签擦去上室细胞,PBS洗涤后以质量浓度为1 g/L结晶紫染色,在倒置显微镜下(100×)随机选取5个视野观察穿膜细胞数,实验重复3次。
1.6 双荧光素酶报告基因实验采用生物信息学软件TargetScan等数据库分析miR-9-5p的靶基因,结果显示FOXO1基因3′端存在miR-9-5p的潜在结合位点,提示FOXO1可能是miR-9-5p的直接靶基因。采用双荧光素酶报告基因实验验证该结论,本实验根据生物信息学预测结果,分别扩增出含miR-9-5p结合位点的FOXO1 3′UTR及miR-9-5p结合位点突变的FOXO1 3′ UTR序列,并将其插入到荧光素酶报告基因载体上,构建野生型FOXO1-Wt和突变型FOXO1-Mut重组质粒。将Eca-109细胞接种到96 孔板中,37 ℃培养24 h,分别将FOXO1-Wt重组质粒或FOXO1-Mut重组质粒与miR-9-5p mimics或NC-mimics共转染至Eca-109细胞,置于37 ℃培养箱继续培养48 h,收集并裂解细胞,使用双荧光素酶报告基因检测试剂盒测定每孔细胞的海肾荧光素酶活性和萤火虫荧光素酶活性,计算细胞相对荧光素酶活性,实验重复3次。相对荧光素酶活性=萤火虫荧光素酶活性/海肾荧光素酶活性。
1.7 Western blotting检测FOXO1蛋白表达水平收集转染48 h的Blank组、NC组和anti-miR-9-5p组Eca-109细胞,加入RIPA细胞裂解液于冰上提取细胞中总蛋白,采用BCA蛋白浓度测定试剂盒对蛋白进行定量。将蛋白样品与上样缓冲液混匀,沸水浴加热变性,取等量变性蛋白样品加入上样孔,行SDS-PAGE凝胶电泳。待蛋白分离后转膜至PVDF膜上,在质量浓度为50 g/L脱脂奶粉中封闭1 h,TBST洗膜后加入FOXO1一抗(1∶500稀释),4 ℃过夜杂交,TBST洗膜后再加入辣根过氧化物酶标记的二抗(1∶3 000稀释),室温杂交1 h,TBST洗膜后以ECL化学发光,于暗室成像拍照,以GAPDH为内标蛋白,使用Image J分析软件计算各组Eca-109细胞中FOXO1蛋白相对表达水平。
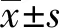
2 结果
2.1 转染miR-9-5p inhibitor可下调食管癌Eca-109细胞中miR-9-5p的表达qRT-PCR分析结果显示,anti-miR-9-5p组Eca-109细胞中miR-9-5p的表达水平显著低于NC组和Blank组(P<0.05),miR-9-5p在NC组和Blank组中的表达水平差异无统计学意义(P>0.05)(见图1)。
注:与Blank组相比,aP<0.05;与NC组相比,bP<0.05。图1 各组细胞中miR-9-5p的表达Fig 1 Expression of miR-9-5p in each group
2.2 干扰miR-9-5p抑制食管癌Eca-109细胞增殖MTT实验结果显示,anti-miR-9-5p组Eca-109细胞在24、48、72 h时OD值均明显低于NC组和Blank组(P<0.05),NC组和Blank组细胞OD值差异无统计学意义(P>0.05)(见表1)。

表1 干扰miR-9-5p对Eca-109细胞OD值的影响Tab 1 Effect of interference miR-9-5p on OD value of Eca-109 cells
注:与Blank组比,aP<0.05;与NC组比,bP<0.05。
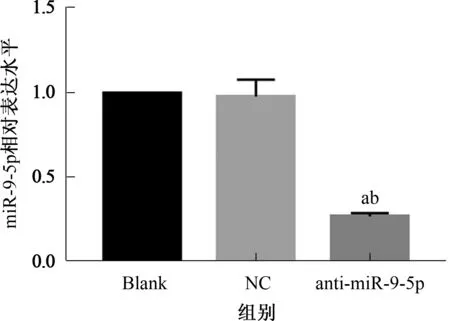
2.3 干扰miR-9-5p抑制食管癌Eca-109细胞侵袭和迁移Transwell实验结果如图2所示,anti-miR-9-5p组侵袭和迁移细胞数明显低于NC组和Blank组(P<0.05),而NC组和Blank组中侵袭和迁移细胞数差异无统计学意义(P>0.05)(见表2)。
2.4 miR-9-5p靶向调控FOXO1的表达在线生物学软件TargetScan预测分析结果显示,FOXO1基因3′UTR上和miR-9-5p存在潜在靶向结合位点(见图3 A)。双荧光素酶报告基因实验检测结果显示,FOXO1-Wt共转染组中miR-9-5p组细胞相对荧光素酶活性明显低于NC组(P<0.05);FOXO1-Mut共转染组中miR-9-5p组和NC组相对荧光素酶活性差异无统计学意义(P>0.05)(见图3B)。qRT-PCR和Western blotting方法检测干扰miR-9-5p对细胞中FOXO1 mRNA和蛋白表达的影响,结果显示,anti-miR-9-5p组Eca-109细胞中FOXO1 mRNA和蛋白表达水平均明显高于NC组(P<0.05)(见图3C~3D)。

表2 干扰miR-9-5p对Eca-109细胞侵袭和迁移细胞数的影响Tab 2 Effects of interference miR-9-5p on cell invasion and migration of Eca-109 cells
注:与Blank组相比,aP<0.05;与NC组相比,bP<0.05。
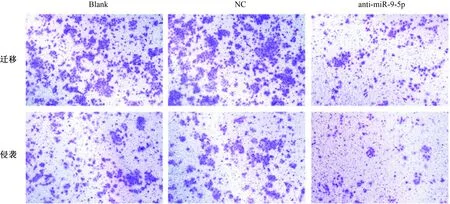
图2 Transwell实验检测Eca-109细胞迁移和侵袭(结晶紫染色,100×)Fig 2 Transwell assay for migration and invasion of Eca-109 cells (crystal violet staining, 100×)
注:与NC组相比,bP<0.05。
图3 miR-9-5p靶向调控FOXO1的表达A:miR-9-5p和FOXO1基因3′UTR存在靶向结合位点;B:双荧光素酶报告基因实验验证FOXO1是miR-9-5p的靶基因;C~D:qRT-PCR和Western blotting方法检测细胞中FOXO1 mRNA和蛋白表达
Fig 3 Expression of FOXO1 by miR-9-5p target regulationA: target binding sites in miR-9-5p and FOXO1 gene 3′UTR; B: FOXO1 was the target gene of miR-9-5p verified by double luciferase reporting gene experiment; C-D: expressions of FOXO1 mRNA and protein detected by qRT-PCR and Western blotting
2.5 Western blotting方法检测FOXO1蛋白表达水平Western blotting实验结果显示, Western blotting方法检测干扰miR-9-5p对细胞中FOXO1 蛋白表达的影响,结果显示,anti-miR-9-5p组Eca-109细胞中FOXO1蛋白表达水平明显高于NC组(P<0.05)(见图4、表3)。

注:与NC组相比,bP<0.05。图4 干扰miR-9-5p对细胞中FOXO1蛋白表达的影响Fig 4 Effect of interference miR-9-5p on expression ofFOXO1 protein in cells

FOXO1蛋白相对表达量123平均值SD值NC组0.6530.6600.6610.6580.0047anti-miR-9组1.1631.1661.1701.1660.0033
3 讨论
越来越多的研究表明,miRNA参与各种生物过程,如细胞增殖、分化、凋亡、代谢和肿瘤发生[10-11]。众所周知,miRNA可以参与调节人类疾病的起始和维持多种基因的表达。近年来,多项研究报道了多种miRNA参与食管癌的发生、进展和转移,然而其具体作用机制尚不十分明确[12-13]。目前研究发现,miR-9-5p能够参与调控多种肿瘤的发生和发展,如在乳腺癌中,miR-9-5p能够通过介导细胞中AR-an癌基因的表达抑制乳腺癌的进展[14]。GAO等[15]研究显示,miR-9-5p在胃癌组织和细胞中呈低表达,miR-9-5p干扰能够在体外抑制胃癌细胞增殖,体内移植瘤实验同样证实了干扰miR-9-5p抑制肿瘤的生长。miR-9-5p抑制人卵巢癌OVCAR-3细胞的细胞增殖,抑制侵袭能力并诱导细胞凋亡,该过程通过靶向SDF-1/CXCR4通路实现的[16]。目前研究发现,miR-9-5p在食管癌中呈低表达,因此本研究首先在食管癌Eca-109细胞中转染miR-9-5p inhibitor干扰miR-9-5p,qRT-PCR技术验证了转染miR-9-5p inhibitor能够上调Eca-109细胞中miR-9-5p的表达。MTT检测发现,干扰miR-9-5p能够抑制Eca-109细胞体外增殖能力。Transwell实验结果表明,干扰miR-9-5p能够抑制Eca-109细胞体外侵袭和迁移能力。这与以往关于miR-9-5p发挥抑癌基因功能的研究相符。随着对miR-9-5p研究的深入,发现miR-9-5p在肺癌组织和细胞中呈高表达,体外研究发现,miR-9-5p可通过抑制TGFBR2促进非小细胞肺癌细胞生长和转移[17]。miR-9-5p在宫颈癌组织标本中的表达显著高于邻近正常组织,可作为宫颈癌患者潜在的预后标志物[18]。miR-9-5p在自发性犬骨肉瘤中干扰,并介导凝溶胶蛋白(GSN)的表达促进转移表型,包括成骨细胞和骨肉瘤细胞的侵袭和迁移[19]。这些研究显示miR-9-5p发挥促癌基因的作用。提示miR-9-5p在不同肿瘤中可能通过介导不同靶基因发挥促癌基因或抑癌基因的作用。
FOXO1转录因子是FOX家族重要成员之一,目前研究显示FOXO1与多种恶性肿瘤形成、生长及浸润和转移密切相关,CHAN等[20]研究表明,FOXO1可抑制口腔癌细胞生长、集落形成和侵袭能力,HBP1作为口腔癌中FOXO1的直接下游靶标,HBP1敲低有效促进口腔癌的恶性表型。ZANG等[21]研究发现,miR-215通过直接结合FOXO1的3′UTR来降低FOXO1的表达,miR-215通过靶向FOXO1促进胃癌细胞的迁移和侵袭。miR-196a的下调通过靶向FOXO1抑制人肝癌细胞的增殖和侵袭。近期研究发现,miR-9通过下调FOXO1促进乳腺癌细胞的增殖、迁移和侵袭[22]。提示miR-9-5p可能与FOXO1存在靶向关系。因此本实验通过生物信息学软件预测miR-9-5p的靶基因,结果发现FOXO1基因3′ UTR与miR-9-5p存在互补结合位点,表明FOXO1可能是miR-9-5p的直接靶基因,双荧光素酶报告基因实验验证了miR-9-5p能够与FOXO1靶向结合。接下来本实验通过qRT-PCR和Western blotting方法检测干扰miR-9-5p对细胞中FOXO1 mRNA和蛋白表达的影响,结果发现,干扰miR-9-5p能够抑制FOXO1 mRNA和蛋白的表达,这表明miR-9-5p能够负向调控FOXO1的表达。以上实验结果提示,miR-9-5p在食管癌中的抑癌基因的作用可能通过靶向FOXO1实现。
综上,本实验结果表明,干扰食管癌Eca-109细胞中miR-9-5p的表达可抑制细胞体外增殖、侵袭和迁移能力,该过程可能通过靶向负调控FOXO1的表达来实现。随着对miR-9-5p研究的深入,miR-9-5p有望成为食管癌早期诊断和临床治疗的分子靶向。
