地氟烷预处理对脂多糖所致肺损伤幼年大鼠的影响
2019-06-19冯继峰
吕 锋 冯继峰
(广西壮族自治区妇幼保健院厢竹院区麻醉科,南宁市 530002,电子邮箱:13206945@qq.com)
地氟烷是血/气分配系数最小的吸入麻醉药,麻醉诱导和苏醒均很迅速,并可精确调控肺泡药物浓度和快速调节麻醉深度[1]。地氟烷可促进脑缺血大鼠的神经功能恢复,降低脑梗死和缺血再灌注损伤的面积,其机制可能与抑制线粒体肿胀和膜电位耗散有关[3-5]。最近有研究表明,地氟烷可通过干扰CXC受体(CXC receptor,CXCR)2信号通路来减弱CXC细胞因子诱导的中性粒细胞炎症反应[6]。脂多糖是导致脓毒症的常见内毒素,可引起明显的肺损伤,但目前鲜见有关地氟烷预处理是否能减轻脂多糖所致肺损伤的研究报道。因此,本研究建立幼年大鼠的脂多糖所致肺损伤模型,探讨地氟烷预处理对脂多糖所致肺损伤的干预效果及其机制。
1 材料与方法
1.1 主要仪器和试剂 UV-2100PC型紫外可见分光光度计由美国Unico公司生产,RF-510型荧光分光光度计由日本岛津公司生产,55P-7型超速离心机由日本东芝公司生产。大肠杆菌脂多糖(批号:S17 32~25 mg)、二喹啉甲酸(bicinchoninic acid,BCA;批号:P0012)、活性氧簇(reactive oxygen species,ROS;批号:S0033)和线粒体膜电位(mitochondrial membrane potential,MMP;批号:C2006)试剂盒均由上海碧云天生物技术有限公司生产,白细胞介素(interleukin,IL)-1β(批号:CSB-E08055r)和肿瘤坏死因子(tumor necrosis factor,TNF)-α(批号:CSB-E11987r)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒由武汉华美生物工程有限公司生产,RNAiso Plus(批号:9108)试剂、反转录PrimeScriptTMRT reagent Kit(Perfect Real Time)(批号:RR037A)试剂盒、PCR TB GreenTMPremix Ex TaqTMⅡ(Tli RNaseH Plus;批号:RR820A)试剂盒均由日本TaKaRa公司生产,CXCR1多克隆抗体(批号:bs-1009R)、CXCR2多克隆抗体(批号:bs-1629R)、CD11b多克隆抗体(批号:bs-1014R)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多克隆抗体(批号:bs-2188R)和辣根过氧化物酶标记的山羊抗兔IgG(bs-0295G)均由美国Bioss公司生产。
1.2 实验动物及分组 清洁级健康雄性Wistar大鼠60只,购于广东省医学实验动物中心[(许可证号:SCXK(粤)2013-0002)],18日龄,体重160~180 g,饲养于鼠笼内,自由进食和饮水。采用随机数字表法将大鼠分为对照组(C组)、脂多糖组(L组)、1.0 最大允许浓度(maximum allowable concentration,MAC)地氟烷组(D1.0组)和1.5 MAC地氟烷组(D1.5组),每组15只。本实验中所有实验动物处置方法均符合动物伦理学标准。
1.3 建立脂多糖肺损伤模型[7]D1.0组和D1.5组建模前分别吸入1.0 MAC和1.5 MAC地氟烷40 min。L组、D1.0组和D1.5组大鼠气管内滴注脂多糖,剂量均为5.0 mg/kg,C组气管内滴注等量生理盐水。
1.4 标本制备 滴注脂多糖或生理盐水8 h后,采用80 mg/kg氯胺酮和60 mg/kg戊巴比妥钠行腹腔注射以麻醉大鼠,暴露胸腔,右心室取血,1 800 r/min、4℃离心15 min后留取血清;结扎右肺,反复灌洗支气管肺泡,收集支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)。血清、BALF和肺组织置于-80℃保存待检。
1.5 观察指标
1.5.1 肺组织湿/干比:取右肺下叶组织称取湿重,置60℃烘干箱48 h后称取干重,计算湿/干比值评估肺水肿程度。
1.5.2 肺组织病理学观察:取右肺中叶组织以10%中性甲醛固定,常规石蜡包埋切片,苏木素-伊红(hematoxylin and eosin,HE)染色,光镜下观察肺组织病理学改变并评分。评分内容包括肺泡充血、出血、白细胞渗出到肺泡腔或血管壁、肺泡壁损伤,均分别按照0~4分进行评分,其中少量轻微损伤为0分,轻度损伤为1分,中度损伤为2分,重度损伤为3分,严重损伤为4分,病理学评分为各项评分之和[8]。
1.5.3 炎症因子含量的检测:采取ELISA检测血清和BALF中IL-1β和TNF-α的含量,均按照试剂盒说明书进行操作。
1.5.4 肺组织ROS和MMP耗散情况的检测:取右肺上叶肺组织,制备细胞匀浆后,按照ROS检测试剂盒说明书进行操作,以Rosup试剂作为活性氧阳性对照。参照文献[4]的方法,将分离的线粒体(0.5 mg蛋白/mL)置于225 mmol/L甘露醇(1.0 mL)、70 mmol/L蔗糖(1.0 mL)和5 mmol/L Hepes分析缓冲液(1.0 mL)中,加入40 μmol/L氯化钙1.0 mL,诱发罗丹明123的释放(测定条件:25℃,0.3 mol/L罗丹明123,激发和发射波长分别为503 nm和525 nm),MMP耗散以加入罗丹明123前后的荧光强度变化绝对值表示。
1.5.5 实时荧光定量PCR反应检测肺组织CXCR1、CXCR2和CD11b mRNA的表达:取左肺上叶肺组织,采用TRIzol试剂提取肺组织中的总RNA,按试剂盒说明进行反转录后,按照PCR试剂盒的操作步骤进行PCR反应,反应体系包括2×One Step TB Green实时荧光PCR Buffer 4 12.5 μL、PrimeScript 1 Step Enzyme Mix 2 2.0 μL、PCR forward Primer(10 μM)2.0 μL、PCR reverse Primer(10 μM)2.0 μL、ROX Reference Dye or Dye Ⅱ(50×)1.0 μL、Total cDNA 4.0 μL和RNase Free dH2O 1.5 μL。CXCR1、CXCR2、CD11b和内参GAPDH引物序列均由日本TaKaRa公司合成。采用相对定量法2-△△Ct计算各基因mRNA的表达水平,其中△Ct=目的基因Ct值-内参基因Ct值。
1.5.6 蛋白质免疫印迹法检测CXCR1、CXCR2和CD11b蛋白的表达:取左肺下叶肺组织,提取肺组织的总蛋白,BCA法测定蛋白浓度后,经十二烷基硫酸钠聚丙烯酰胺凝胶电泳、转膜和封闭后,多克隆CXCR1、CXCR2和CD11b抗体(一抗,比例分别为1 ∶1 000、1 ∶500和1 ∶500)4℃孵育过夜,辣根过氧化物酶标记的山羊抗兔IgG(二抗,比例为1 ∶1 000)室温孵育1 h。采用电化学发光试剂盒显影,ChemiDocTMMP成像系统成像并检测灰度值,以目的蛋白与内参GAPDH 的灰度值比值代表各组目的蛋白的相对表达量。
1.6 统计学分析 采用SPSS 13.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用单因素方差分析,两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 4组大鼠肺组织湿/干比比较 与C组比较,L组、D1.0组和D1.5组大鼠肺组织湿/干比均增加(均P<0.05);与L组比较,D1.0组和D1.5组大鼠肺组织湿/干比均降低(均P<0.05);而D1.0组和D1.5组大鼠肺组织湿/干比差异无统计学意义(P>0.05)。见表1。

表1 4组肺组织湿/干比、病理学评分、ROS阳性率和MMP耗散的比较(x±s)
注:与C组比较,aP<0.05;与L组比较,bP<0.05。
2.2 4组大鼠肺组织病理学改变和评分比较 C组大鼠肺组织无明显病理学改变;D1.0组和D1.5组大鼠肺组织结构轻度紊乱,肺组织及肺间质部分充血水肿,肺泡可见炎症细胞和红细胞渗出;L组大鼠肺组织结构明显紊乱,肺组织及肺间质充血水肿明显,肺泡内大量炎性细胞和红细胞渗出。见图1。与C组比较,L组、D1.0组和D1.5组大鼠肺组织病理学评分升高(均P<0.05);与L组比较,D1.0组和D1.5组大鼠肺组织病理学评分降低(均P<0.05);而D1.0组和D1.5组大鼠肺组织病理学评分差异无统计学意义(P>0.05)。见表1。

图1 光镜下观察大鼠肺组织病理学改变(HE染色,100×)
2.3 4组大鼠ROS阳性率和MMP耗散比较 与C组比较,L组、D1.0组和D1.5组大鼠肺组织ROS阳性率和MMP耗散增加(均P<0.05);与L组比较,D1.0组和D1.5组大鼠肺组织ROS阳性率和MMP耗散降低(均P<0.05);而D1.0组和D1.5组大鼠肺组织ROS阳性率和MMP耗散差异无统计学意义(P>0.05)。见表1。
2.4 4组大鼠血清及BALF炎症因子表达水平比较 与C组比较,L组、D1.0组和D1.5组大鼠血清及BALF中TNF-α和IL-1β水平均增加(均P<0.05);与L组比较,D1.0组和D1.5组血清及BALF中TNF-α和IL-1β水平均降低(均P<0.05);D1.0组和D1.5组大鼠血清及BALF中TNF-α和IL-1β水平差异无统计学意义(均P>0.05)。见表2。

表2 各组大鼠血清和BALF炎症因子IL-1β和TNF-α水平的比较(x±s)
注:与C组比较,aP<0.05;与L组比较,bP<0.05。
2.5 4组大鼠肺组织CXCR1、CXCR2和CD11b mRNA和蛋白的表达水平比较 与C组比较,L组、D1.0组和D1.5组大鼠肺组织中CXCR1、CXCR2和CD11b mRNA和蛋白表达水平均增加(均P<0.05);与L组比较,D1.0组和D1.5组肺组织中CXCR1、CXCR2和CD11b mRNA和蛋白表达水平均降低(均P<0.05);D1.0组和D1.5组肺组织中CXCR1、CXCR2和CD11b mRNA和蛋白表达水平比较,差异均无统计学意义(均P>0.05)。见表3和图2。
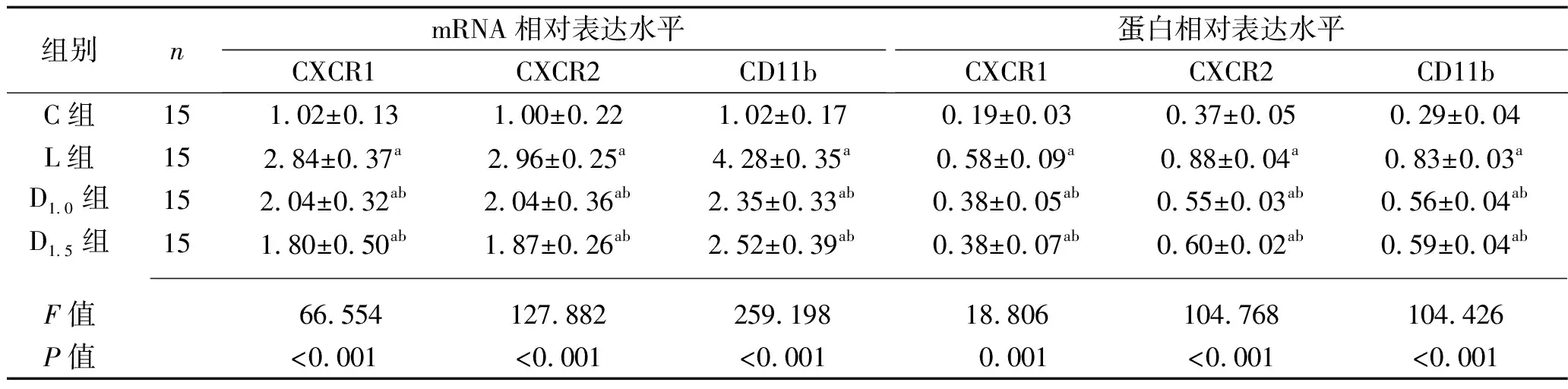
表3 各组大鼠肺组织CXCR1、CXCR2和CD11b mRNA和蛋白表达水平比较(x±s)
注:与C组比较,aP<0.05;与L组比较,bP<0.05。

图2 4组大鼠肺组织CXCR1、CXCR2和CD11b蛋白的表达情况
3 讨 论
本研究中,L组大鼠经0.5 mg/kg脂多糖作用8 h后,肺泡及肺泡壁结构紊乱,肺间质水肿,肺泡内见大量红细胞和炎细胞浸润,且肺组织湿/干比、血清及BALF中IL-1β和TNF-α水平均较C组升高(均P<0.05)。这提示大鼠肺组织发生水肿和急性炎症性损伤,脂多糖致肺损伤模型建立成功。预先给予地氟烷处理40 min的D1.0组和D1.5组大鼠肺组织湿/干比、病理学评分、血清及BALF中TNF-α和IL-1β水平均低于L组(P<0.05),肺组织水肿、病理损伤均减轻,但D1.0组和D1.5组间差异无统计学意义,提示地氟烷预处理可能起到抗炎症和肺保护作用且不随地氟烷的浓度变化而改变。
脂多糖刺激肺组织分泌炎性介质、产生ROS以及引起气道上皮损伤,是其导致急性肺损伤的重要机制。正常情况下,机体内氧化系统和抗氧化系统是平衡的,不断产生ROS以维持生理功能,并被抗氧化系统清除。当产生的ROS超出抗氧化系统的清除能力,出现氧化应激反应,即引起组织器官损伤[9]。急性肺损伤时,中性粒细胞和肺泡巨噬细胞释放大量的ROS,引起脂质过氧化反应、抑制线粒体呼吸链酶和膜钠通道活性等,进一步加重肺组织炎症反应和损伤[10-11]。本研究结果显示,D1.0组和D1.5组大鼠肺组织ROS阳性率低于L组(均P<0.05),但D1.0组和D1.5组间差异无统计学意义(P>0.05),提示地氟烷预处理后可一定程度抑制肺组织ROS的产生,且无浓度依赖性。
MMP耗散是细胞能量代谢严重障碍的结果,在一定程度上反映细胞凋亡和坏死[12]。张兵等[4]的研究结果提示,1.0 MAC和1.5 MAC的地氟烷均可抑制脑缺血再灌注导致的MMP耗散和Ca2+导致的线粒体肿胀,但这种变化不呈剂量依赖性。本研究中,D1.0组和D1.5组大鼠肺组织MMP耗散均低于L组(均P<0.05),提示地氟烷也可抑制脂多糖所致大鼠肺损伤模型的MMP耗散,这可能是地氟烷可以抑制脂多糖所致肺损伤引起的氧化应激和炎症反应;但D1.0组和D1.5组大鼠肺组织MMP耗散差异无统计学意义(P>0.05),提示地氟烷的抑制作用亦无浓度依赖性。
中性粒细胞募集是脂多糖所致肺损伤和炎症反应发展的关键病理生理过程。携带C-X-C-基序的前炎症细胞因子包括IL-8及其激活的CXC-配体1和CXCR2,可促进依赖CD11b的中性粒细胞迁移[13-15]。因此,CXCR2信号通路是减轻脂多糖诱导急性肺损伤的重要途径。有研究表明,麻醉药地氟烷可通过干扰CXCR2信号通路的传导降低CXC炎症因子的释放和减轻中性粒细胞炎症反应[6]。本研究结果显示,D1.0组和D1.5组大鼠肺组织CXCR1、CXCR2和CD11b mRNA和蛋白表达水平均低于L组(均P<0.05),提示地氟烷可抑制CXCR2信号通路的激活,从而减少CXC炎症因子的释放和减轻中性粒细胞炎症反应。
综上所述,地氟烷预处理可减轻幼年大鼠脂多糖所致的肺损伤和炎症反应,其机制可能是通过干扰CXCR2信号通路减少ROS生成和MMP的耗散。
