虾青素对小鼠结肠急性氧化损伤的保护作用
2019-06-18张子琪朱凌羽刘惠麟李若楠郎伍营兰海楠
张子琪,朱凌羽,刘惠麟,李若楠,郎伍营,吴 旻,兰海楠,郑 鑫
(吉林农业大学动物科学技术学院,吉林长春 130118)
肠道是机体对营养物质消化吸收的主要器官,也是机体内最大的免疫器官。受环境及饮食因素影响,动物肠道尤其是在低龄家畜中,极易出现肠道炎症而导致疾病的发生。炎症性肠病包括克罗恩病和溃疡性结肠炎,是一组非特异性肠道慢性炎症疾病,可增加结直肠癌发生的风险[1],它是由各种环境因素引起,如胃肠道感染、非甾体抗炎药物使用或其他环境毒素等[2]。随着生活水平的提高,市场对于畜产品的需求量越来越大,亟待解决的问题之一就是用天然的饲料添加剂彻底替换抗生素类药物,使畜禽健康成长的同时可自身抵御外界疾病。
虾青素(Astaxanthin,ATX)是一种红橙色的叶黄素类胡萝卜素,具有强抗氧化性。雨生红球藻是天然虾青素的丰富来源,鲑科鱼类、虾类等甲壳类生物体内也含有虾青素[3]。许多研究表明,虾青素具有抗氧化、抗炎和抗癌特性等多种生物活性,可降低人类及动物多种疾病的发生[4-5],现已被美国食品药物管理局和欧盟委员会批准作为食品添加剂。目前关于虾青素的研究大都是单一、孤立地研究其某一特性,但炎症反应与氧化应激有着千丝万缕的联系。为此,本试验以脂多糖(Lipopolysaccharide,LPS)诱导小鼠发生炎症反应,建立急性小鼠结肠炎症模型,研究虾青素对炎症因子水平和氧化损伤程度的影响,来说明虾青素对小鼠急性结肠炎症反应的抑制作用和对结肠氧化损伤的保护作用,并通过NF-κB 信号通路探讨两者之间的关系,为虾青素作为食品和饲料添加剂的使用以及其在炎症性肠病防治中的应用提供依据。
1 材料与方法
1.1 试验设计及饲养管理 随机将6 周龄、体重均为(18±1)g 的32 只雄性ICR 小鼠(购自长春市亿斯实验动物技术有限责任公司)分为4 组(对照组、虾青素组、LPS 组和虾青素保护组),每组8 只。在LPS 注射前连续15 d,对照组与LPS 组小鼠灌胃橄榄油,虾青素组与虾青素保护组灌胃50 mg/kg 虾青素,虾青素(雅仕达生物技术有限公司,纯度:2%)溶于橄榄油中。小鼠在第15 天灌胃后禁食12 h,之后LPS 组和虾青素保护组小鼠按1 mg/kg 剂量腹腔注射LPS,LPS 溶于无菌生理盐水中。同时,对照组和虾青素组注射等量无菌生理盐水。
小鼠饲养在12 h 明暗交替循环、室温(25±1)℃的无菌动物实验室内,适应环境1 周后进行试验。所有小鼠均饲喂标准小鼠日粮,在整个饲养期间保证小鼠自由摄食和饮水。
1.2 样品采集 各组小鼠在LPS/生理盐水腹腔注射3 h后,进行血液和结肠组织采集。采集血液:小鼠眼球采血,血液置于1.5 mL 离心管中,室温下静置30 min 以析出血清,4℃,3 500 r/min 离心15 min 分离血清,-20℃保存备用。结肠组织采集:颈椎脱臼处死小鼠,迅速自肛门上2 cm 处向上分离结肠6~8 cm,4% 多聚甲醛溶液固定,待做组织切片;其余肠组织置于生理盐水中清洗,吸干水分后在液氮中速冻,之后置于-80℃冰箱中保存备用。
1.3 ELISA 检测各组小鼠血清中炎性水平 根据ELISA检测试剂盒(美国R&D System)说明书,分别检测和计算各组小鼠血清中肿瘤坏死因子(Tumor Necrosis Factor-α,TNF-α)、 白 细 胞 介 素-6(Interleukin-6,IL-6)、白细胞介素-1β(Interleukin-1β,IL-1β)和髓过氧化物酶(Myeloperoxidase,MPO)含量,每组设3 个重复并且每个样本测3 个重复值。Thermo 酶标仪(上海赛默飞世尔)检测。
1.4 Western blot 检测各组小鼠结肠组织中p-NF-κB p65蛋白的相对表达量 取出冻存的肠段组织,用预冷的PBS 洗涤2 次,加入含蛋白酶抑制剂的RIPA 裂解液(上海碧云天生物技术有限公司),在冰上进行组织匀浆,12 000 r/min 4℃离心5 min,取上清液,BCA法测蛋白浓度。取20 g 总蛋白进行SDS-PAGE 电泳,电转印至PVDF 膜上,用5%的BSA 封闭1 h,一抗为鼠源的p-NF-κB p65抗体(1∶1 000),兔源的β-actin 抗体(1∶5 000)(美国 CST),4℃孵育过夜。TBST 洗膜后分别加入相应的二抗∶HRP 标记的山羊抗鼠IgG(1∶3 000)和HRP 标记的山羊抗兔IgG(1∶3 000)(天津三箭生物技术有限公司),37℃孵育1 h 。TBST 洗膜后,凝胶成像仪(美国Bio-Rad)感光显色,目的条带用 Image J 进行灰度分析,用目的条带灰度值比上内参(β-actin)条带灰度值计算出蛋白相对表达量。
1.5 结肠组织中抗氧化指标测定 取部分结肠组织,用冰冻的生理盐水冲洗,滤纸吸干后称重,剪碎后加入9 倍生理盐水,在冰浴中机械匀浆成10%匀浆液,3 000 r/min离心15 min,取上清液,按南京建成生物研究所有限公司相应的试剂盒说明操作测定结肠组织蛋白、丙二醛(MDA)含量与超氧化物歧化酶(Superoxide Dismutase,SOD)、谷胱甘肽过氧化酶(Glutathione Peroxidase,GSH-Px)、过氧化氢酶(Catalase,CAT)等抗氧化酶活性。1 个酶活力单位(U)表示每分钟转化1 μmol 底物的酶量。
1.6 荧光定量PCR 检测各组结肠组织中炎性因子及抗氧化酶mRNA 相对表达量 荧光定量PCR 检测各组小鼠结肠组织中炎性因子TNF-α、IL-6、IL-1β、一氧化氮合酶(Induced Nitric Oxide Synthase,iNOS)、环氧合酶(cyclooxygenase-2,COX-2)和SOD、GSHPx、CAT 等抗氧化酶的mRNA 相对表达量。根据上海ExCell 公司RNA Lyzol 说明书提取各个肠段组织RNA,并测得所有样品浓度和质量,OD260/280在1.8~2.0,可用于下一步试验。然后按照美国Gene Copoeia 公司cDNA 逆转录试剂盒的步骤将RNA 反转录为cDNA。最后进行荧光定量PCR,采用20 μL 反应体系:SYBR(日本TaKaRa)10 μL,上、下游引物各1 μL、cDNA 模板2 μL,ddH2O 6 μL,在美国Bio-Rad 荧光定量PCR仪中按照95℃预变性30 s,95℃变性5 s,60℃退火30 s,39 个循环进行PCR 反应,每次试验均设置18S 作为内参,用2-ΔΔCt法计算炎性因子mRNA 的相对表达量。所用引物均由上海生工生物技术公司合成(表1)。
1.7 结肠组织病理学分析 将各组小鼠结肠用一系列浓度梯度的乙醇脱水,二甲苯透明,石蜡包埋、切片,常规脱蜡复水,经苏木精- 伊红(HE)染色,中性树脂封片后光镜检查。
1.8 统计分析 试验数据经Microsoft Excel 2010 整理,利用SPSS 19.0 软件进行统计分析,结果以平均值±标准差表示,数据采用单因素方差分析,Duncan's 法进行多重比较,P<0.05 为差异显著。
2 结 果
2.1 结肠组织病理学观察 如图1 所示,对照组与虾青素组结肠结构正常;LPS 组结肠损伤严重,出现黏膜糜烂、水肿,黏膜层和固有层炎性细胞浸润增加;虾青素保护组黏膜受损较轻,炎细胞浸润较少,极少出现绒毛顶端破损,绒毛状态均匀完整。提示急性结肠炎症模型建立成功,虾青素可预防急性炎症带来的结肠形态损伤。

表1 荧光定量PCR 引物序列表

图1 光镜下各组小鼠结肠黏膜组织HE 染色(×100)
2.2 虾青素对LPS 诱导的小鼠血液炎性因子的影响 由表2 可 知,LPS 组 血 清 中 炎 性 因 子TNF-α、IL-6、IL-1β 及MPO 的分泌量高于对照组、虾青素组和虾青素保护组(P<0.05),提示虾青素降低了LPS 诱导的血清炎性因子的分泌量,虾青素对细胞炎症因子的分泌有一定抑制作用。
2.3 虾青素对小鼠结肠组织氧化水平的影响 由表3 可知,与对照组相比,LPS 组小鼠结肠组织MDA 含量升高(P<0.05),SOD、GSH-Px、CAT 活性降低(P<0.05);与LPS 组相比,虾青素保护组小鼠结肠组织MDA 含量降低(P<0.05),SOD、GSH-Px、CAT 活性升高(P<0.05)。提示LPS 组小鼠结肠的抗氧化水平显著降低,氧化损伤明显,而虾青素保护能明显改善小鼠结肠抗氧化能力,降低结肠氧化损伤。
2.4 虾青素对小鼠结肠组织炎性因子及抗氧化酶mRNA相对表达量的影响 如图2 显示,与LPS 组相比,虾青素保护组可降低炎症因子TNF-α、IL-6、IL-1β 和炎症相关诱导型iNOS、COX-2 的mRNA 相对表达量(P<0.05),提高抗氧化酶SOD、GSH-Px、CAT 的mRNA 相对表达量(P<0.05)。表明虾青素可抑制TNF-α、IL-6、IL-1β、iNOS、COX-2 等基因的转录水平,同时提高抗氧化酶SOD、GSH-Px、CAT 等mRNA 水平,进而缓解结肠组织的急性损伤。
2.5 虾青素对小鼠结肠p-NF-κB p65 蛋白表达的影响如图3 所示,LPS 组结肠组织中p-NF-κB p65 蛋白表达量高于对照组和虾青素保护组(P<0.05)。由此推测,虾青素对LPS 诱导的小鼠急性结肠炎症的保护作用可能是通过抑制NF-κB p65 蛋白的活化来实现的。

表2 虾青素对小鼠血清TNF-α、IL-6、IL-1β、MPO 的影响

表3 虾青素对小鼠结肠组织SOD、GSH-Px、CAT、MDA 的影响

图2 虾青素对LPS 诱导的小鼠结肠炎性因子和抗氧化酶mRNA 相对表达量的影响
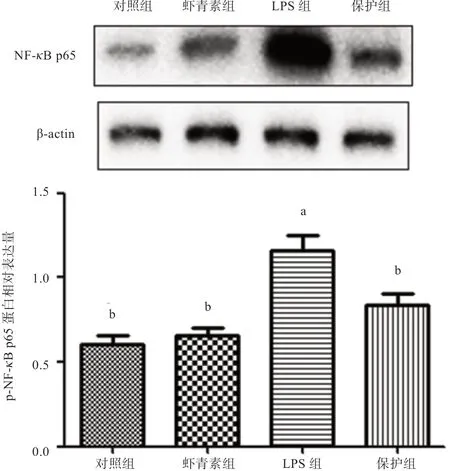
图3 虾青素对LPS 诱导的小鼠肠道p-NF-κB p65 蛋白表达的影响
3 讨 论
炎症是通过消除有害刺激来对机体进行自身保护的过程,通常是有益的,但如果持续较长时间,会导致宿主患各种慢性疾病,进而引发癌症[6]。炎症在激活肿瘤形成中至关重要,并且炎症诱导的细胞因子(如TNF-α和IL-1β)可促进肿瘤的形成。另外,参与肿瘤起始、促进和转移的几种基因(如COX-2、MMP-9、iNOS、TNF-α、IL-8 等)均由NF-κB 编码和调节[7],其与人和小鼠肿瘤的发生和进展相关[8]。此外,许多致癌基因和致癌物质也会引起NF-κB 的活化,而具有已知化学预防特性的化学物质可以抑制NF-κB 的活化。研究表明,虾青素通过诱导细胞凋亡和调节NF-κB、COX-2、MMPs-2/9、Akt、ERK-2 的表达,对二甲基肼诱导的大鼠结肠癌显现出抗癌作用[9]。另外,选择性COX-2抑制剂可降低NF-κB 蛋白的表达,进而缓解大鼠结肠病变[10]。综上说明虾青素可通过调节相关基因来缓解炎症反应。
LPS 又称内毒素,是革兰阴性菌细胞壁外膜中的主要成分,可引起全身炎症反应综合征,增强许多炎性因子(如TNF-α、IL-6 和IL-1β 等)的分泌和表达,因此可通过检测这些因子的分泌和表达量来衡量炎症的严重程度[11]。给小鼠注射LPS 后,巨噬细胞和嗜中性粒细胞释放炎性因子,最初的促炎性细胞因子TNF-α 和IL-6 被激活,刺激IL-1β、IL-8 等下游细胞因子表达,它们都在细胞因子级联中起到重要作用[12]。许多体内和体外研究显示,虾青素给药减少了TNF-α、IL-1β 和IL-6 的释放并可通过抑制脓毒症大鼠模型中的炎症来保护多器官免受损伤[13-14]。再者,研究表明添加虾青素的饮食可以降低黄曲霉毒素B1诱导的肝脏组织中MPO水平升高[15]。本研究结果表明,虾青素显著降低LPS诱导的急性结肠炎小鼠血清中TNF-α、IL-6、IL-1β 和MPO 的分泌,可下调组织中炎性因子TNF-α、IL-6、IL-1β 及炎症相关酶iNOS、COX-2 的mRNA 水平并可抑制NF-κB p65 蛋白的活化。
氧化应激是由于氧化与抗氧化系统之间的不平衡,导致机体内产生过量ROS。过量ROS 可能导致肺血管内皮的炎症损伤[16]。机体通过抗氧化酶(如SOD、GSH-Px、CAT)以及非酶抗氧化剂(如维生素E、β-胡萝卜素等)来调节机体的氧化还原水平[17]。氧化还原平衡被打破后,一些与自由基代谢有关的抗氧化酶和保护细胞免受氧化应激的抗氧化剂通常被耗尽。另外,MDA 是过量ROS 诱导的脂质过氧化产物,广泛用作氧化应激发生的标志物[18]。本研究结果显示,虾青素可显著提高LPS 诱导的小鼠急性结肠炎症组织中抗氧化酶SOD、CAT、GSH-Px 的活性及其基因的表达,同时显著降低MDA 含量,并且通过HE 染色从病理形态学角度表明了虾青素对急性结肠炎的预防作用。值得注意的是,在对急性肺损伤的研究中发现虾青素能够下调NF-κB p65 的表达,缓解氧化应激并抑制炎症[14]。此外,NF-κB、IL-6、IL-8、IFN-γ 等细胞因子能刺激炎性细胞诱导iNOS 蛋白表达上调产生大量NO,参与炎症反应[19]。说明炎症反应和氧化应激的发生很有可能是通过NF-κB信号通路相连。研究表明,虾青素具有比角黄素、β-胡萝卜素或玉米黄质高十倍的抗氧化活性,它可以减缓氧化应激和硝化应激,保护细胞和组织免受自由基损伤[20]。人体血液检测的结果显示,每天补充虾青素可以下调炎症细胞因子(如IL-6 和IFN-γ)的水平,并抑制活性氧和活性氮的产生[21]。因此,虾青素通过NF-κB 信号通路调节的一系列机制有可能首先来自于其强大的抗氧化性。
尽管许多研究表明虾青素有很强的抗炎和抗氧化性,但它在炎症性肠病中确切的作用机制仍需进一步探索。可通过NF-κB 这一条关键的信号通路研究其与炎症、氧化应激、细胞凋亡坏死等机制。另外,虾青素对结肠的保护作用也可能来自于其对肠道功能完整性的保护和对肠道菌群环境的改善。虾青素现已被用作保健品或食品添加剂,这些都预示着服用虾青素是一种预防和治疗炎症性肠病的新方法。由于本研究仅基于动物试验,尚需对其作用机制进行深入研究并开展前瞻性临床研究来评估虾青素是否适用于急性结肠炎的临床治疗。
4 结 论
本研究表明,虾青素可以通过抑制NF-κB p65 的活化降低血液和结肠组织中炎症水平,提高结肠中抗氧化能力,从而减轻LPS 诱导的急性结肠损伤;此外,虾青素还可维持肠道黏膜结构的完整性,其潜在的作用机制可能受益于其强大的抗氧化和抗炎活性。虾青素作为食品和饲料添加剂可能开辟出预防和治疗炎症性肠病的新途径。
