附子毒性生物碱的肝脏摄取机制*
2019-06-17从娇娇张雷覃晓慧张峻颖吴春勇
从娇娇,张雷,覃晓慧,张峻颖,吴春勇
(1.中国药科大学药物质量与安全预警教育部重点实验室,南京 210009;2.中国药科大学药物分析系,南京 210009;3.山东省食品药品检验研究院,济南 250101;4.中国药科大学中药制剂教研室,南京 211198)
附子是毛茛科植物乌头(AconitumcarmichaeliiDebx.)子根的加工品,可回阳救逆、补火助阳、散寒止痛[1],具有抗心力衰竭、镇痛、抗癫、抗肿瘤等多种药理作用[2-8]。但其治疗窗较窄,不当使用会发生神经毒性、心力衰竭等多种不良反应,严重时甚至导致死亡[9-12]。因此,阐明附子毒性生物碱的体内转运机制,对临床安全用药具有重要的指导意义。附子主要活性和毒性由双酯型生物碱,如乌头碱(aconitine)、新乌头碱(mesaconitine)和次乌头碱(hypaconitine)决定。LI等[13]发现大鼠灌胃给予由泥附子炮制而成的黑顺片后,肝脏的毒性作用具有剂量依赖性。NIITSU等[14]发现乌头碱和新乌头碱在人体肝脏中具有较高的组织分布。然而,笔者未见国内外关于肝脏对附子毒性生物碱转运机制方面的报道。人原代肝细胞是研究药物代谢和毒性的体外金标准[15],但其来源不易,个体间差异较大且价格昂贵,应用受到很大的限制[16]。来源于人肝胚胎瘤细胞的HepG2细胞表达有多种重要的药物转运蛋白,已用于槲皮素-3-硫酸酯、维生素B1等多个药物的肝脏摄取转运研究[17]。本实验以HepG2细胞为体外模型,首次从细胞水平研究附子中毒性生物碱乌头碱、新乌头碱和次乌头碱的肝脏摄取机制,结果可为附子及其配伍方剂的研究及临床应用提供参考。
1 材料与方法
1.1仪器 LC-30AD型高效液相色谱系统(日本Shimadzu公司),TRIPLE QUAD 5500型质谱仪(含Analyst 软件,美国AB SCIEX),BT25S型电子天平(德国Sartorius公司,感量:0.01 mg),Milli-Q型纯水仪(美国Millipore公司),JY 92-IIN超声波细胞粉碎机(宁波新芝生物科技股份有限公司),Synergy 4型酶标仪(美国伯腾仪器有限公司),12孔细胞培养板、细胞培养瓶(美国Corning公司),BHW-05型恒温加热平台(上海博通化学科技有限公司)。
1.2药品与试剂 乌头碱、新乌头碱和次乌头碱对照品(成都普瑞法科技开发有限公司,含量:98%),奥拉帕尼对照品(药渡经纬信息科技有限公司),高糖DMEM培养基、胎牛血清、非必需氨基酸和0.25%胰蛋白酶-乙二胺四乙酸溶液、青霉素-链霉素双抗液均为Gibco产品。甲醇(色谱纯,美国TEDIA公司),其他试剂与试药均为分析纯,水为去离子水。
1.3色谱条件 Hedera ODS-2 C18色谱柱(4.6 mm × 150 mm,5 μm),柱温30 ℃,流动相:10 mmol·L-1乙酸铵溶液(含0.1%甲酸)-甲醇(30:70),流速:0.8 mL·min-1,进样量:20 μL。
1.4质谱条件 柱后分流0.4 mL·min-1进入质谱仪,正离子气动辅助电喷雾离子化(ESI),离子检测为多反应监测(MRM),检测对象:乌头碱m/z646.3→586.2,新乌头碱m/z632.3→572.2,次乌头碱m/z616.2→556.3,奥拉帕尼(IS)m/z435.2→367.2,喷雾电压4 kV,温度500 ℃,碰撞气68.95 kPa,乌头碱、新乌头碱、次乌头碱和内标的碰撞能分别为46,42,41和28 eV。
1.5溶液的配置 精密称定乌头碱、新乌头碱和次乌头碱各适量,分别加二甲亚砜溶解,并稀释制成800 μmol·L-1的储备液;精密移取储备液适量,用甲醇稀释制成浓度为1~1000 nmol·L-1的系列标准混合工作液。另取奥拉帕尼对照品适量,用甲醇溶解并稀释制成0.5 mg·mL-1内标储备液;精密移取适量,用甲醇稀释制成0.5 μg·mL-1内标工作液。以上溶液置于-20 ℃冰箱保存。
1.6HepG2细胞培养 HepG2细胞株(中国科学院上海药物研究所馈赠)于37 ℃、5%二氧化碳(CO2)、相对湿度95%条件下培养,培养液为高糖DMEM培养液(含10%胎牛血清、1%非必需氨基酸及1%青霉素-链霉素双抗液)。将细胞按每孔1×105个接种到12孔板上,待细胞长至80%~90%汇合时进行药物摄取实验。
1.7细胞摄取 除另有规定外,细胞板置于37 ℃恒温加热平台上,各孔细胞用37 ℃的Krebs-Henseleit缓冲液(pH值7.4)冲洗2次,并预孵育30 min,吸干孔内溶液,加入含药缓冲液(乌头碱、新乌头碱和次乌头碱各1 μmol·L-1)0.8 mL并开始计时,孵育1 min后立即用4 ℃的空白缓冲液快速洗涤3次,吸干孔内溶液,细胞于-80 ℃冰箱保存备测。考察摄取时间(0.5,1,2,5 min)、孵育温度(4,37 ℃)、浓度(1~800 μmol·L-1)、胞外pH值(6.4,7.4,8.4)、胞内pH值调节(Acute,即摄取实验时加入氯化铵;Pre,即预孵育时加入氯化铵)、能量抑制剂叠氮化钠、质子泵抑制剂羰基-氰-对-三氟甲氧基苯腙(FCCP)、典型阳离子抑制剂对细胞摄取的影响。在考察trans-stimulation实验时,将细胞预先用0.5 mmol·L-1吡拉明或苯海拉明预孵育,摄取试验时去除吡拉明和苯海拉明。每个实验组平行操作3次。
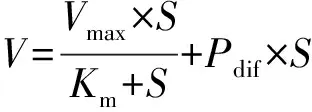
其中V为药物摄取率(nmol·min-1·mg-1),S为孵育液中药物浓度(μmol·L-1),Pdif为被动摄取清除率(mL·min-1·mg-1),Km为Michaelis-Menten常数(μmol·L-1),Vmax为最大摄取率(nmol·min-1·mg-1)。
1.8细胞样品处理 各孔加入水 300 μL,超声裂解细胞。取细胞裂解液140 μL,加入内标工作液20 μL(0.5 μg·mL-1)和甲醇40 μL,涡旋3 min,12 000 r·min-1离心5 min,取上清液180 μL进行液相色谱-质谱串联(LC-MS/MS)分析。另取BCA试剂盒(Thermo Fisher)定量蛋白。
2 结果
2.1LC-MS/MS法的建立与验证 空白细胞裂解液、空白细胞裂解液加入乌头碱、新乌头碱和次乌头碱对照品和内标,以及实测样品的典型LC-MS/MS图谱见图1,目标物和内标峰形尖锐,空白细胞对测定无干扰,方法专属性良好。以目标物和内标响应值比值f对细胞裂解液中药物浓度C进行权重回归(权重系数1/C2),乌头碱、新乌头碱和次乌头碱在0.143~143 nmol·L-1线性关系良好,典型回归方程分别为:f=0.039 5C-0.000 7(r=0.997 8),f=0.045 7C-0.0007(r=0.996 5),f=0.053 2C-0.000 8(r=0.997 5)。附子生物碱在细胞裂解液中的最低定量限为0.143 nmol·L-1,完全能满足药物摄取实验中细胞样品的检测要求。此外,方法的准确度、精密度和稳定性等均符合生物样品的分析要求。
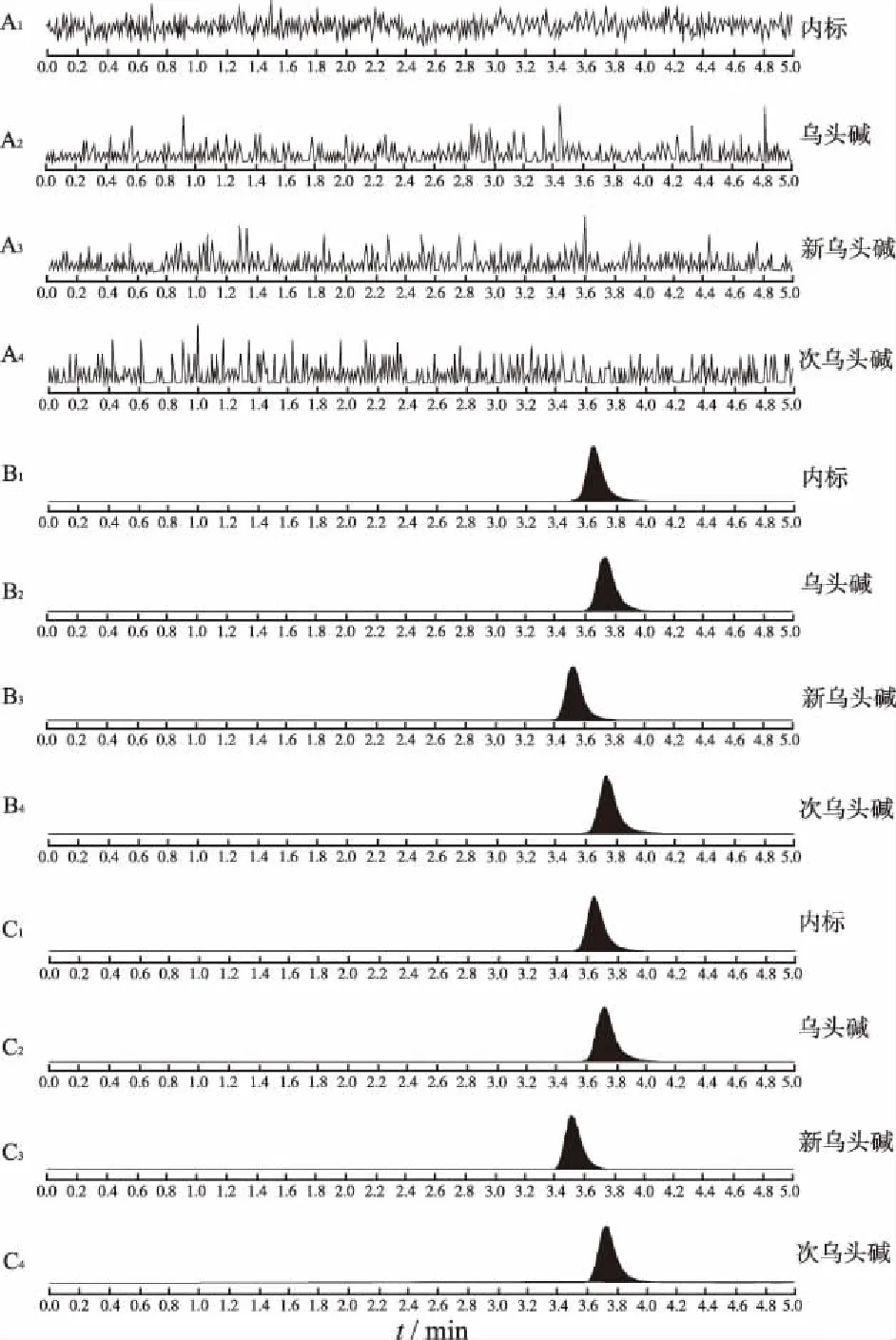
A.空白细胞裂解液;B.空白细胞裂解液加入附子生物碱对照品和内标;C.药物摄取实验中细胞样品
图1 LC-MS/MS测定HepG2细胞中附子生物碱的典型色谱图
A. blank cell lysis buffer; B. cell lysis buffer spiked with references of Fuzi alkaloids and internal standard; C. cell sample in drug uptake test
Fig.1RepresentativeLC-MS/MSchromatogramsofFuzialkaloidsinHepG2cells
2.2HepG2细胞摄取
2.2.1时间及温度依赖性 乌头碱、新乌头碱和次乌头碱的细胞摄取量随着时间增加而增加。孵育1 min时,乌头碱、新乌头碱和次乌头碱在4 ℃下摄取量仅为37 ℃摄取量的10.0%,11.1%和13.8%(图2)。
2.2.2浓度依赖性 给予细胞不同浓度附子生物碱(1~800 μmol·L-1),附子生物碱的摄取量逐渐增加并趋于饱和(图3)。药动学分析得出乌头碱、新乌头碱和次乌头碱的米氏常数Km分别为248.1,69.15,26.89 μmol·L-1,药物最大摄取率Vmax分别为5.136,2.195,1.139 nmol·min-1·mg-1,Pdif分别为2.58,8.86,2.78 μL·min-1·mg-1。
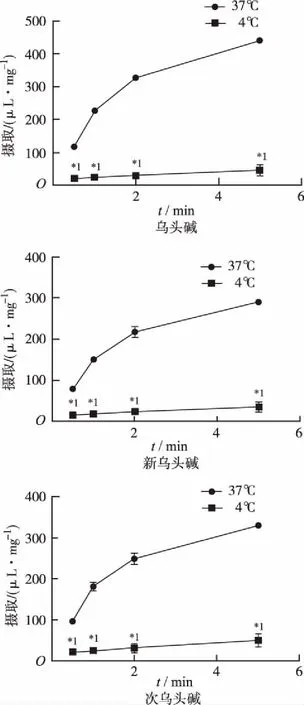
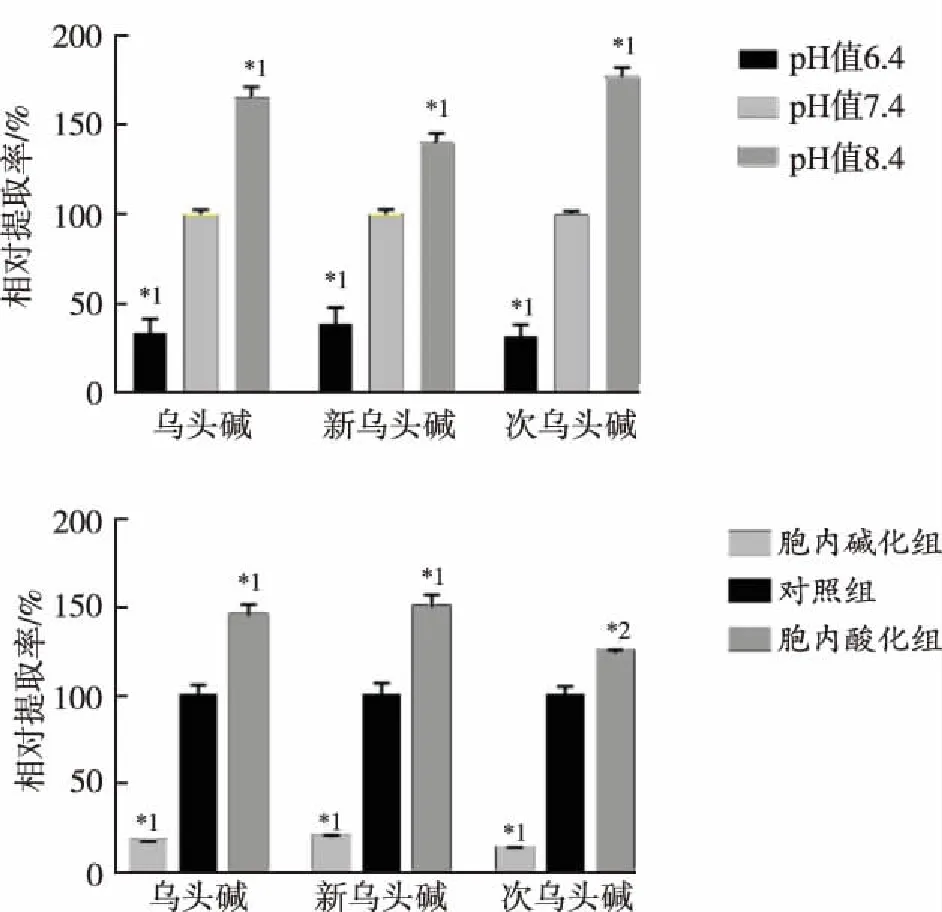
与37 ℃比较,*1P<0.01
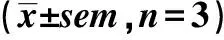
Compared with 37 ℃,*1P<0.01
2.2.3能量依赖性 当给予能量抑制剂叠氮化钠后,3种附子生物碱的摄取量均显著下降(图4)。
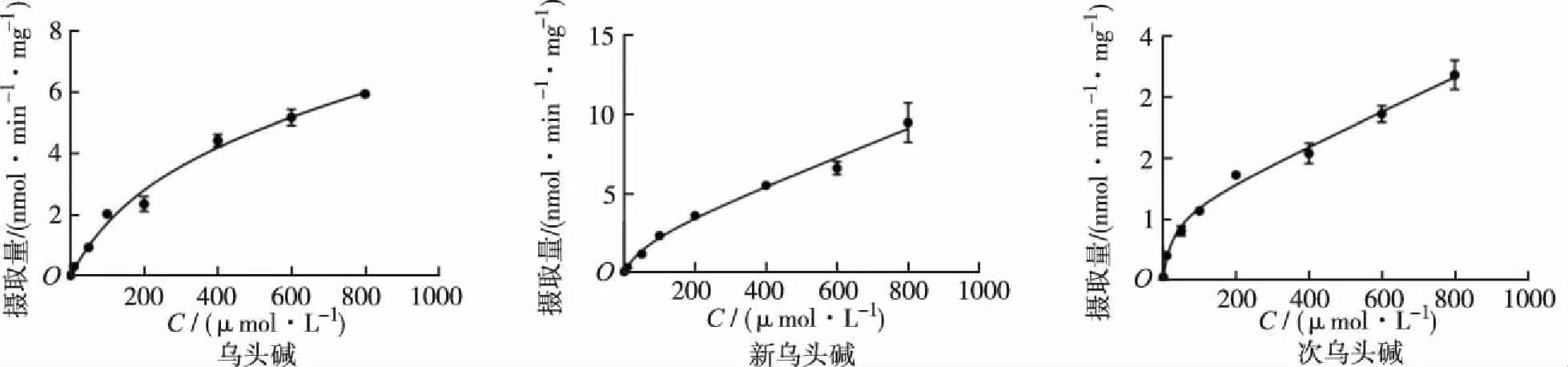
图3 孵育液中药物浓度对附子生物碱在HepG2细胞中摄取的影响
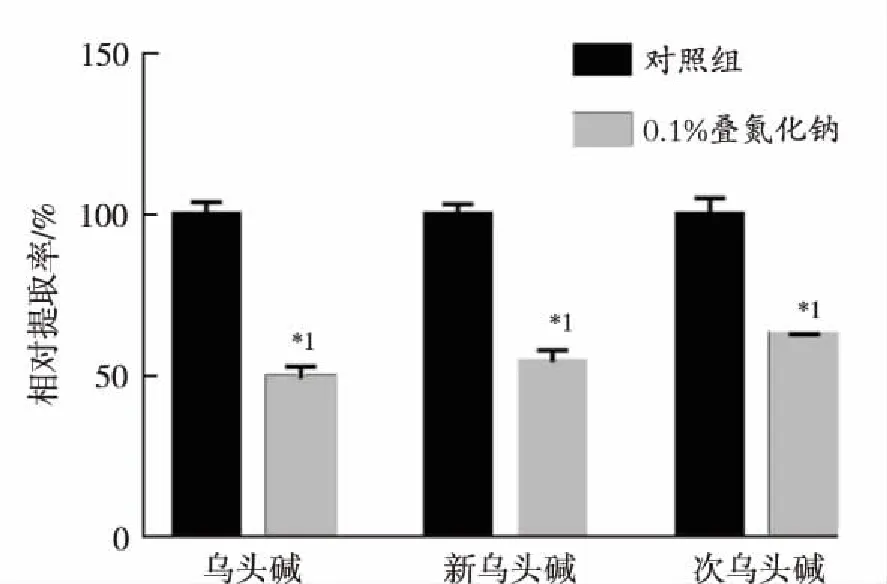
与对照组比较,*1P<0.01
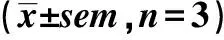
Compared with control group,*1P<0.01
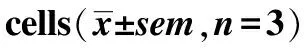
2.2.4pH依赖性 给予化学解耦联剂FCCP后,附子生物碱的摄取量均显著下降(图5),此外,当细胞处于胞外酸化(pH值6.4)或胞内碱化(Acute)时,乌头碱、新乌头碱和次乌头碱的摄取量均显著下降;但当胞外碱化(pH值 8.4)或胞内酸化(Pre)时,目标物的细胞摄取量显著增加(图6)。
2.2.5转运蛋白抑制剂的影响 不同类型的抑制剂对附子生物碱的细胞摄取有不同影响(表1)。吡拉明、奎尼丁、维拉帕米、苯海拉明及金刚烷胺可显著降低附子生物碱的摄取量,而四乙胺、MPP+、乙胺嘧啶及L-肉碱对药物的摄取量基本没有影响。
2.2.6Trans-stimulation试验 吡拉明(0.5 mmol·L-1)或苯海拉明(0.5 mmol·L-1)预孵育细胞30 min后,移去孔内溶液,开始细胞摄取实验,结果表明乌头碱、新乌头碱和次乌头碱的摄取量均显著增加(图7)。
3 讨论
肝细胞基底膜上存在多种摄取转运蛋白,可影响药物在肝脏中的组织分布,从而影响药物的药效与安全性[18]。附子具有肝脏毒性[13],且乌头碱和新乌头碱在人体肝脏中具有较高的组织分布[14]。为指导复方配伍研究与临床安全用药,笔者以HepG2细胞为体外模型,首次研究了附子毒性生物碱进入肝脏的摄取机制。结果表明,乌头碱、新乌头碱和次乌头碱的肝脏摄取均存在温度依赖性、时间依赖性和浓度依赖性,并可被能量抑制剂叠氮化钠抑制,HepG2细胞对附子生物碱的摄取主要由转运蛋白介导。pH依赖性实验表明附子生物碱的肝脏摄取依赖于反向的质子梯度。由于肝脏的胞内pH值为(6.99±0.03)[19],能够促进附子生物碱摄取进入肝脏。

与对照组比较,*1P<0.01
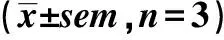
Compared with control group,*1P<0.01
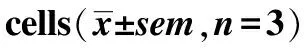
与对照组比较,*1P<0.01,*2P<0.05
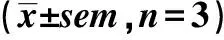
Compared with control group,*1P<0.01,*2P<0.05
表1 抑制剂对附子生物碱在HepG2细胞中摄取的影响
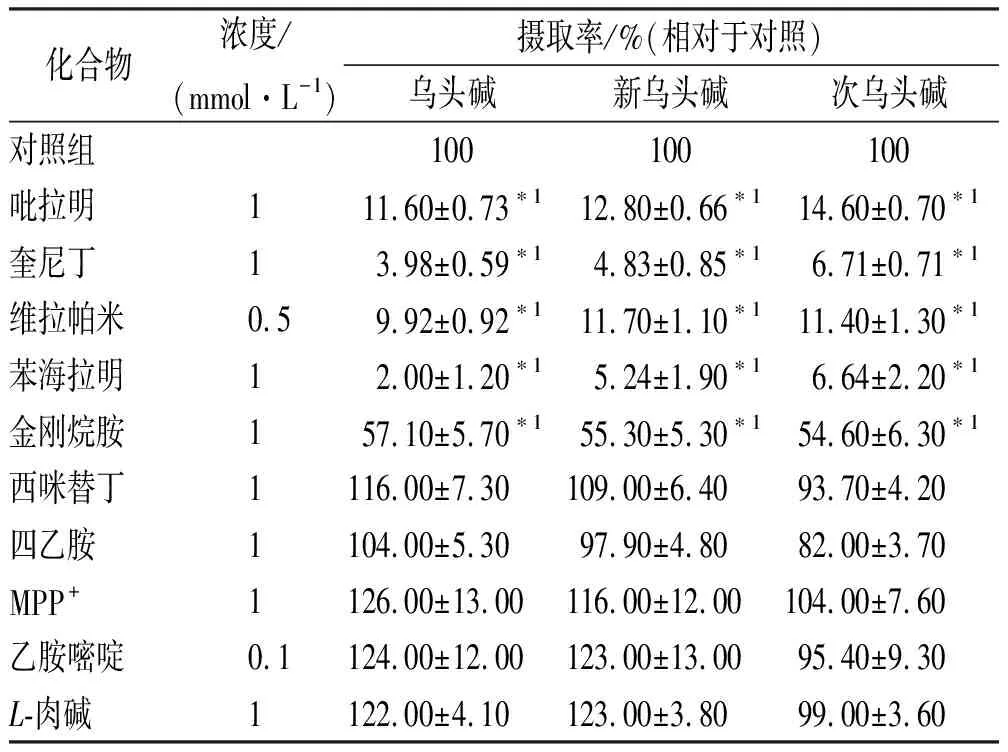
化合物浓度/(mmol·L-1)摄取率/%(相对于对照)乌头碱新乌头碱次乌头碱对照组 100 100 100吡拉明111.60±0.73∗112.80±0.66∗114.60±0.70∗1奎尼丁13.98±0.59∗14.83±0.85∗16.71±0.71∗1维拉帕米0.59.92±0.92∗111.70±1.10∗111.40±1.30∗1苯海拉明12.00±1.20∗15.24±1.90∗16.64±2.20∗1金刚烷胺157.10±5.70∗155.30±5.30∗154.60±6.30∗1西咪替丁1116.00±7.30109.00±6.4093.70±4.20四乙胺1104.00±5.3097.90±4.8082.00±3.70MPP+1126.00±13.00116.00±12.00104.00±7.60乙胺嘧啶0.1124.00±12.00123.00±13.0095.40±9.30L-肉碱1122.00±4.10123.00±3.8099.00±3.60
与对照组比较,*1P<0.01
Compared with control group,*1P<0.01
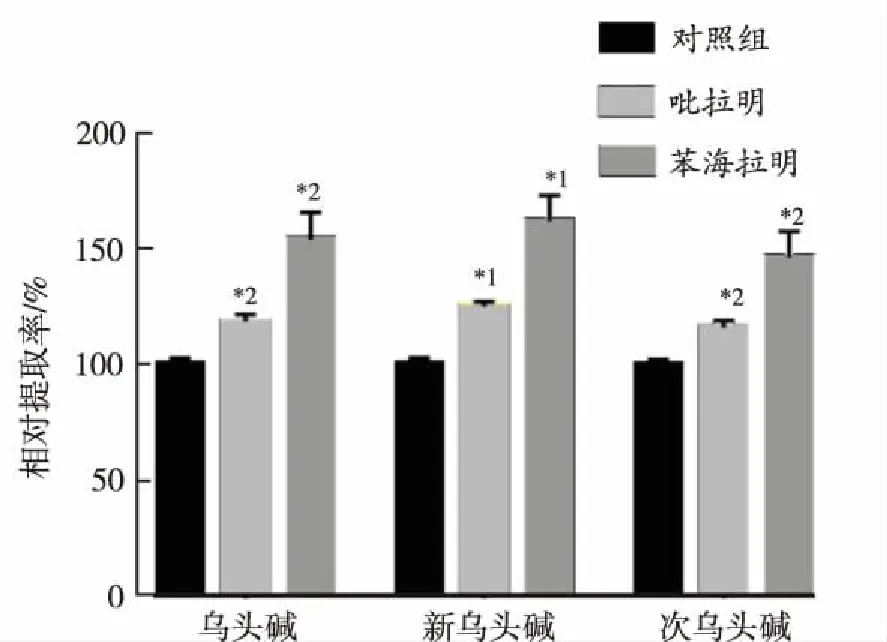
与对照组比较,*1P<0.01,*2P<0.05
Compared with control group,*1P<0.01,*2P<0.05
生理条件下附子生物碱主要以阳离子形式存在。目前已知的有机阳离子转运系统包括有机阳离子转运蛋白(organic cation transporters,OCTs)、有机阳离子/肉毒碱转运蛋白(organic cation/carnitine transporters,OCTNs)、多药及毒素外排转运蛋白(multidrug and toxin extrusion transporters,MATEs)及质膜单胺转运蛋白(plasma membrane monoamine transporter,PMAT)。然而,这些已知转运蛋白的典型底物或抑制剂,例如四乙胺(OCTs、OCTNs、MATEs的底物[20-24])、MPP+(OCTs、PMAT和MATE1的底物[25-28])、L-肉碱(OCTN2的底物[29])及乙胺嘧啶(MATEs的抑制剂[30])对细胞摄取基本没有影响。近年来,还发现一种具有全新转运特性、吡拉明敏感的有机阳离子/质子逆向转运蛋白(pyrilamine-sensitive proton-coupled organic cation antiporter)[17,31-34],其抑制剂,如吡拉明、苯海拉明、维拉帕米和奎尼丁等可显著降低乌头碱、新乌头碱和次乌头碱的细胞摄取。此外,吡拉明或苯海拉明预孵育可显著促进细胞对附子生物碱的摄取,提示这些化合物可能是相同转运蛋白的底物。
综上所述,该新型有机阳离子/质子逆向转运蛋白可能是附子中主要毒性生物碱进入肝脏的分子基础。临床上很多药物是有机阳离子转运系统的底物或抑制剂[35- 36],可能会与附子生物碱发生转运蛋白介导的药物相互作用,减少其肝组织分布,进而增加系统暴露量,发生毒副作用,临床上应加以关注。
