7-甲氧基-4’-羟基异黄酮促进大鼠成骨细胞成骨性分化的作用机制*
2019-06-17宋明甲文益民吴晓燕柴晓亮周建
宋明甲,文益民,吴晓燕,柴晓亮,周建
(中国人民解放军联勤保障部队九四○医院1.脊柱外科;2.骨科研究所,兰州 730050)
大豆苷元和黄酮可提高骨密度和增加骨胳矿盐的含量,改善骨胳微观结构[1],但其作用机制尚不清楚。有人通过结构类推,黄酮类化合物具有类似于雌激素样的结构,所以异黄酮可能通过雌激素信号机制促进骨形成。系列研究表明,大豆异黄酮能治疗去卵巢大鼠模型的骨质疏松症,减少去卵巢造成的骨丢失,且对生殖器官无雌激素样作用[2-3],因此异黄酮通过雌激素信号途径调节骨形成并不是其主要作用机制。前期研究表明,异黄酮通过提高一氧化氮(NO)含量发挥改善心血管疾病作用[4]。因此,笔者通过体外培养成骨细胞观察研究黄豆苷元杂质7-甲氧基-4’-羟基异黄酮(7-methoxy-4’-hydroxyisoflavone,MHIF)对NO/cGMP/sGC信号通路的作用机制。
1 材料与方法
1.1实验动物 无特定病原体(SPF)级大鼠,出生2 d内,购于甘肃中医药大学动物实验中心,实验动物生产许可证号:SCXK(甘) 2016-0006。
1.2试剂 7-甲氧基-4’-羟基异黄酮(MHIF,中国食品药品检定研究院,批号:100348-201102,含量:100%),胎牛血清(兰州荣晔生物生物公司,批号:RF-32-01);达尔伯克改良伊格尔培养基(Dulbecco's modified Eagle's medium,DMEM,美国Gibco公司,批号:11054020);β-磷酸甘油钠、维生素C(批号:A4403)、地塞米松(批号:D4902)、青霉素(批号:M7292)、链霉素(批号:V900929),均购于美国Sigma公司;Ⅱ型胶原酶(Invitrogen公司,批号:17100-017);sGC一抗(美国abcam公司,批号:ab155651);PKG-1一抗(cell signaling公司,批号:#3248);辣根过氧化酶标记二抗(北京Bioword有限公司,批号:BS10043);BCA蛋白定量试剂盒(索莱宝生物公司,批号:F8060);骨钙素测定试剂盒(南京建成生物工程公司,批号:H152),一氧化氮(NO,南京建成生物工程公司,批号:A012-1)、碱性磷酸酶(alkaline phosphatase,ALP)测定试剂盒(南京建成生物工程公司,批号:A059-2);一氧化氮合成酶阻断剂N-单甲基-L- 精氨酸(N-monomethyl-L-arginine,L-NMA,批号:475886)和可溶性的腺苷酸环化酶(ODQ,批号:495320)购于美国Sigma公司。
1.3仪器 酶标仪(BIoTek公司,型号:EPOCH);离心机(湖南湘仪公司,型号:Primo R)。
1.4大鼠原代成骨细胞培养 大鼠原代颅骨成骨细胞[4],无菌条件下,取出生2 d内SPF级大鼠颅骨,剔除骨膜及软组织,将骨片剪成碎片,用0.25%胰蛋白酶于37 ℃水浴酶解2次,每次10 min,弃消化液。0.1%Ⅱ型胶原酶于37 ℃水浴连续消化4次,第1次10 min消化结束后弃掉消化液,以后每次水浴消化20 min,结束后收集消化液,加入含有10%胎牛血清DMEM终止消化,收集液200×g离心10 min,弃上清液,用含10%胎牛血清DMEM悬浮细胞沉淀。以3×104·mL-1的浓度接种培养中,37 ℃、5%二氧化碳(CO2)、饱和湿度条件下培养,每隔3 d换液一次,待细胞长至80%融合时传代培养。
1.5成骨细胞的药物处理 待成骨细胞传代培养融合生长达到80%~90%时,使用不同浓度 (10-4,10-5,10-6,10-7和10-8mol·L-1) MHIF对成骨细胞进行处理,其中对照组补加与药物组等体积药物溶剂(DMSO),药物浓度参考前期文献报道黄酮类化合物[4],使用不同浓度MHIF对成骨细胞进行处理后,通过测定ALP活性找到最合适浓度的药物浓度。
1.6成骨细胞的阻断剂处理 待成骨细胞传代培养融合生长达到80%~90%时,加入100 μmoL·L-1的L-NMA预处理成细胞,然后对成骨细胞进行随机分组,使用10-6mol·L-1MHIF进行处理检测各项结果。
1.6.1碱性磷酸酶活性的测定 MHIF处理成骨细胞后,使用碱性磷酸酶试剂盒测定其活性。具体操作参见说明书,按照1:1的比例分别加入基质液1和基质液2,然后37 ℃水浴15 min后加入显色剂,避光混匀后在507 nm波长测定吸光度(A)值,然后依据说明书换算成金氏单位。
1.6.2骨钙素含量测定 MHIF处理成骨细胞后,测定培养液中骨钙素含量。收集血清,室温放置5 min 后,400×g离心10 min,检测骨形成指标骨钙素含量。严格按照EIA kit试剂盒说明书测定,测定结束后,严格按照测定A值和标准品浓度制作标准曲线。
1.6.3NO含量检测 MHIF处理后,每组取培养液 500 μL,测定培养液中硝酸盐含量,以硝酸盐含量来反映一氧化氮(NO)生成量。具体操作按照硝酸还原酶法一氧化氮试剂盒说明书。将各样品加至96孔板中,紫外分光光度计上测定波长550 nm处A值,利用NO含量计算公式计算出样本NO含量。
1.6.4cGMP含量检测 MHIF处理后,用4 ℃预冷磷酸盐缓冲液(PBS)漂洗培养细胞3次,每皿细胞加入0.25%胰蛋白酶1.5 mL收集细胞,4 ℃、200×g离心10 min,弃上清液,加PBS 200μL涡旋震荡混匀,沸水浴10 min。冷却后,5000×g离心10 min,采用酶联免疫吸附测定(ELISA)法定量检测环磷酸鸟苷(cGMP)。紫外分光光度计测定450 nm波长处A值,根据标准品的浓度及对应的A值计算出浓度。
1.6.5蛋白电泳 MHIF处理成骨细胞后,开始提取总蛋白,取出培养成骨细胞后PBS漂洗2次,每一个60 mm皿中加入蛋白裂解液300 μL,放免沉淀检测法(radio immunoprecipitation assay,RIPA),低温静置裂解30 min,收集裂解液,5000×g离心离心30 min,收集上清液,取出20 μL,BCA法测定蛋白浓度,加上样缓冲液,煮沸变性10 min,-20 ℃冰箱保存备用。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)检测蛋白电泳,按照每孔总蛋白上样量为20 μg,根据BCA定量蛋白浓度计算上样体积,在电泳结束后,将SDS上蛋白转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,转膜条件:电流280 mA转膜60~80 min,转膜结束后5%脱脂奶粉封闭2 h,加入sGC和PKG一抗(1:1000稀释),4 ℃孵育过夜,结束后摇床振荡洗膜3次,每次10 min,加入二抗37 ℃孵育1.5 h,洗膜3次,每次10 min,暗室加入电致化学发光(electrochemiluminescence,ECL)发光液检测蛋白的表达情况,用X射线片记录结果,IPP6.0扫描蛋白条带灰度。

2 结果
2.1MHIF对成骨细胞作用浓度筛选 结果见图1。10-6mol·L-1MHIF为促进成骨细胞最合适浓度。实验数据显示,10-4~10-6mol·L-1MHIF处理成骨细胞,随着药物浓度降低,ALP活性逐渐升高,其中10-6mol·L-1组ALP活性最高为71.23 U·g-1,然而,MHIF在10-6~10-8mol·L-1,随着浓度降低,ALP活性也逐渐降低。


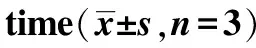
2.2MHIF对成骨细胞骨钙素表达的影响 结果见图2。实验结果显示,骨钙素的表达与MHIF具有浓度依赖性,10-6mol·L-1MHIF组骨钙素含量最高,为633 ng·mL-1。


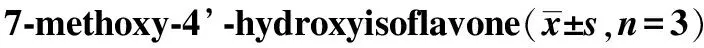
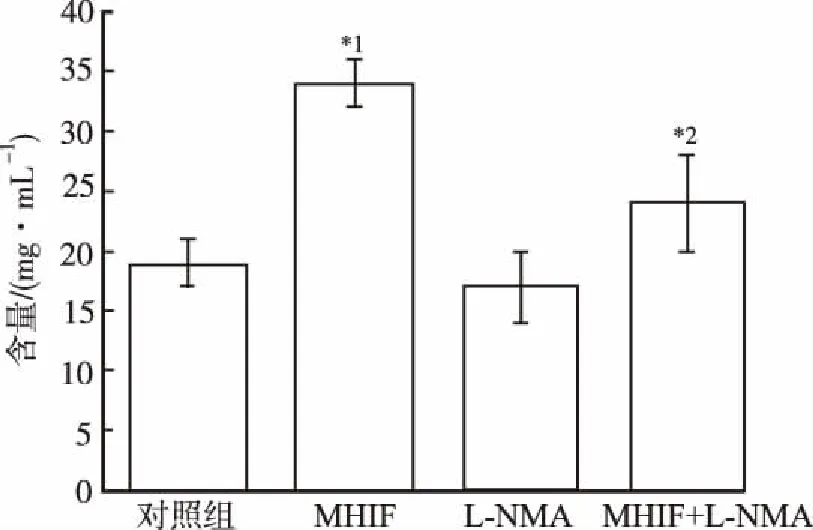
2.3L-NMA对MHIF提高ALP活性的影响 实验结果显示,MHIF组ALP活性显著高于对照组(P<0.01),MHIF组ALP活性显著高于L-NMA+MHIF组(P<0.05),其他组间比较差异无统计学意义,见图3。
2.4L-NMA对MHIF提高成骨细胞骨钙素含量影响 实验结果显示,MHIF组骨钙素含量高于对照组(P<0.01),MHIF组骨钙素含量显著高于L-NMA+MHIF组(P<0.01),其他组间比较差异无统计学意义。见图4。

与对照组比较,*1P<0.01;与MHIF组比较,*2P<0.05

Compared with control group,*1P<0.01; Compared with MHIF group,*2P<0.05
Fig.3EffectofL-NMAtreatmentonALPactivityenhancementbyMHIF
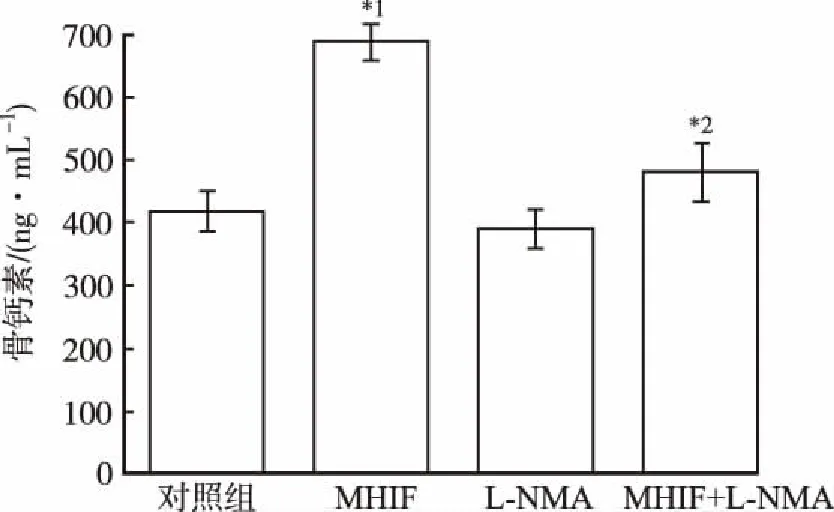
与对照组比较,*1P<0.01;与MHIF组比较,*2P<0.01

Compared with control group,*1P<0.01; Compared with MHIF group,*2P<0.01
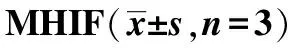
2.5L-NMA对MHIF提高成骨细胞NO浓度的影响 实验结果显示,MHIF组NO含量高于对照组(P<0.01),MHIF组NO含量显著高于L-NMA+MHIF组(P<0.05),其他组间比较差异无统计学意义。见图5。
2.6L-NMA对MHIF提高成骨细胞cGMP浓度的影响 实验结果显示,MHIF组cGMP含量高于对照组(P<0.01),MHIF组cGMP含量显著高于L-NMA+MHIF组(P<0.05),其他组间比较差异无统计学意义。见图6。
2.7对成骨细胞sGC和PKG蛋白表达影响 结果见图7。L-NMA处理成骨细胞后,MHIF提高sGC和PKG蛋白的表达水平受到抑制。

与对照组比较,*1P<0.01;与MHIF组比较,*2P<0.05

Compared with control group,*1P<0.01; Compared with MHIF group,*2P<0.05
Fig.5EffectofL-NMAtreatmentonNOenhancementbyMHIF
与对照组比较,*1P<0.01;与MHIF组比较,与*2P<0.05

Compared with control group,*1P<0.01; Compared with MHIF group,*2P<0.05
Fig.6EffectofL-NMAtreatmentoncGMPenhance-mentbyMHIF

图7 MHIF对体外培养成骨细胞内sGC和PKG蛋白表达水平的影响
Fig.7EffectofMHIFontheproteinexpressionofsGCandPKGinosteoblastsculturedinvitro
3 讨论
近年来,研究发现黄酮类化合物具有重要的药理活性,尤其是对骨代谢调节作用,但具体机制尚未完全清楚。笔者在本研究首先研究不同浓度MHIF对体外培养大鼠颅骨成骨细胞的骨形成活性的影响,1×10-6mol·L-1MHIF能显著提高成骨细胞中ALP活性和骨钙素含量,并且存在一定剂量依赖性。目前研究表明,通过提高血管内皮细胞一氧化氮改善心脑血管疾病[5],本实验研究MHIF促进体外培养成骨细胞成骨性分化过程中是否激活NO信号通路。
成骨细胞在骨代谢过程中扮演着骨形成的角色,如果能有效促进成骨细胞成骨性分化,那么就能促进骨形成。因此,本研究通过体外培养大鼠颅骨成骨细胞在不同的药物干预后其成骨性分化的相关指标,碱性磷酸酶和骨钙素是成骨细胞成骨性分化的标志性指标,因此首先从ALP活性和骨钙素含量水平[6],筛选最佳促进成骨细胞成骨性分化的的最适浓度为10-6mol·L-1,同时实验结果表明促进体外培养成骨细胞分化过程具有剂量依赖性,黄酮类化合物调节骨骼代谢存在剂量的依赖性。
NO参与调控多种生理过程,包括骨重建[7-8]。NO可结合到可溶性鸟苷酸环化酶(soluble guanylate cy-clase,sGC)的血红素基团上,提高该酶活性[9],由此引起cGMP水平升高,从而导致 cGMP 依赖性蛋白激酶级联激活,以及进一步激活下游信号通路发挥生理活性作用。体外研究表明,由成骨细胞自身产生的少量 NO,可能是成骨细胞内生长因子产生的调节剂[10-12]。NO 供体内 NO 的缓慢释放诱导体外成骨细胞的生长和分化[10]。实验结果显示,MHIF促进体外培养成骨细胞成熟与矿化过程中激活NO信号途径。使用L-NMA预处理成骨细胞后发现,MHIF促进成骨细胞中ALP活性和骨钙素含量的能力受到抑制,因此初步证明MHIF促进体外培养成骨细胞分化过程中需要激活一氧化氮合酶参与其中。其次,本研究进一步观察发现,一氧化氮合酶活性被抑制后,MHIF提高成骨细胞NO和cGMP含量均受到抑制,以成骨细胞中sGC和PKG蛋白的表达水平也受到抑制,因此进一步证明MHIF在促进成骨细胞骨形成过程中通过NO/cGMP/sGC信号过程发挥作用。
成骨细胞在骨形成过程中发挥重要作用,因此,本实验应用成骨细胞研究MHIF对体外培养成骨细胞的药理活性,以及其促进成骨性分化的分子机制,实验结果表明MHIF在促进体外培养成骨细胞成骨性分化过程中激活NO信号通路,实验因此推测这个机制为MHIF调节骨代谢可能机制之一,此实验结果为异黄酮类化合物的药物促进活性的机制奠定基础,下一步有待从动物实验水平证明其活性和作用机制。
