重楼总皂苷对肝癌HepG2细胞放射敏感性的影响*
2019-06-17钟勇但卫斌谢俊杰刘江勇邵志雄易峰涛邓波
钟勇,但卫斌,谢俊杰,刘江勇,邵志雄,易峰涛,邓波
(1.湖北省通城县人民医院肿瘤科,咸宁 437400; 2.中国人民解放军中部战区总医院放射治疗科,武汉 430070;3.中国人民解放军中部战区总医院放射科,武汉 430070;4.湖北省咸宁市中心医院肿瘤中心,咸宁 437000)
原发性肝癌是我国第四常见的恶性肿瘤,在肿瘤相关致死病因中排名第三,严重威胁人民的健康和生命[1-2]。过去考虑全肝耐受放射剂量较低、放射线对于周围正常组织的影响,很难提高肝脏肿瘤的靶区放射剂量,所以放射治疗(放疗)在肝癌治疗中的应用有限。近年来,随着对放射生物学及放射物理学的不断认识、放疗技术及设备的不断发展,使放疗在肝癌治疗中的应用更加广泛。但肿瘤的辐射抗性以及大剂量照射对正常肝组织的损伤仍然是肝癌放疗中难以突破的瓶颈。重楼是我国传统中药,具有清热解毒、凉肝定惊、消肿镇痛等功效,现代药理研究发现它具有抗病毒、抗肿瘤、免疫调节等功效[3]。重楼总皂苷(Rhizomaparidistotal saponins,RPTS)是重楼的主要成分,研究发现它对骨肉瘤、乳腺癌、结直肠癌、胶质瘤在内的多种实体瘤均具有一定的抗肿瘤作用,其机制主要与细胞毒性作用、免疫调节作用、抑制肿瘤血管生成、降低肿瘤细胞耐药性等有关[4-6]。目前关于RPTS抗肝癌作用的研究时有报道,但有关其对肝癌细胞放射敏感性影响的研究尚不多见。因此,笔者拟通过观察RPTS对肝癌HepG2细胞增殖、细胞周期及凋亡情况的影响,并进一步研究其对肝癌细胞中MUC-1蛋白表达情况的影响,从而探讨RPTS对肝癌细胞放射敏感性的影响及其可能机制,为探索中医药在肝癌放疗中的应用、增强肝癌放疗疗效提供理论依据。
1 材料与方法
1.1实验药品及试剂 RPTS由成都曼思特生物科技有限公司(批号:A0125,含量≥98%)提供,实验前用二甲亚砜(DMSO)配制成一定浓度的保存液,保存于-20 ℃条件下,实验时用小剂量伊格尔培养液(MEM)配制成不同浓度的药液。CCK-8试剂盒(C0038)购于上海碧云天生物技术有限公司;碘化丙啶(PI)染色试剂盒(PAB180014)及Annexin V-FITC/PI凋亡试剂盒(PAB180012)均购自bio-Swamp公司;BCA蛋白浓度测定试剂盒(P0010S)购于上海碧云天生物技术有限公司;鼠抗MUC-1抗体[C595(NCRC48)]购自Abcam公司。
1.2细胞与细胞培养 肝癌HepG2细胞购于中国典型培养物保藏中心(武汉大学保藏中心),用MEM Hyclone培养基、10%胎牛血清、青霉素-链霉素溶液配置成的完全培养基培养于37 ℃、5%二氧化碳(CO2)饱和湿度的细胞培养箱中,实验时取对数生长期细胞备用。
1.3照射方法 采用瑞典医科达直线加速器(规格型号:ELEKTA-Precise)6 MV X线进行照射。设照射野大小为16 cm×16 cm,采用设源皮距(SSD)照射技术,SSD为100 cm,板缘距离射野边缘约2 cm,剂量率为200 cGy·min-1,照射剂量设为单次8 Gy。
1.4CCK-8法检测RPTS对HepG2细胞的增殖抑制作用 取指数生长期细胞,配制成4×103个·mL-1的单细胞悬液,保持每孔100 μL接种于96孔板中,复孔3个,置于37 ℃、5%CO2饱和湿度的培养箱中培养24 h,待细胞贴壁后,再给予不同浓度的RPTS(0.0,30,60,120,240 μg·mL-1)干预细胞,每个浓度设5个复孔,每个96孔板边缘均加入磷酸盐缓冲液(PBS)100 μL,再分别继续培养24,48,72 h。然后吸出原液,PBS洗涤1次,每孔中加入用MEM稀释的CCK-8 100 μL,再置于培养箱中继续孵育3 h。用酶联免疫吸附测定(ELISA)法测定每孔在波长450 nm处吸光度(A值),再根据公式计算细胞增殖抑制率。实验重复3次。细胞增殖抑制率(%)=[(用药组A值-空白组A值)/(阴性组A值-空白组A值)]×100%。
1.5流式细胞术检测细胞周期变化及细胞凋亡情况 取对数生长期细胞,清洗消化后制成3×105个·mL-1的单细胞悬液,接种于6孔板中,置于培养箱中继续培养24 h,待细胞贴壁后再分别设空白对照组、RPTS组、单纯照射组、照射+RPTS组。空白对照组:用正常培养液继续培养48 h;RPTS组:用低细胞毒性浓度的RPTS(25 μg·mL-1)干预48 h;单纯照射组:先用正常培养液继续培养48 h,再用6 MV的X线进行照射;照射+RPTS组:先用低细胞毒性浓度的RPTS(25 μg·mL-1)干预48 h,再用6 MV的X线进行照射。照射完成后用PBS洗涤2次,胰酶消化,离心收集细胞,并重悬于Binging Buffer 200 μL中,再根据PI染色试剂盒及Annexin V-FITC/PI凋亡检测试剂盒的说明书进行细胞染色,最后用流式细胞仪检测细胞周期分布及凋亡情况。实验重复3次。
1.6Western blotting检测MUC-1蛋白表达情况 细胞培养和分组方法同“1.5”项。照射完成后收集细胞并提取蛋白,再根据BCA蛋白浓度测定试剂盒说明书测定各组蛋白的含量,每组样品各取蛋白30 μg进行上样,根据Western blotting法操作步骤检测各组中MUC-1蛋白的表达情况。实验重复3次。

2 结果
2.1RPTS抑制HepG2细胞增殖 与空白对照组比较,RPTS能明显抑制HepG2细胞增殖,其抑制率随药物浓度的增加、作用时间的延长明显增大。见图1。
2.2RPTS对细胞周期的影响 RPTS可影响HepG2细胞的周期分布,减少G0/G1期细胞分布率,将细胞阻滞于S期(t=16.4136,P<0.05);在RPTS干预细胞48 h后再进行细胞照射,S期细胞明显减少(t=13.4513,P<0.05),而G0/G1期以及G2/M期细胞变化不显著。见表1。
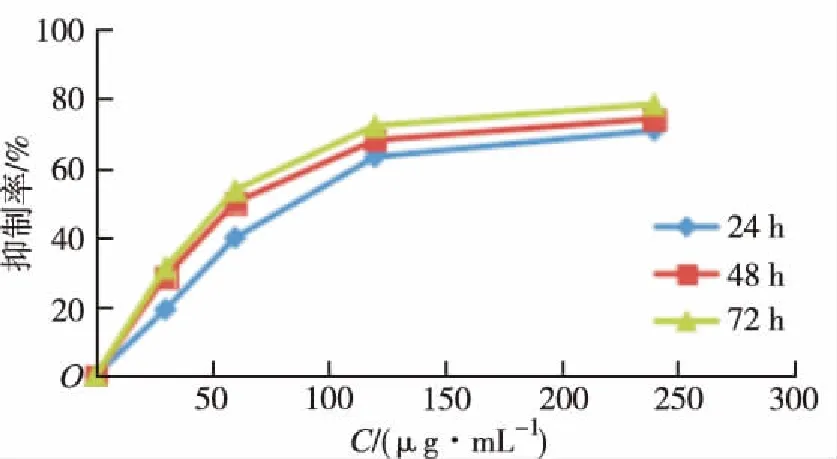
图1 RPTS对HepG2细胞生长抑制曲线
Fig.1GrowthinhibitioncurveofRPTSonHepG2cells
表1 4组HepG2细胞作用48 h后细胞周期分布情况

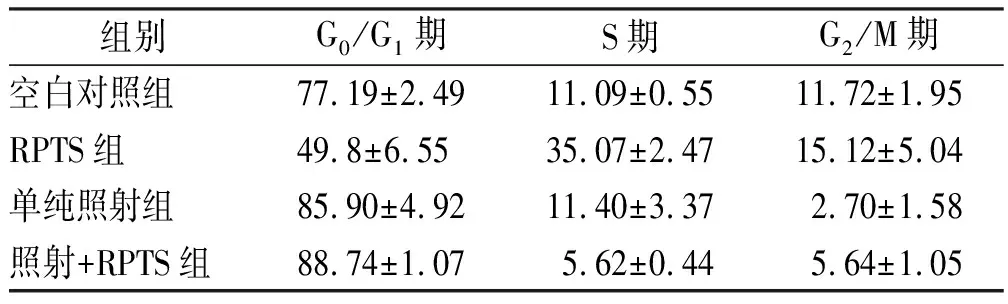
组别G0/G1期S期G2/M期空白对照组77.19±2.4911.09±0.5511.72±1.95RPTS组49.8±6.5535.07±2.4715.12±5.04单纯照射组85.90±4.9211.40±3.372.70±1.58照射+RPTS组88.74±1.075.62±0.445.64±1.05
2.3RPTS对HepG2细胞凋亡的影响 与空白对照组比较,RPTS组在RPTS(25 μg·mL-1)干预HepG2细胞48 h后,早期凋亡率和晚期凋亡率均显著增加(t早期=18.700 9,t晚期=34.159 9,P<0.01);与RPTS组比较,单纯照射组及照射+RPTS组早期凋亡率和晚期凋亡率明显增加(t早期=53.565 4,t晚期=2.890 1,P<0.05)。见表2。
表2 4组HepG2细胞48 h后细胞凋亡变化情况

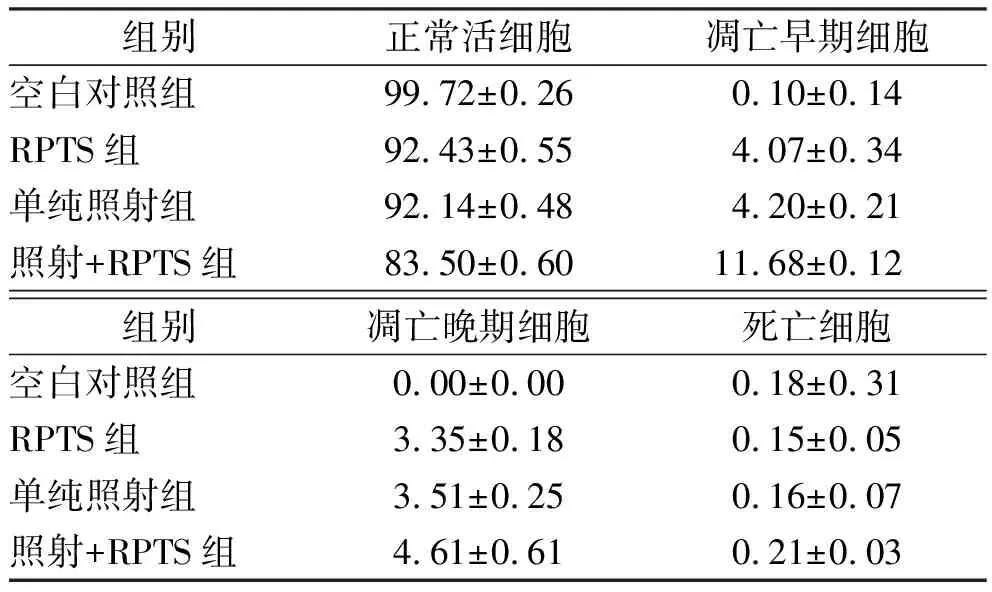
组别正常活细胞凋亡早期细胞空白对照组99.72±0.260.10±0.14RPTS组92.43±0.554.07±0.34单纯照射组92.14±0.484.20±0.21照射+RPTS组83.50±0.6011.68±0.12组别凋亡晚期细胞死亡细胞空白对照组0.00±0.000.18±0.31RPTS组3.35±0.180.15±0.05单纯照射组3.51±0.250.16±0.07照射+RPTS组4.61±0.610.21±0.03
2.4RPTS对MUC-1蛋白表达的影响 RPTS+照射组MUC-1蛋白的表达最低,呈现时间依赖性(t48 h=5.1187,t72 h=4.3864,P<0.05);而RPTS组MUC-1蛋白的表达也明显低于空白对照组,并呈时间依赖性(t48 h=5.5388,t72 h=5.2705;P<0.05)。见图2。

A.空白对照组(48 h);B.空白对照组(72 h);C.RPTS组(48 h);D.RPTS组(72 h);E.单纯照射组(48 h);F.单纯照射组(72 h);G.照射+RPTS组(48 h);H.照射+RPTS组(72 h)
图2 4组HepG2细胞在48和72 h MUC-1蛋白表达
A.blank control group(48 h);B.blank control group(72 h);C.RPTS group(48 h);D.RPTS group(72 h);E.irradiation group(48 h);F.irradiation group(72 h);G.irradiation+RPTS group(48 h);H.irradiation+RPTS group(72 h)
Fig.2ProteinexpressionofMUC-1infourgroupsofHepG2cellsat48hand72h
3 讨论
根据原发性肝癌诊疗规范,对伴有门静脉/下腔静脉癌栓或肝外转移的Ⅲa期、Ⅲb期肝癌患者,可行姑息性放疗;部分患者术前放疗可使肿瘤体积缩小或降期,而获得手术切除机会[7-9];而肝外转移的患者,也可用于等待肝癌肝移植前的治疗,或用于减轻疼痛、梗阻或出血等症状,使肿瘤发展减缓,从而延长生存期[10-12];而中央型肝癌切缘距肿瘤≤1 cm的窄切缘术后需要行辅助放疗降低复发概率[13]。
虽然放疗在肝癌治疗中的应用日趋广泛,但是肿瘤的辐射抗性以及大剂量射线照射对正常组织的损伤仍然是肝癌放疗中难以突破的瓶颈。肝细胞对放射线存在显著的剂量-体积效应,其放射耐受量、再生能力与照射体积-剂量、肝脏的功能状态密切相关[14]。肝功能为Child-Pugh A级时,在常规分割放疗下,全肝的耐受剂量为28~30 Gy[15],在非常规低分割放疗(每次分割剂量4~8 Gy)下,全肝的耐受量为23 Gy[16];肝功能为Child-Pugh B级时,肝脏对射线的耐受量明显下降。考虑到亚洲PLA患者常伴有肝硬化和脾功能亢进,导致胃肠道瘀血和凝血功能差,所以放射耐受剂量更低于临床推荐剂量[17]。而肝脏肿瘤的放疗剂量与低分化鳞癌(如鼻咽癌)相近,致死量约为60 Gy/6周,所以正常肝组织的耐受剂量远低于致死量[18]。因此,寻找高效低毒的放射增敏剂是目前肝癌放射治疗的一个研究热点。
中药具有多靶点、多效性的特点,其毒副作用较低,在改善放疗敏感性方面有其自身的特点,作为放疗辅助用药已广泛应用于恶性肿瘤的防治。许多活血化瘀类中药能通过改善血液循环及组织供氧来实现放疗的增敏作用,如莪术油、川芎嗪、川红注射液、通窍活血汤等中药制剂,通过扩张血管、增加血流、改善微循环、破坏肿瘤组织周围和内部纤维蛋白的聚集、降低血液黏稠度、减轻血管闭塞等作用,提高瘤体的氧效值,改善乏氧细胞放射敏感性[19-20]。而部分中药提取物则通过增强对肿瘤细胞DNA的损伤、抑制乏氧细胞损伤的修复来起到增敏作用,如在乏氧条件下,马蔺子甲素可明显降低HeLa细胞中谷胱甘肽含量,抑制DNA的合成和DNA链断裂后的重接修复,从而起到放射增敏作用[21];另外一些中药提取物则可以通过调节肿瘤细胞周期,从而提高放射敏感性,如β-榄香烯可以提高H460癌细胞株G2/M期细胞比例,从而起到放疗增敏作用[22];还有一些补益固本类中药提取物则能通过诱导肿瘤细胞凋亡、促进DNA分子损伤、抑制肿瘤细胞增殖来实现放疗增敏,如人参皂苷Rg3能通过抑制细胞活性、诱导细胞凋亡及DNA分子损伤来实现对食管癌细胞的放疗增敏[23]。
根据实验结果可知,RPTS能抑制HepG2细胞的增殖,且在一定范围内具有时间和浓度依赖性。从细胞周期分布情况可知,低细胞毒性的RPTS能使HepG2细胞周期分布发生改变;而低细胞毒性的RPTS可协同X线进一步诱导细胞发生凋亡,这说明改变细胞周期分布、诱导细胞凋亡可能是RPTS发挥抗肿瘤作用、提高肝癌细胞放射敏感性的一个重要机制。
MUC-1蛋白是一种在大部分肿瘤细胞中都过量表达的糖蛋白,它与肿瘤血管生成、增殖、转移、以及新陈代谢在内的诸多方面都关系密切[24-28]。MUC-1基因作为原发性肝癌的致癌基因,已被发现具有加速肝癌细胞转移和扩散的能力[29],而JAK/STAT信号通路对肝癌细胞的生长增殖起着至关重要的作用[30],抑制STAT3信号通路能增加肝癌细胞的辐射诱导凋亡[31]。笔者前期的研究也发现[32],MUC-1蛋白能通过激活JAK2/STAT3信号通路提高肝癌细胞的放射抵抗性;而MUC-1蛋白通过JAK2/STAT3信号通路以及抗凋亡蛋白Mcl-1和Bcl-xL的诱导作用抑制辐射诱导的细胞凋亡。这意味着降低MUC-1蛋白的表达可能是提高肝癌放疗敏感性的一个潜在靶点。在本实验中,RPTS能单独抑制HepG2细胞中MUC-1蛋白的表达,而当RPTS与X线联合应用,则能进一步抑制MUC-1蛋白的表达,说明RPTS可协同X线进一步抑制MUC-1蛋白的表达
