新型载体罗汉果苷V对紫杉醇的增溶作用*
2019-06-17王杏利王爽张雷罗玉琴韦铭旻吴春勇张峻颖
王杏利,王爽,张雷,罗玉琴,韦铭旻,吴春勇,张峻颖
(1.中国药科大学中药制药系,南京 211198;2.广东食品药品监督管理局认证审评中心,广州 510080;3.山东省食品药品检验研究院,济南 250101;4.中国药科大学药物分析系,南京 210009)
口服给药简单,方便,患者依从性高,是药物递送的最优选途径。但目前超过40%市售药物、60%研发中药物都存在难溶性问题。得益于载体辅料的开发应用,改善疏水性药物的溶解性和生物利用度已有多种方法,如:使用磷脂复合物、生物相容性聚合物、固体分散体、脂质体或胶束等[1-4]。但目前满足上述方法要求、符合中药成分特性的辅料尤为缺乏。本课题组前期发现一些糖基化苷类化合物在水性环境中,能够形成与表面活性剂相似的结构,可作为固体分散体的载体,实现难溶性药物的高效增溶[5-7]。罗汉果甜苷是罗汉果的甜味成分。植物含量较高且水溶性好,目前已经有纯度98%以上成品用作食品添加剂,其甜度为蔗糖的300倍。罗汉果苷V是罗汉果甜苷的主要成分,是一种天然小分子化合物,由亲水性葡萄糖基和疏水性三萜类两部分组成,与已报道的糖苷类增溶载体结构相似,故选其为载体,以研究其对难溶性药物的增溶效果。罗汉果苷V甜度高,热稳定性好,色泽浅,易于使用,不受pH值(pH值在2~10)的影响。它在中国、美国、日本等一些国家作为非营养性天然甜味剂而闻名[8]。同时,含葡基辅料还可能通过与葡萄糖转运体1(glucose transporter 1,GLUT1)结合实现跨越血-脑屏障,进而实现对目标药物的脑靶向转运[9]。
紫杉醇(paclitaxel,PTX)是一种从短叶红豆杉(taxus brevifolia)茎皮中分离出来的复杂二萜类天然产物[10],由于能够与微管蛋白结合诱导细胞死亡并影响微管动力学[11],紫杉醇在治疗乳腺癌、卵巢癌和非小细胞肺癌方面表现出优异的抗肿瘤活性[12]。然而紫杉醇高度亲脂,水中溶解度低,研究报道显示其在小鼠中的生物利用度<3.6%[13],这一缺陷大大限制紫杉醇的临床应用。已上市产品紫杉醇注射液(Taxol®,商品名:泰素)使用乙醇和聚氧乙烯蓖麻油(50:50)的共溶剂系统来增加其溶解度,由于聚氧乙烯蓖麻油存在显著的毒副作用,如神经毒性、肾毒性、变态反应等[14],给患者的生命健康带来极大的危害。所以,新型载体或辅料的发掘,可为紫杉醇的临床制剂进一步开发提供帮助。
因此,笔者以罗汉果苷V为载体,以紫杉醇为模型药,采用溶剂法制备紫杉醇-罗汉果苷V固体分散体。考察其饱和溶解度和体外溶出特征,通过差示热扫描法(differential scanning calorimetry,DSC)考察紫杉醇在固体分散体中的物理存在形态。
1 仪器与试药
1.1仪器 LC-2010CHT液相色谱仪(含高压泵、柱温箱、自动进样器、紫外检测器、LC solution色谱工作站,日本岛津公司);KQ-250DE型数控超声波清洗器(昆山市超声仪器有限公司);BT125D电子天平(北京赛多利斯科学仪器有限公司,感量:0.01 mg);XW-80A旋涡混合器(海门市其林贝尔仪器制造有限公司);旋转蒸发装置(含N-1100型旋转蒸发仪、OSB-2100型油浴锅,上海爱朗仪器有限公司);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司);DKZ系列电热恒温振荡水槽(上海一恒科技有限公司);2XZ-2型旋片式真空泵(临海市永昊真空设备有限公司);差示扫描量热仪NETZSCH DSC 204(NETZSCH GERAETEBAU GmbH)等。
1.2试药 紫杉醇对照品(阿拉丁,含量:99%,批号:E1822047);罗汉果苷V(成都普瑞法科技开发有限公司,含量:98%,批号:PRF8093001);去离子水;乙腈为色谱纯;其他试剂为分析纯。
2 方法与结果
2.1紫杉醇-罗汉果苷V物理混合物的制备 取紫杉醇适量,按1:5,1:10,1:15,1:20(W/W)添加相应量的罗汉果苷V,置于研钵中研细,混匀,置干燥器中备用。
2.2紫杉醇-罗汉果苷V固体分散体的制备 采用溶剂法制备紫杉醇-罗汉果苷V固体分散体,按1:20(W/W)称取适量紫杉醇和罗汉果苷V,加入适量的80%乙醇,常温下50 Hz超声30 min,置于50 ℃水浴锅中进行减压浓缩干燥60 min,即可得到固体分散体。得到固体状固体分散体,用研钵研磨均匀,置干燥器中备用。
2.3高效液相色谱(HPLC)测定紫杉醇
2.3.1色谱条件 色谱柱:Inertsil®ODS-3(4.6 mm × 250 mm,5 μm);柱温:30 ℃;检测波长:227 nm; 流速:1 mL·min-1;流动相:乙腈-水(65:35)。
2.3.2紫杉醇对照品溶液的配制 精密称定紫杉醇10 mg,置于10 mL棕色量瓶中,加入乙腈5 mL,超声使其溶解,用乙腈定容,配制得浓度约为1 mg·mL-1紫杉醇对照品溶液。
2.3.3罗汉果苷V对照品溶液的配制 精密称定罗汉果苷V 10 mg,置于10 mL棕色量瓶中,加入乙腈5 mL,超声使其溶解,用乙腈定容,配制得浓度约为1 mg·mL-1罗汉果苷V对照品溶液。
2.3.4紫杉醇-罗汉果苷V固体分散体溶液的配制 精密称定紫杉醇-罗汉果苷V固体分散体10 mg,置于10 mL棕色量瓶中,加入乙腈5 mL,超声使其溶解,用乙腈定容,配制得浓度约为1 mg·mL-1紫杉醇-罗汉果苷V固体分散体溶液。
2.3.5专属性实验 分别取空白溶剂、罗汉果苷V对照品溶液、紫杉醇对照品溶液和紫杉醇-罗汉果苷V固体分散体溶液,按“2.3.1”条件,进行HPLC分析,紫杉醇典型色谱图见图1。结果表明,在本色谱条件下,紫杉醇峰形良好,保留时间约为6.8 min,空白溶剂和罗汉果苷V对主峰的测定无干扰。
2.3.6检测限及定量限 取“2.3.2”项制备的紫杉醇对照品溶液,按一定比例稀释,得到一系列浓度溶液,进行HPLC分析,紫杉醇检测限(S/N=3)和定量限(S/N=10)分别为20 ng·mL-1和50 ng·mL-1(n=5)。
2.3.7线性关系考察 取“2.3.2”项制备的紫杉醇对照品溶液,按一定比例稀释,得到浓度分别为0.05,0.1,0.2,1,5,10,25,50 μg·mL-1的标准液,按“2.3.1”项条件进行HPLC分析,以紫杉醇峰面积(A)为纵坐标,紫杉醇浓度(C,μg·mL-1)为横坐标进行线性回归,结果表明紫杉醇在0.05~50 μg·mL-1内线性关系良好,回归方程为:A=44 827C+387.46,R2=1.000 0。
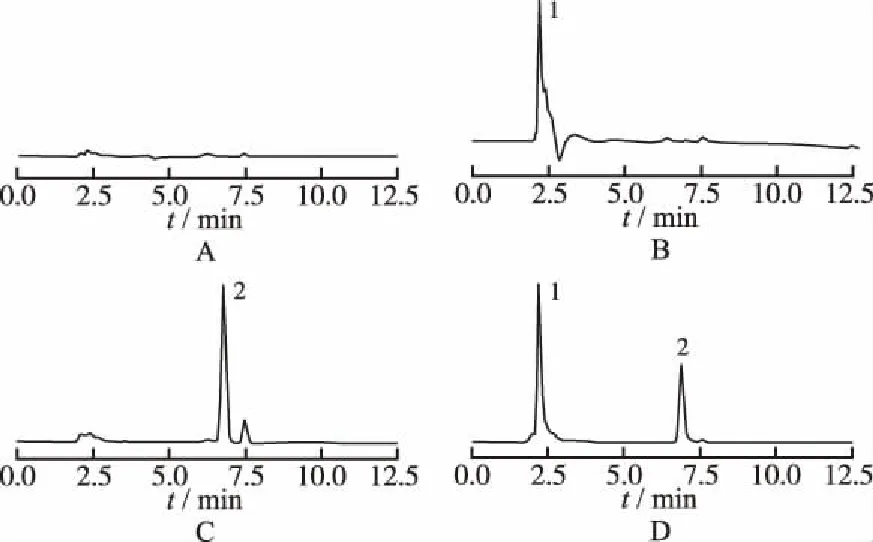
A.空白溶剂;B.罗汉果苷V对照品溶液;C.紫杉醇对照品;D.紫杉醇-罗汉果苷V固体分散体溶液;1.罗汉果苷V;2.紫杉醇
图1 4种溶液的HPLC图谱
1.blank solution;B.mogroside-V reference solution;C.paclitaxel reference solution;D.paclitaxel-mogroside-V SD solution;1.mogroside-V; 2.paclitaxel
Fig.1HPLCchromatogramsoffourkindsofsolution
2.3.8精密度实验 精密量取“2.3.2”项制备紫杉醇对照品溶液0.5 mL,置于100 mL量瓶中,加流动相定容,得到5 μg·mL-1紫杉醇溶液。按“2.3.1”项方法重复测定6次,结果峰面积稳定,RSD为0.8%,表明仪器精密度良好。
2.3.9重复性实验 取紫杉醇-罗汉果苷V固体分散体(1:20)约20 mg,共6份,精密称定。置于10 mL量瓶中,加适量乙腈溶解并定容。精密量取0.5 mL,置10 mL量瓶,加流动相定容。配制得相当于紫杉醇含量5 μg·mL-1溶液。按“2.3.1”项方法测定,计算6份样品中的紫杉醇含量。测定6份固体分散体中紫杉醇的含量分别为4.3%,4.2%,4.3%,4.4%,4.4%,4.3%,RSD为1.3%,表明该方法重复性良好。
2.3.10稳定性实验 取“2.3.9”项下含紫杉醇5 μg·mL-1的紫杉醇-罗汉果苷V固体分散体溶液,室温下放置0,2,4,6 h,按“2.3.1”项方法分别测定,紫杉醇峰面积RSD为0.06%,表明紫杉醇溶液在室温下6 h内稳定。
2.3.11加样回收率实验 参考文献[15]方法,分别精密称取紫杉醇适量,按处方比例(1:20)添加罗汉果苷V,分别制成高、中、低浓度溶液各3份,按“2.3.1”项方法测定。分析结果见表1,加样回收率在97.9%~101.5%,方法准确度良好。
2.4紫杉醇与罗汉果苷V投药比例筛选 根据物理混合物饱和溶解度测定。取紫杉醇-罗汉果苷V不同比例的物理混合物(相当于紫杉醇1 mg),置于2 mL EP管中,加水0.5 mL,置于恒温振荡水浴锅中,37 ℃振摇饱和24 h,后取上清液,用孔径0.45 μm微孔滤膜滤过,取续滤液按“2.3.1”项方法测定紫杉醇浓度。结果如图2。结果显示随着罗汉果苷V加入量的增加,紫杉醇的增溶倍数增加,故最终选取紫杉醇-罗汉果苷V 1:20(W/W) 为处方制备固体分散体。
表1 紫杉醇加样回收率实验结果
Tab.1Resultsofrecoverytestofpaclitaxel
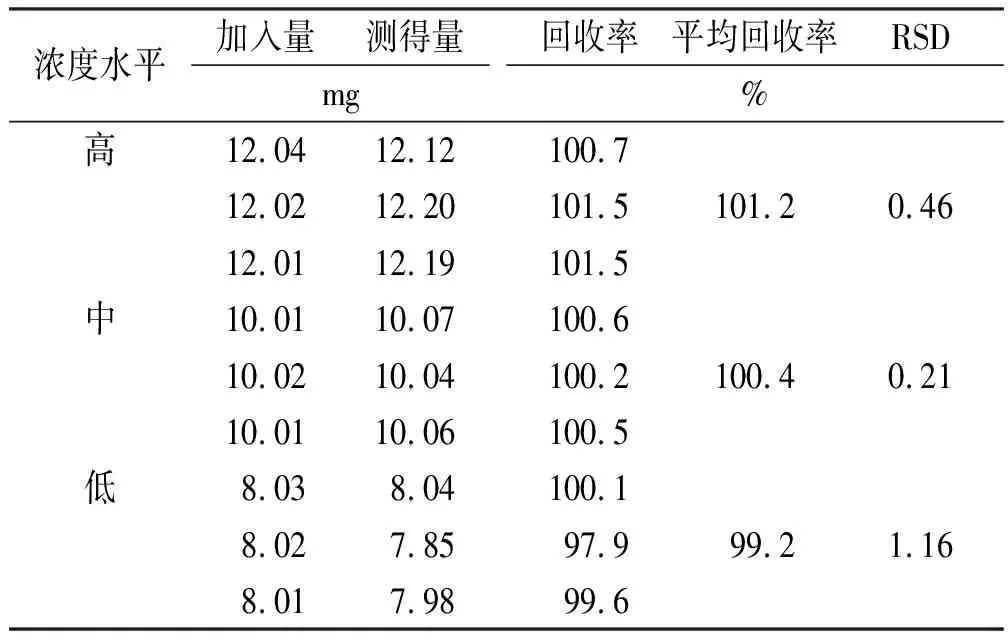
浓度水平加入量测得量mg回收率平均回收率RSD%高12.0412.12100.712.0212.20101.5101.20.4612.0112.19101.5中10.0110.07100.610.0210.04100.2100.40.2110.0110.06100.5低8.038.04100.18.027.8597.999.21.168.017.9899.6
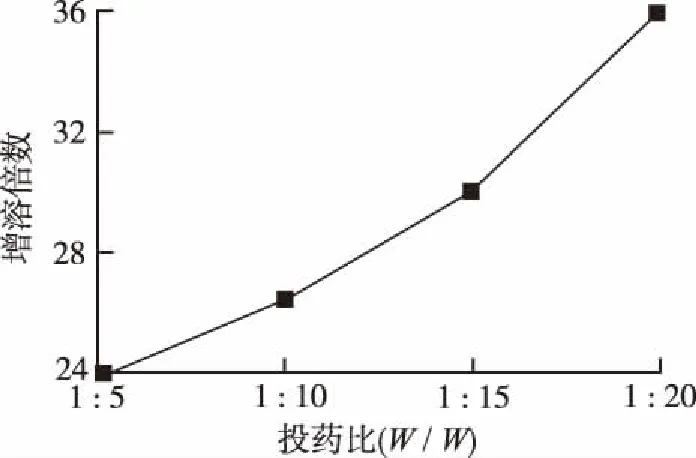
图2 紫杉醇/罗汉果苷Ⅴ物理混合物的增溶倍数变化曲线
Fig.2Solubilizationfoldcurveofpaclitaxel-Mog-Vphysicalmixture
2.5固体分散体饱和溶解度实验 分别取紫杉醇和紫杉醇-罗汉果苷V固体分散体(相当于紫杉醇1 mg),置于2 mL EP管中,加水0.5 mL,置于恒温振荡水浴锅中,37 ℃振摇饱和24 h,用孔径0.45 μm微孔滤膜滤过,取续滤液按“2.3.1”项方法测定紫杉醇浓度。结果显示紫杉醇的饱和溶解度约为0.1 μg·mL-1,紫杉醇/罗汉果苷V固体分散体的饱和溶解度约为37.5 μg·mL-1。与紫杉醇比较,固体分散体的饱和溶解度增加约375倍,表明罗汉果苷V明显增加紫杉醇的溶解度。
2.6DSC法分析 分别取紫杉醇、罗汉果苷V、紫杉醇与罗汉果苷V的物理混合物(1:20)、紫杉醇-罗汉果苷V固体分散体适量,置于铝制坩埚内,盖上盖子,密封。测试条件为:以空铝坩埚为参比,升温速率:10 ℃·min-1,扫描范围:40~300 ℃,结果见图3。由DSC图可知,紫杉醇和罗汉果苷V分别在214和178.8 ℃处各有一吸热峰。紫杉醇和罗汉果苷V物理混合物的DSC图为两者图谱的叠加,分别在177和210 ℃处有吸热峰。而固体分散体的DSC图中,紫杉醇的吸热峰消失,仅在164.6 ℃处出现一个微小的吸热峰,表明以罗汉果苷V为载体,紫杉醇在固体分散体的制备过程中,由晶体转变为无定形或极其微小的晶体。
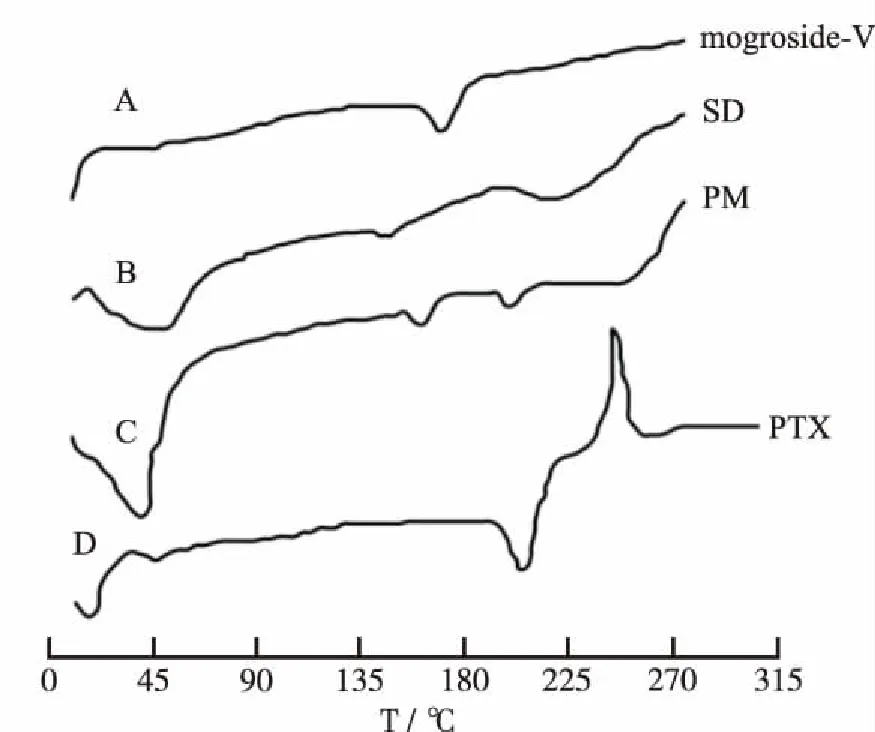
图3 罗汉果苷V(A)、固体分散体(B)、物理混合物(C)、紫杉醇(D) DSC图谱
Fig.3DSCthermogramsofmogroside-V(A),SD(B),PM(C),andpurepaclitaxel(D)
2.7体外溶出度实验 参照文献[16]方法,以恒温振荡水浴锅为溶出装置,以pH值 6.8磷酸盐溶液(含0.2%聚山梨酯80)为溶出介质,每个溶出杯加入溶出介质100 mL,振荡频率50 r·min-1,温度为(37±0.5) ℃。称取等价于主药约2 mg的紫杉醇、物理混合物(1:20)、固体分散体分别加入溶出介质中,于5,10,20,30,60,120 min定时定位取样1 mL,经孔径0.45 μm微孔滤膜滤过,弃去初滤液。同时向溶出杯中补加新鲜介质1 mL。取出的样品立即按“2.3.1”项方法测定紫杉醇浓度,重复3次。结果见图4。结果显示紫杉醇在120 min时累积溶出度为12%,紫杉醇-罗汉果苷V(1:20)物理混合物累积溶出度在120 min达到36.3%。紫杉醇-罗汉果苷V固体分散体在5 min时溶出度就达到42.2%,120 min时累积溶出度达到83.9%。与紫杉醇比较,固体分散体和物理混合物的溶出速率和累积溶出度都有明显的提高,说明罗汉果苷V能够显著增加难溶性药物紫杉醇的体外溶出。
累积溶出量(%)=(溶出的总物质量/投入量)×100%
溶出的总物质量=当前取样点介质浓度×介质体积+(之前取样点介质浓度×取样量)

图4 紫杉醇、物理混合物和固体分散体的体外溶出曲线
Fig.4Dissolutioncurvesofpaclitaxel,PMandSD
3 讨论
笔者在本研究以食品添加剂罗汉果苷Ⅴ为固体分散体的载体,考察不同投药比例对紫杉醇增溶效果的影响。以药物增溶倍数为指标,筛选出最佳的固体分散体投药比例为1:20(W/W)。同时,本研究建立了灵敏度高、准确度好、检测范围广的HPLC法,用于测定制剂中紫杉醇的含量。另外,通过DSC分析法验证紫杉醇在固体分散体中以无定形或微小晶体形式存在,显示出该制剂中紫杉醇的增溶机制是改变其难溶性的晶体结构及降低晶体的大小。饱和溶解度和体外溶出的实验结果表明,以罗汉果苷V为载体,能有效提高难溶性药物紫杉醇的溶解度,进而改善其溶出速率和累积溶出度。
本研究的固体分散体处方简单、制备工艺简便,不仅显著提高紫杉醇的饱和溶解度,还有效改善其体外溶出性能。罗汉果苷V作为食品添加剂,安全、无毒。该研究结果表明罗汉果苷V有望成为新型载体辅料,在难溶性药物的制剂开发中具有极大应用价值。
