中国药物警戒的发展及文献计量分析*
2019-06-17祝晓雨张伟光孙树森赵志刚
祝晓雨,张伟光,孙树森,赵志刚
(1.首都医科大学附属北京天坛医院药学部,北京 100050;2.首都医科大学附属北京朝阳医院西院药事办,北京 100043;3.美国西新英格兰大学药学院,美国斯普林菲尔德 01119)
药物警戒译自“Pharmacovigilance”,简称PV 或PhV,这个词从词源学角度是希腊语pharmakon(“药物”的意思)以及拉丁语vigilare(“注意”的意思)的合成词,英译汉翻译为“drug safety”(药物安全性)[1]。世界卫生组织(WHO)将PV定义为检测、评估、理解和预防不良反应,或其他任何药物相关问题的科学研究与活动(Pharmacovigilance is defined as the science and activities relating to the detection,assessment,understanding and prevention of adverse effects or any other drug-related problem)[2]。1961年发生“沙利度胺海豹儿事件”后,WHO启动一项多个国家合作的国际药物警戒监测合作计划(即现在的WHO药物监测中心——WHO Monitoring Center)[3],奠定国际药品监测合作计划的基础,由总部位于瑞士乌普萨拉的WHO协作中心(Uppsala Monitoring Center,UMC)统一协调[4],从而开启药物警戒的理论与实践。截至2016年,已经有123个国家加入WHO的药品监测计划,28个国家等待正式加入此中心[5]。我国于1998年加入WHO国际药品监测合作中心[6],成为第68个成员国,以坚持提高患者的健康水平和促进用药安全为目的,开展不良反应监测的工作。
药物警戒于1974年在法国首先提出[7],最初的解释着重强调药物不良反应(adverse drug reaction,ADR)的监测。ADR指合格药品在正常用法用量下出现的与用药目的无关的有害反应。所以直到现在还普遍认为药物警戒就是ADR。ADR是药物警戒的重要内容,但是药物警戒并非单指ADR,还包括劣药、假药存在的用药风险,以及不合理用药——药品误用与严重的药物滥用产生的危险,药物用法错误。药物警戒贯穿于药物研究、药物审批、药物上市的整个生命周期。在药物警戒的不断实践中,还有可能扩展其警戒的目标[8]。而ADR是药物警戒的重要内容,常常用来作为药物警戒监测的重要数据。药物警戒需要在ADR监测工作中不断完善[9-10],我国的药物警戒体系就是在药物不良反应监测体系基础上发展而来,两者最终目的都是促进临床合理用药,提高用药安全,改善公众身体健康,提升公众生活质量。两者区别见表1。
文献计量分析[11]有助于对某一研究领域的国内外文献发表情况进行全面了解[12-13]。笔者在本研究利用文献计量分析的方法对中国药物警戒的文献发表情况进行全面分析,有助于了解中国药物警戒现状,有助于药物警戒的进一步发展,保障用药安全。
1 研究方法
1.1文献检索与计量学分析 在中国学术期刊全文数据库(CNKI,1979—2018)、维普网(VIP)、万方数据库中,以“药物警戒”为篇名或关键词检索,检索从建库时期到2018年5月22日所有文献。
制定纳入和排除标准:①纳入关键词或者篇名中含有“药物警戒”的文献。②排除新闻、会议通知、文摘、书籍等类型文献。③应用数据处理软件Endnote X排除重复文献。④由于《药品不良反应信息通报》和《药物警戒快讯》是国家药品不良反应监测中心发布的警戒通报,故不作为计量分析的数据。
对所得结果进行计量分析,包括出版年份、关键词、机构、作者和来源出版物等,并分析文献引用情况。
1.2药品不良反应通报与药物警戒快讯检索 通过原国家食品药品监督管理局(CFDA)官方网站查询全部《药品不良反应通报》与《药物警戒快讯》,用Excel表格统计分析发表时间、基本内容等信息。
2 结果
2.1文献计量分析 在CNKI、VIP和万方数据库中检索到文献分别为1103篇、686篇和777篇,经过数据处理,最终得到文献588篇,文献类型包括期刊、会议论文、研究生论文等。其中期刊464篇(78.91%)、综述28篇(4.76%)、会议论文71篇(12.07%)、研究生论文25篇(4.25%)。
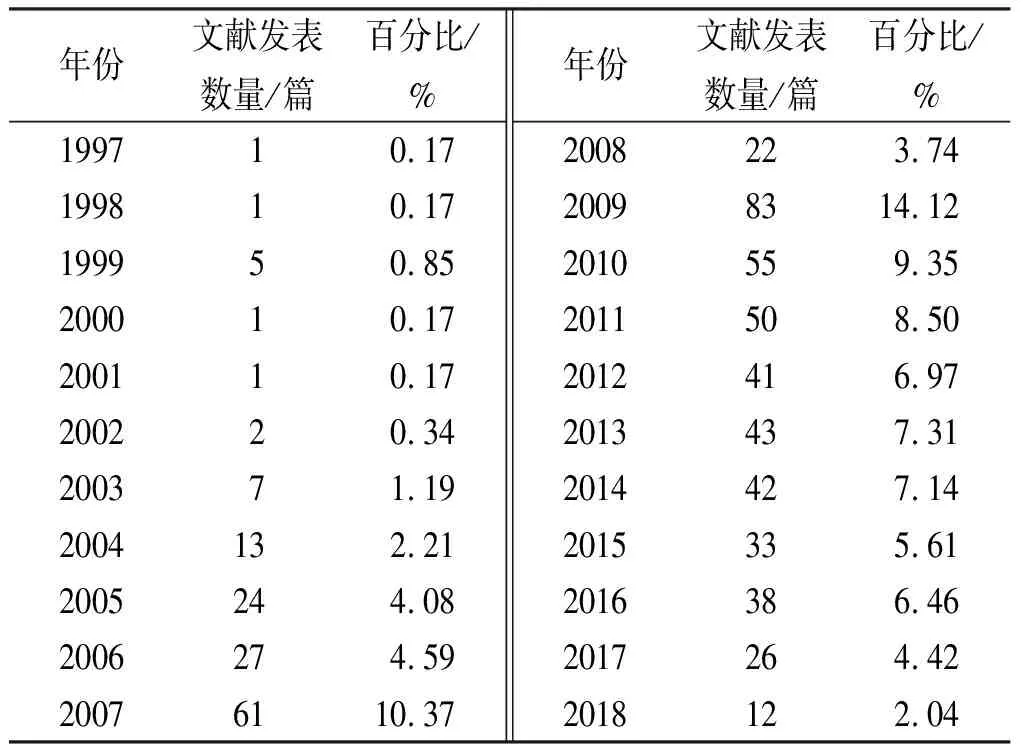
2.1.1药物警戒相关文献年发表量 为反映研究主题在该领域的发展情况,笔者对检索到的文献按年度分布情况、文献量与时间变化的关系统计分析,见表2。
1997年李家泰的论文中首次以“药物警戒”作为关键词。1998年我国加入WHO国际药品监测合作中心,1999年论文发表达5篇。之后,国家颁布一系列法律法规和指南[14-15],见表3。大力推动我国药物警戒的发展,在2004年,李青[16]发表的《我国药品上市后监测工作及国家药物政策的基础研究》开启了关于我国药物警戒相关监测工作的研究。此后论文发表数明显增多,从2006年的27篇增至2009年的83篇,这表明药物警戒已经引起广泛关注,2011年之后虽然文献发表量有所下降,但仍维持在每年26~50篇,说明中国学者意识到药物警戒直接关系到临床用药安全,是不可忽视的内容。
为了促进中国药物警戒领域的学术交流,推进药
表2 药物警戒相关文献年发表情况
Tab.2Annualpublicationofpharmacovigilancerelatedpapers
年份文献发表数量/篇百分比/%199710.17199810.17199950.85200010.17200110.17200220.34200371.192004132.212005244.082006274.5920076110.37年份文献发表数量/篇百分比/%2008223.7420098314.122010559.352011508.502012416.972013437.312014427.142015335.612016386.462017264.422018122.04
物警戒创新发展,自2007年至今,中国已举办6届药物警戒大会[17],见表4。
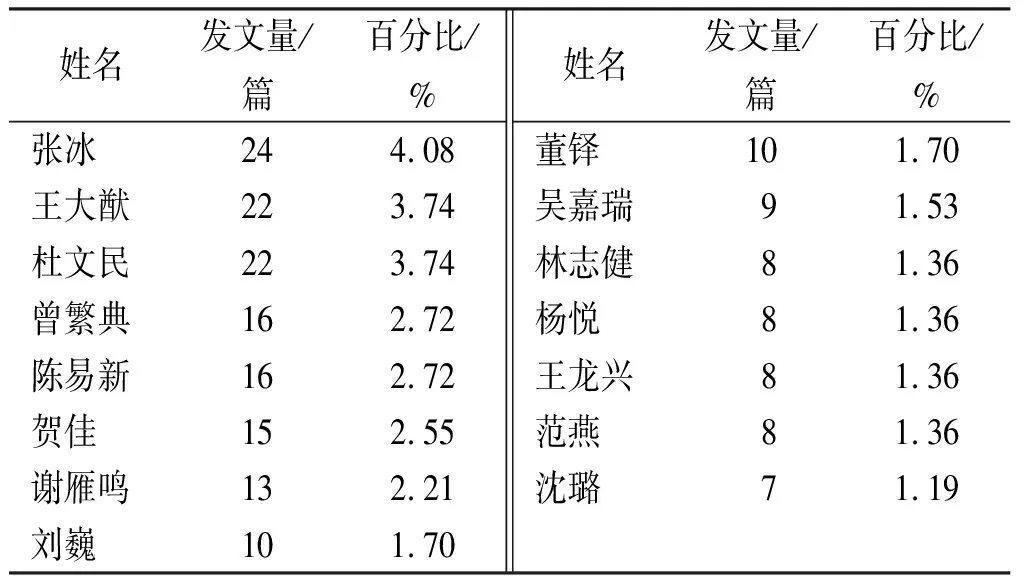
2.1.2文献作者分布 表5为文献发表总量前15位的作者,其中排名第一位的作者张冰教授来自北京中医药大学,主要研究方向为中药防治代谢性疾病的临床与实验研究、中药毒副作用及其药源性疾病的研究和中药药性理论基础与应用的研究,致力于中药药物警戒的理论研究与实践探索,是《中国药物警戒》杂志编委。排名第二位王大猷教授来自复旦大学附属华山医院,从事药物警戒及药物流行病学的研究与实践,担任国际药物警戒学会会员、国家药品监督管理局药品评价中心专家委员会委员以及上海市临床药品不良反应监测中心专家咨询委员会委员,并且担任《药物不良反应杂志》等刊物的编委。曾繁典教授曾担任华中科技大学同济医学院临床药理研究室主任,原中国药理学会副理事长、中国临床药理学会副主任委员、国家药监局药品评审专家库专家,中国药学会药物流行病学专业委员会副主任委员,在药物警戒与临床药学服务和药物流行病学方面深有研究,曾担任《医药导报》和《药物流行病学杂志》主编。国家食品药品监督管理局药品评价中心陈易新是中药不良反应及用药安全性问题中国中医药监测和评价专家,主要参与组织、建立,并完善了中国药品不良反应监测的基本技术工作体系,在药品风险预警、不良反应监测中发挥至关重要的作用。这些专家及其团队是我国药物警戒研究的主力军,其对药物警戒体系的建立及发展起着至关重要的作用,其文献也有及其重要的参考价值。
表3 相关法律法规及指南
Tab.3Relevantlaws,regulationsandguidelines

发布时间法律法规及指南1998《药品生产质量管理规范》(局令第9号)2000《药品经营质量管理规范》(局令第20号)2001《中华人民共和国药品管理法》(主席令第45号)2002《中国人民共和国药品管理法实施条例》(国务院令第360号)2002《医疗机构药事管理暂行规定》2003《药物临床试验质量管理规范》2003《药品监督行政处罚程序规定》(局令第1号)2004《药品不良反应报告和监测管理办法》(局令第7号)2004《药品生产监督管理办法》(局令第14号)2004《互联网药品信息服务管理办法》(局令第9号)2006《药品说明书和标签管理规定》(局令的24号)2007《药品注册管理办法》(局令第28号)2007《药品召回管理办法》(局令第29号)2007《药品广告审查办法》(局令第27号)2007《药品广告审查发布标准》(国家工商总局局令第27号)2007《药品流通监督管理办法》(局令第26号)2011《药品不良反应报告和监测管理办法》(卫生部令 81 号)2011《医疗机构药事管理规定》2011《药品生产质量管理规范》(卫生部令第79号)2013《国家基本药物目录》(2012年版)(卫生部令第93号)2015《药品不良反应报告和监测检查指南(试行)》2015《药品经营质量管理规范》(国家食品药品监督管理总局令第13号)2015《中华人民共和国药品管理法》2016《药品经营质量管理规范》2016《中华人民共和国药品管理法实施条例》2017《药品生产监督管理办法》2017《药品经营许可证管理办法》2017《互联网药品信息服务管理办法》2017《蛋白同化制剂和肽类激素进出口管理办法》2017《生物制品批签发管理办法》(国家食品药品监督管理总局令第39号)

表4 第一至第六届药物警戒大会
表5 文献发表总量前15位的作者
Tab.5Thetop15authorswiththemostpublishedpapers
姓名发文量/篇百分比/%张冰244.08王大猷223.74杜文民223.74曾繁典162.72陈易新162.72贺佳152.55谢雁鸣132.21刘巍101.70姓名发文量/篇百分比/%董铎101.70吴嘉瑞91.53林志健81.36杨悦81.36王龙兴81.36范燕81.36沈璐71.19
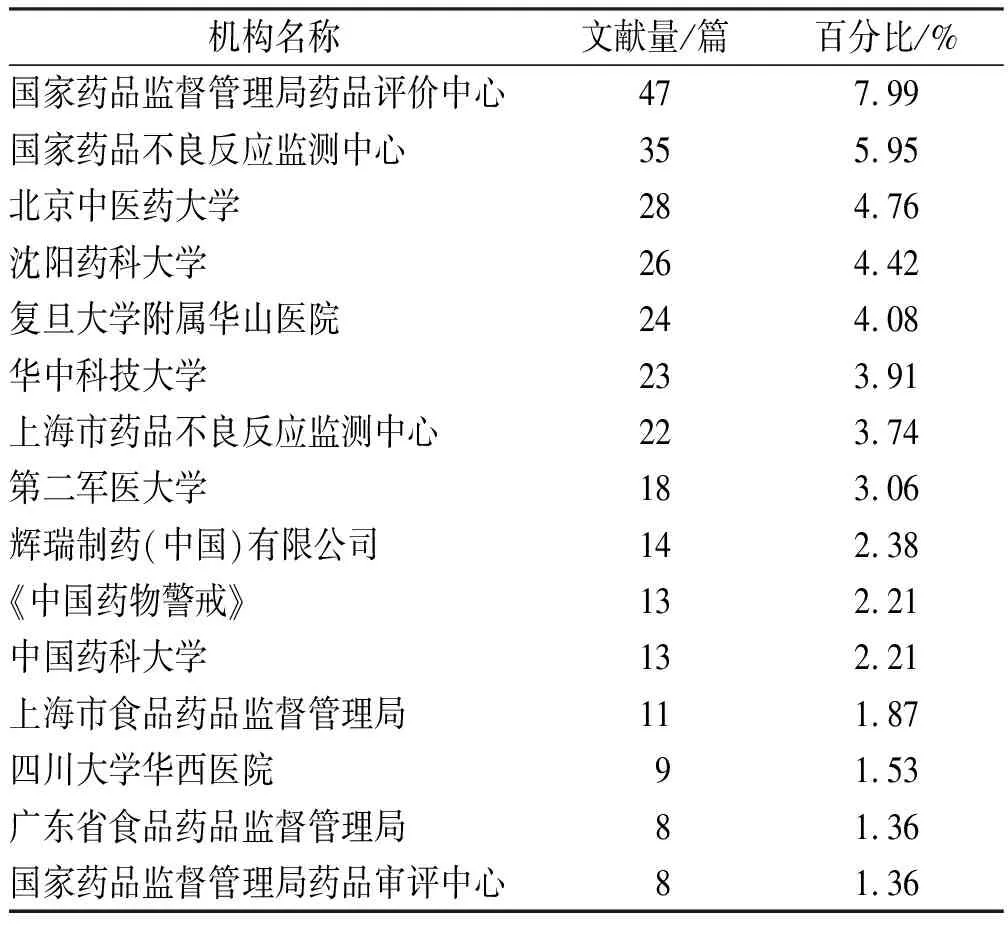
2.1.3研究机构 机构是科学研究的重要背景因素,表6是发表药物警戒相关文献最多的前15个机构,其中国家药品监督管理局药品评价中心以47篇居于首位,第2和第3名分别是中国国家药品不良反应监测中心和北京中医药大学。我国总的趋势是非常重视药物警戒的,尤其是对中药药物警戒方面的关注和研究。但各省市在此工作上仍然有很多工作需要做。
表6 文献发表前15位的机构
Tab.6Thetop15institutionswiththemostpapers
机构名称文献量/篇百分比/%国家药品监督管理局药品评价中心477.99国家药品不良反应监测中心355.95北京中医药大学284.76沈阳药科大学264.42复旦大学附属华山医院244.08华中科技大学233.91上海市药品不良反应监测中心223.74第二军医大学183.06辉瑞制药(中国)有限公司142.38《中国药物警戒》132.21中国药科大学132.21上海市食品药品监督管理局111.87四川大学华西医院91.53广东省食品药品监督管理局81.36国家药品监督管理局药品审评中心81.36
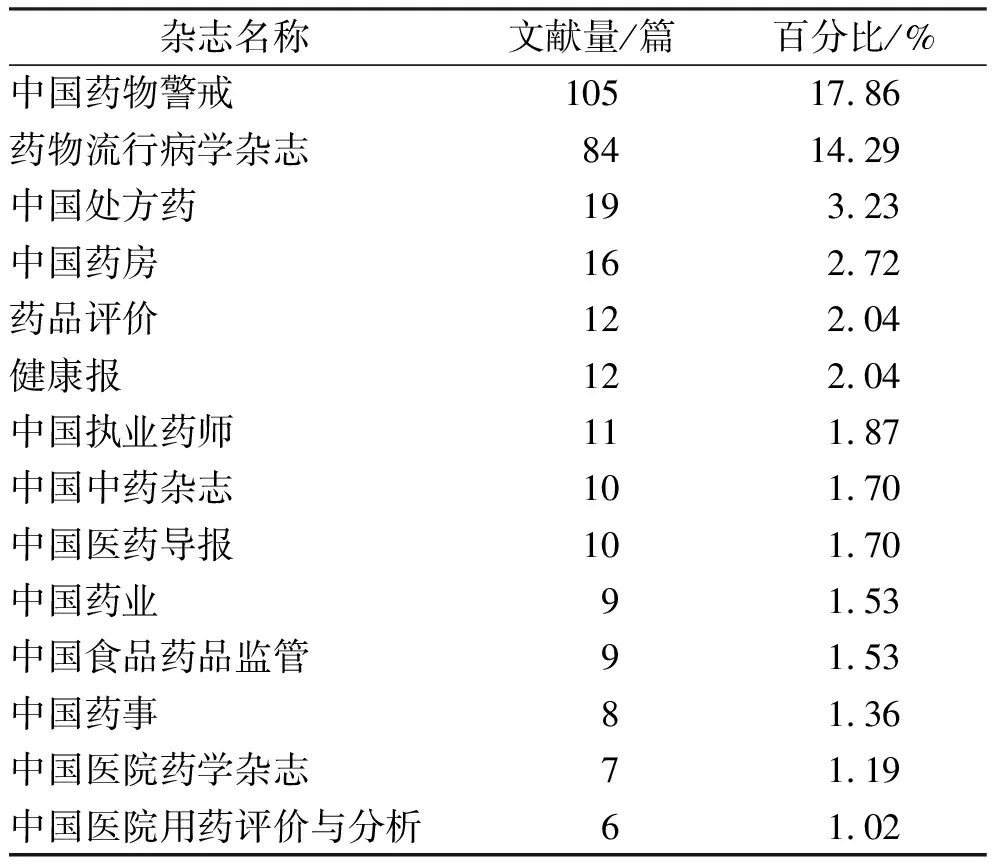
2.1.4文献来源分布 表7是按照收录论文数量的多少对来源出版物进行的排名,从表7中可知,《中国药物警戒》收录的论文数最多,其次是《药物流行病学杂志》和《中国处方药》。
表7 收录论文前15位的出版物
Tab.7Thetop15publicationswiththemostpapers
杂志名称文献量/篇百分比/%中国药物警戒10517.86药物流行病学杂志8414.29中国处方药193.23中国药房162.72药品评价122.04健康报122.04中国执业药师111.87中国中药杂志101.70中国医药导报101.70中国药业91.53中国食品药品监管91.53中国药事81.36中国医院药学杂志71.19中国医院用药评价与分析61.02
2.1.5关键词分布 药物警戒研究的前15个关键词(表8),“药物警戒”有511篇,这与本篇检索策略相关。 “不良反应”,“监测”以及“药品不良反应”分别居于第2,3,4位,50%论文以“不良反应”为关键词,这和药物警戒与药品不良反应的关系相一致,药品不良反应监测是药物警戒的重要内容。
表8 药物警戒研究排名前15的关键词
Tab.8Thetop15keywordsasthepharmacovigilance
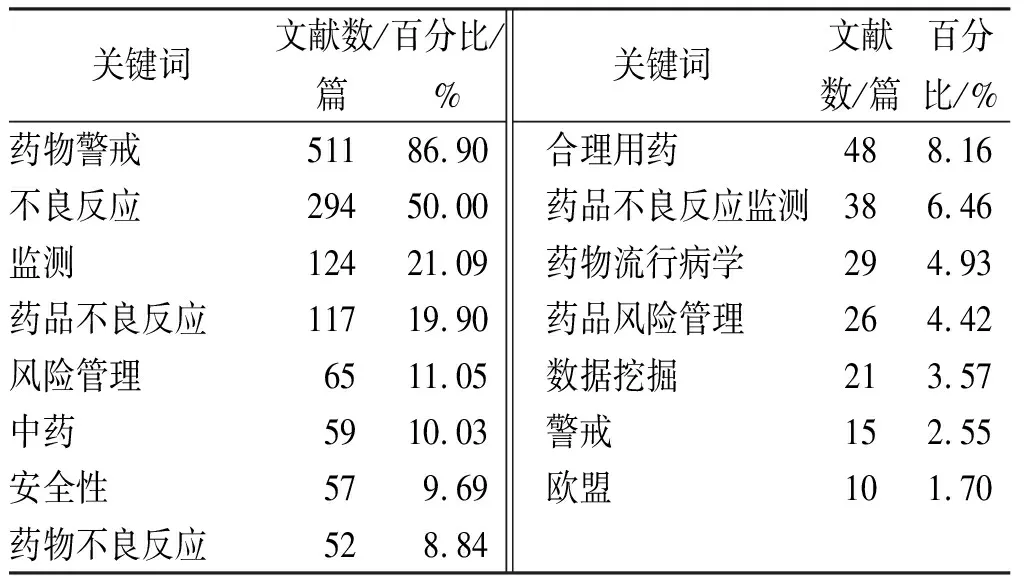
关键词文献数/篇百分比/%药物警戒51186.90不良反应29450.00监测12421.09药品不良反应11719.90风险管理6511.05中药5910.03安全性579.69药物不良反应528.84关键词文献数/篇百分比/% 合理用药488.16 药品不良反应监测386.46 药物流行病学294.93 药品风险管理264.42 数据挖掘213.57 警戒152.55 欧盟101.70
2.1.6基金资助机构分布 表9是基金资助机构,排名前3位的分别是国家自然科学基金、国家科技支撑计划和中国博士后科学基金。
2.1.7被引文献分析 表10列举总被引次数排名前 15 位的论文,查阅论文第一作者后发现,论文被引次数最多的作者李幼平来自四川大学华西医院,该论文为国家自然科学基金面上资助项目,针对药品风险,介绍与药品风险管理相关的一些基本概念等内容的判读[18]。陈易新、杨焕和王兰明3位作者来自国家药品监督管理局,王明珠、叶小飞和田丽娟来自沈阳药科大学。

表9 文献所属基金分布
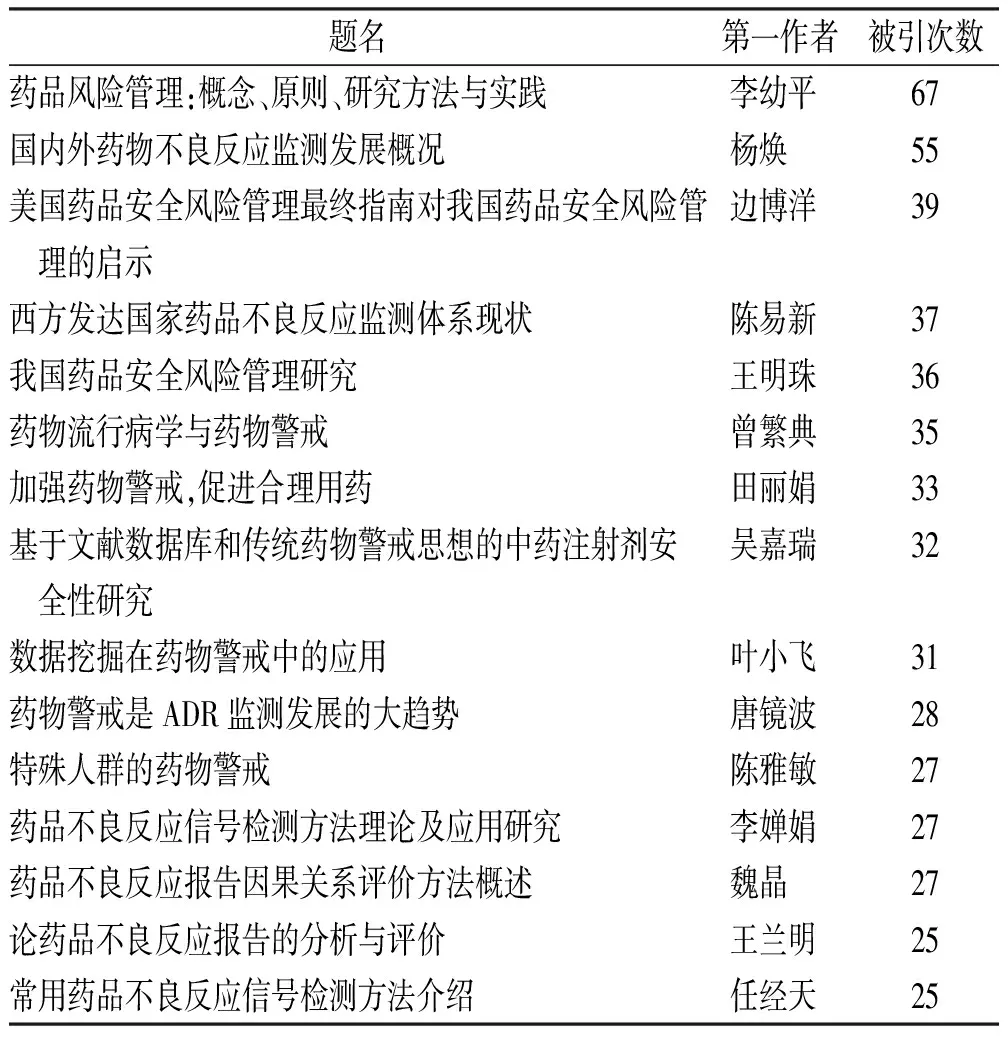
表10 药物警戒被引次数前15位的论文
2.2药品不良反应信息通报 原CFDA自2001年起至今发布76期《药品不良反应信息通报》[19],年发布情况见表11,发布内容绝大部分是我国上报的新的或者严重的药品不良反应信息。发布时间无规律,且自2010年后每年发布的期数明显减少,建议我国加大对药品不良反应信息通报力度。
2.3药物警戒快讯 原CFDA自2005年至今发布《药物警戒快讯》[20]共180期,年发布情况见表12,2005—2010年年发布期数在13~18期,2011年至今每月1期,其内容皆是国际上其他国家或机构发布的药物警戒信息,以美国FDA和欧盟EMEA为代表,其建立较为完善的药物警戒体系,尤其是欧盟实施的药物警戒制度体系,是目前国际范围内最完善的体系[21]。在这样的体系下能全面及时的发现新的或严重的药品不良反应信息,并及时发布。
表11 《药品不良反应信息通报》年发布情况
Tab.11Annualreleaseofadversedrugreactioninformationbulletin
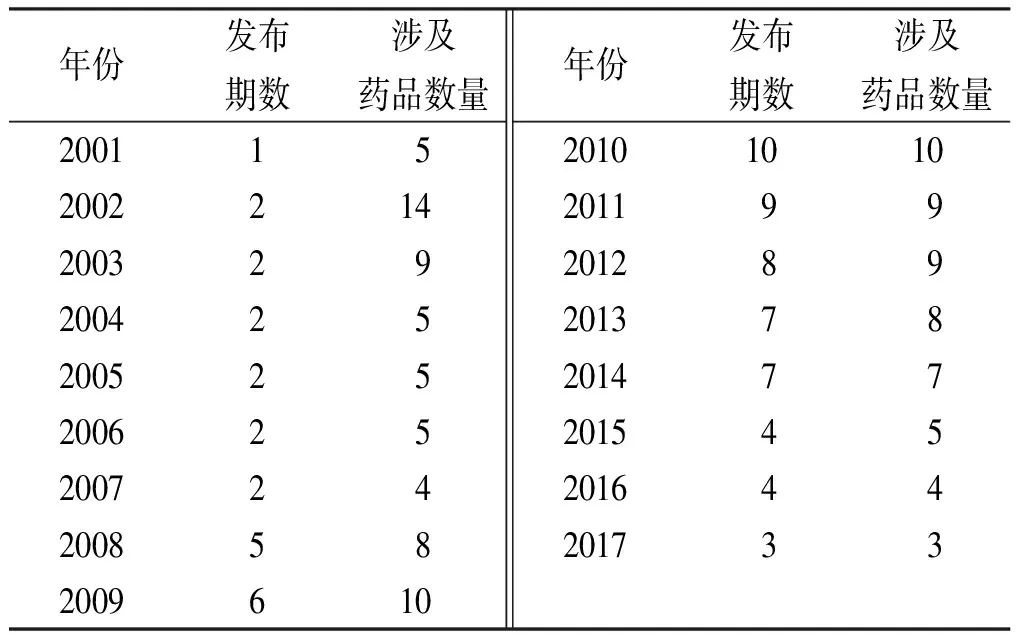
年份发布期数涉及药品数量20011520022142003292004252005252006252007242008582009610年份发布期数涉及药品数量20101010201199201289201378201477201545201644201733
表12 《药物警戒快讯》年发布情况
Tab.12Annualreleaseofpharmacovigilancealerts
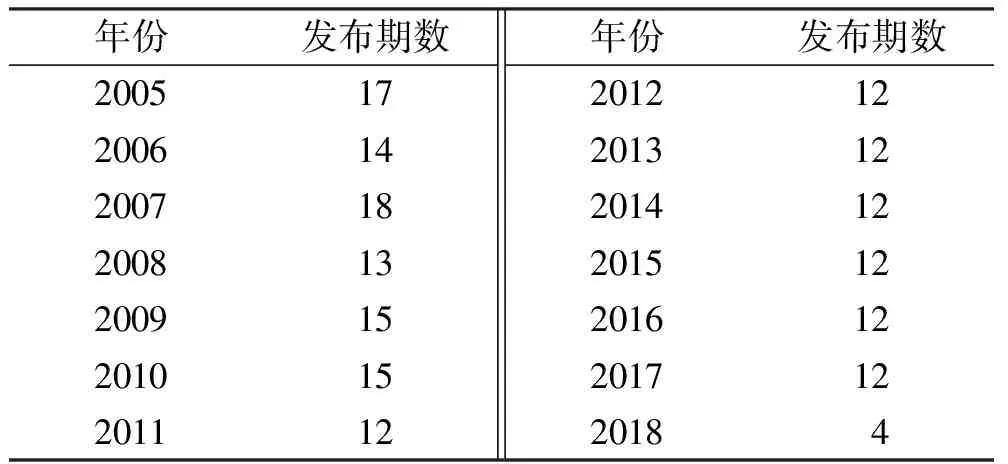
年份发布期数200517200614200718200813200915201015201112年份发布期数20121220131220141220151220161220171220184
3 讨论
目前,我国药物警戒的关注度持续维持在相对较高水平,ADR监测与上报作为其重要组成部分,近年来发展较快。吴世福等[22]研究提到我国2016年收集的ADR报告143.1万份,ADR报告上报总数量较多,但是在严重不良反应和生产企业报告比例等方面还有待提高[23]。目前我国ADR上报主要是医师、药师和护士等医疗机构人员,药品生产企业主动上报数量较少[24]。在发达国家,如加拿大,2011年81.8%报告均来自于药品生产企业[25]。此外,我国普遍存在ADR病例漏报和延迟报告等问题[26]。
截至2011年末,我国已经建立34个省级ADR监测中心和333个地市级ADR监测中心[23]。随着科技的发展,网络建设的深入,我国发现和收集ADR信息的能力进一步增强。截至 2016年,全国已有约31万个医疗机构等通过ADR监测网络报送ADR报告[27],这为我国药物警戒的发展奠定了很好的基础。
中国在药物警戒体系发展的领域尚存在一定不足与差距。许多国家的法律规定中,新药的批准要求在药品上市后最初几年持续提供详细的药物警戒数据[28]。我国药物警戒法规体系建设任重道远,先进的、符合国情的法规和技术指南,将为加速药物警戒的规范化、国际化进程提供法律支撑[29-30]。
立足国情,借鉴国际上ADR监测的经验,加快我国ADR监测体系法律法规的制定,积极推行发布ADR上报和管理指南,才能逐步完善我国药物警戒体系,同时,相关专家的广泛宣传与重视和药师专业技能的提升,会让我国药物警戒工作更进一步。
