消癌平注射液调节核受体增强紫杉醇抑制卵巢癌A2780细胞增殖的机制*
2019-06-17张湘奇陈君君杨姣石美智祁美娟肖霄王洪斌韩永龙
张湘奇,陈君君,杨姣,,石美智,祁美娟,肖霄,王洪斌,韩永龙,
(1.上海交通大学附属第六人民医院药剂科,上海 200233;2.上海健康医学院附属第六人民医院东院药剂科,上海 201306;3.上海海洋大学食品学院,上海 201306;4.北加州大学药学院,美国加利福尼亚 CA95757)
消癌平注射液(xiaoaipinginjection,XAP)是由通关藤药材精制提取而成的中药抗肿瘤单方制剂,在临床上常与紫杉醇[1]、吉非替尼[2]、多柔比星[3]等化学治疗(化疗)药物联合应用治疗肺癌、肝癌、胃肠肿瘤等,对化疗药物具有增效减毒作用,可以提高化疗药物的疗效。紫杉醇(paclitaxel,PTX)是卵巢癌的一线化疗药物,但毒性大,易引起耐药[4];它在人体内主要经药物代谢酶细胞色素P450酶(CYP)的亚型CYP3A4/5、CYP2C8和转运体P-糖蛋白(P-glycoprotein,P-gp)进行代谢消除[5-7]。本课题组前期研究和文献报道均发现XAP可抑制肝微粒体中CYP3A4、CYP2C8活性,从而可能影响PTX在体内的代谢过程。核受体孕烷X受体(PXR)和组成型雄甾烷受体(CAR)可以调控包括细胞色素P450酶,如CYP3A4、CYP2B6、CYP2C8等及转运体如P-gp等众多靶基因的转录表达[8-9];同时有研究表明抑制PXR和CAR的表达,可抑制卵巢癌细胞的增殖并增加其对PTX的敏感性[10-11]。因此,本研究拟在前期工作基础上从细胞水平探究XAP联用PTX对卵巢癌A2780细胞的增殖抑制作用,通过分析mRNA、蛋白表达变化明确XAP是否调节核受体PXR和CAR及下游的药物代谢酶来增强PTX抑制A2780细胞增殖。
1 材料与方法
1.1实验药品及试剂 消癌平注射液(XAP,南京圣和药业有限公司,批号:201709111,规格:每支20 mL,每毫升注射液含生药1 g),紫杉醇注射液(PTX,海口市制药厂有限公司,批号:12171006,规格为5 mL:30 mg),胎牛血清、0.25%胰蛋白酶、青霉素、链霉素溶液(GIBCO公司),高糖达尔伯克改良伊格尔培养基(DMEM,HYCLONE公司),噻唑蓝(MTT,索莱宝生物科技有限公司),UNIQ-10 柱式Trizol总RNA抽提试剂盒、M-MuLV第一链cDNA合成试剂盒、2X SG Fast qPCR预混液(生工生物工程公司),Anti-PXR抗体、Anti-CYP2C8抗体(ABCAM公司),β-actin小鼠单克隆抗体、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒、RIPA裂解液(碧云天生物技术公司),山羊抗小鼠IgG HRP、山羊抗兔IgG HRP(BIOSHARP公司)。
1.2细胞 人卵巢癌细胞系A2780,购自北纳生物公司。
1.3仪器 生物安全柜(ESCO Class II BSC)、二氧化碳(CO2)培养箱(Panasonic MCO-18AIC)、ME203电子分析天平(梅特勒-托利多仪器公司,感量:1 mg)、台式低温离心机(Beckman Microfuge 20R)、多功能酶标仪(Spectra Max i3x)、定量PCR仪(ABI Pro Flex)、实时荧光定量PCR仪(Roche Light Cycler 480II)、蛋白垂直电泳系统(Bio-rad mini-protean Tetra)、倒置相差荧光显微镜(Leica DMi8)。
1.4细胞的培养 卵巢癌细胞A2780培养于含10%胎牛血清,1%青霉素:链霉素溶液(使青霉素和链霉素终浓度分别为100 U·mL-1和100 μg·mL-1)的DMEM高糖完全培养基中,培养条件为37 ℃,5%CO2饱和湿度。培养2或3代后,取对数生长期细胞进行实验。
1.5MTT 法检测细胞活力 调整细胞悬液密度至5×104·mL-1,接种于96孔培养板中,每孔100 μL,空白组加入相应量的无细胞培养基。细胞贴壁后根据药物浓度梯度加入含药培养基,XAP浓度梯度为20,40,80,160 mg·mL-1,PTX浓度梯度为10,40,80,160 nmol·L-1,各浓度PTX分别单用或与XAP 40 mg·mL-1联用,对照组和空白组加入无药培养基,37 ℃、5%CO2培养24和48 h。用无菌磷酸盐缓冲液(PBS)溶解MTT粉末,制成5 mg·mL-1MTT溶液,各孔加入MTT溶液10 μL继续孵育4 h。弃去上清液,加入DMSO150 μL振荡,溶解紫色晶体10 min。用酶标仪测定在490 nm 波长下各孔的吸光度(A)值。计算细胞活力(%)=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%,细胞活力值越低说明药物抑制率越高。平行实验重复3次。
1.6细胞形态观察 收集对数生长期A2780细胞,制成密度为1×105·mL-1的细胞悬液,接种于6孔培养板中,每孔1 mL。细胞贴壁过夜后,根据药物分组,分别加入含药培养基,使终浓度分别为XAP 40 mg·mL-1、PTX 10 nmol·L-1、XAP 40 mg·mL-1+ PTX 10 nmol·L-1,空白对照组只加入无药培养基。加药作用细胞24和48 h后,用PBS溶液轻柔清洗3次,置于倒置相差荧光显微镜下观察摄像。
1.7RT-PCR检测mRNA的表达 A2780细胞接种于6孔板中,每孔5×105个细胞,细胞贴壁后用无血清培养基处理12 h,加入含药培养基,使终浓度分别为XAP 40 mg·mL-1、PTX 10 nmol·L-1、XAP 40 mg·mL-1+ PTX 10 nmol·L-1,空白对照组只加入无药培养基。作用12和24 h后,利用Trizol法提取总RNA,用酶标仪测定所提RNA纯度及浓度。按上样1000 ng计算各样品上样量,依照逆转录试剂盒说明书配制20 μL上样体系加入PCR小管中,置于PCR扩增仪,按42 ℃、45 min 合成cDNA,70 ℃、10 min终止反应的条件进行逆转录反应。以逆转录得到的cDNA为模板,按PCR扩增说明书,加入相应量的扩增溶液及引物,20 μL上样体系中含25 ng模板DNA、10 μmol·L-1引物、10 μLRT-PCR Master Mix,96孔检测板离心后,放入荧光定量PCR仪上,PCR反应条件:①酶激活 95 ℃ 3 min ②变性 95 ℃ 3 s,退火延伸 60 ℃ 30 s,进行40个循环后降温得融解曲线,验证引物特异性。引物序列见表1。
表1 RT-PCR扩增所用的基因引物序列
Tab.1PrimersequencesoftargetgenesinRT-PCRamplification

基因名称引物序列(5′→3′)PXRForward :TGTGAGTGCGTGTGTGTGATReverse :TGATTGTCAGCGTAGCCTTGCARForward :GCTGCAAGAGGAGATGGCACTGReverse :CAGCGGCATCATGGCAGACAGCYP2C8Forward :TCCTGTGTTCACCGTGTATTReverse :TCAATCAGGGCTTCCTTCACCYP3A4Forward :TCATTGCTGTCTCCAACCTTCACCReverse :GGCTTGCCTGTCTCTGCTTCCCYP3A5Forward :CCGACGTGATCAGAACAGTGCTAGReverse :TGGTGAAGGTTGGAGACAGCAATGP-gpForward :GATTGCTCACCGCCTGTCCACReverse :CGTGCCATGCTCCTTGACTCTG
1.8Western blotting检测蛋白的表达 A2780细胞接种于6孔板中,每孔5×105个细胞,贴壁后用无血清培养基处理12 h,加入含药培养基,使终浓度分别为XAP 40 mg·mL-1、PTX 10 nmol·L-1、XAP 40 mg·mL-1+ PTX 10 nmol·L-1,空白对照组只加入无药培养基。作用24和48 h后,用预冷PBS洗涤1次,每孔加入含1%PMSF的RIPA裂解液200 μL,冰上裂解30 min,12 000×g离心20 min,收集上清液即为细胞总蛋白。BCA法测定蛋白浓度,加入5倍上样缓冲液,沸水浴5 min。取蛋白25 μg进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳,恒压180 V电泳30 min,然后换80 V电泳40 min,将胶上分离的蛋白电转到NC膜上,电转条件为半干电转恒压25 V持续30 min,以5%脱脂牛奶室温摇动封闭2 h,加入一抗(1:1000比例稀释)室温孵育2 h,TBST洗膜3次,每次10 min,加入二抗室温孵育1 h,TBST洗膜5次后以电化学发光(electrochemiluinescence,ECL)试剂盒检测蛋白印迹。以内参β-actin(ACTB)进行上样量校正。

2 结果
2.1对A2780细胞活力的抑制作用 实验结果显示,XAP对细胞增殖的抑制作用呈现显著的时间依赖(P<0.05或P<0.01),见图1。各浓度PTX对A2780细胞活力的抑制作用并不显著,当作用时间延长,抑制作用随药物浓度升高而增强,最大抑制率约为50%。各浓度PTX与XAP 40 mg·mL-1联用,可显著抑制A2780细胞活力,且与PTX组比较,抑制率显著增加(P<0.05或P<0.01),两药具有协同作用(图2)。通过Graphpad 6.0版软件分析可得:两药联用24 h,PTX的半数抑制浓度(IC50)由917.823 nmol·L-1降至384.541 nmol·L-1;两药联用48 h,PTX的IC50由97.022 nmol·L-1降至28.340 nmol·L-1。结果表明,XAP可显著抑制A2780细胞的增殖,且随着药物浓度升高及作用时间延长,抑制率升高;与PTX联用后,与PTX组比较,抑制作用增强,IC50明显降低。根据上述结果,选用XAP40 mg·mL-1+PTX10 nmol·L-1进行后续实验。
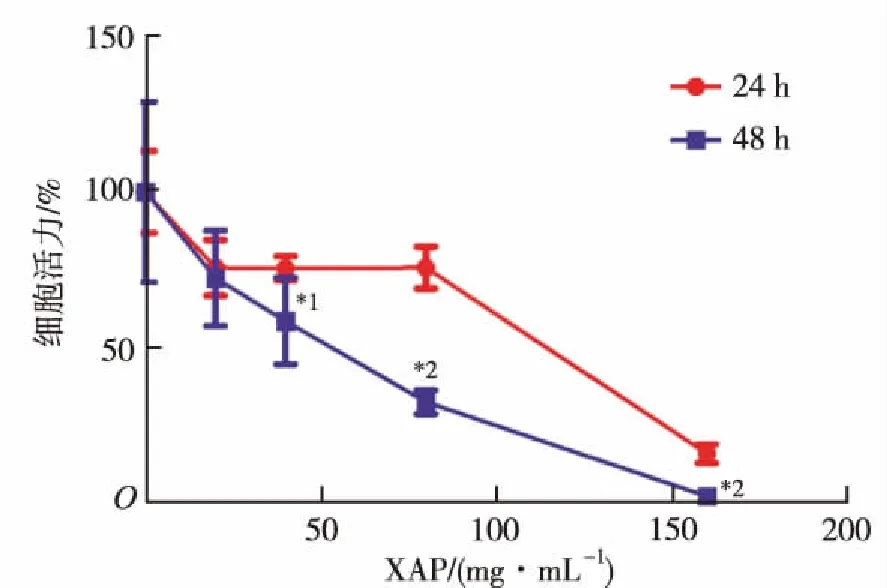
与24 h比较,*1P<0.05,*2P<0.01

Compared with 24 h,*1P<0.05,*2P<0.01
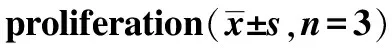
2.2对A2780细胞形态的影响 药物作用24 h后,对照组细胞形态呈上皮型贴壁生长,大小均一,紧密排列,形状多为多角形或类圆形,生长旺盛;XAP组贴壁细胞数较对照组减少,细胞较完整;PTX组及XAP+PTX组贴壁细胞数明显减少,视野中可见皱缩飘浮的死细胞,贴壁细胞内颗粒增多;对比发现,XAP+PTX组细胞数明显少于PTX组,细胞排列稀疏,形状不规则,伴有较多飘浮的死细胞和细胞碎片。药物作用48 h后,各药物组细胞形态变化与24 h相似,细胞碎片和皱缩漂浮的死细胞数量更为增多,见图3。
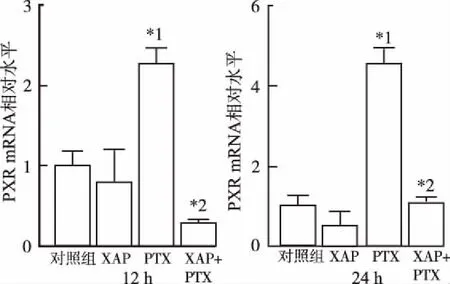
2.3对A2780细胞PXR和CAR的mRNA表达水平的影响 各组药物分别作用12和24 h后,提取细胞总RNA,经过反转录、两步法扩增cDNA,按2-ΔΔCt相对定量法计算目标片段的mRNA相对表达水平。扩增结果显示,加药作用12和24 h后,与对照组比较,PTX10 nmol·L-1组PXR mRNA表达显著增加(P<0.01),而PTX与XAP 40 mg·mL-1联用后,PXR mRNA表达与PTX组相比均显著降低(P<0.01),表达水平接近对照组(图4)。药物作用12 h后,XAP+PTX组CAR mRNA表达低于PTX组,加药24 h后XAP+PTX组CAR mRNA表达水平也低于PTX组,但差异无统计学意义(图5)。结果提示,PTX可显著上调A2780中PXR mRNA表达,与XAP联用后,PXR mRNA的表达被抑制。
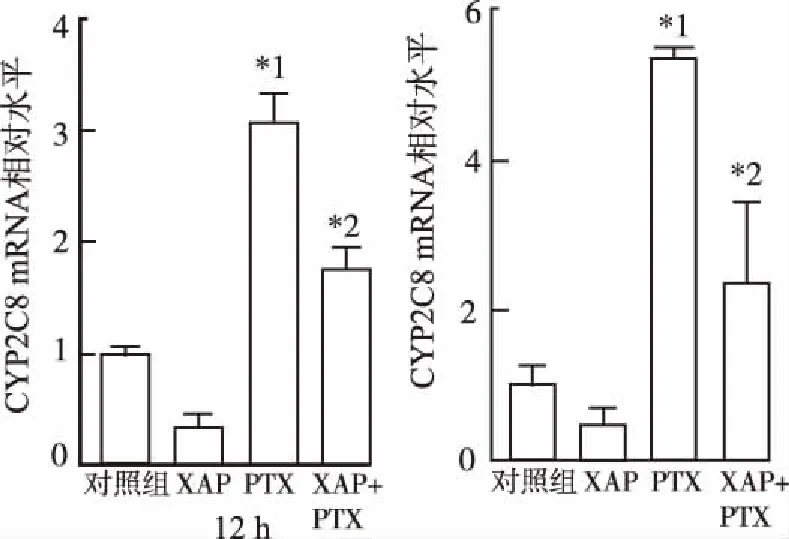
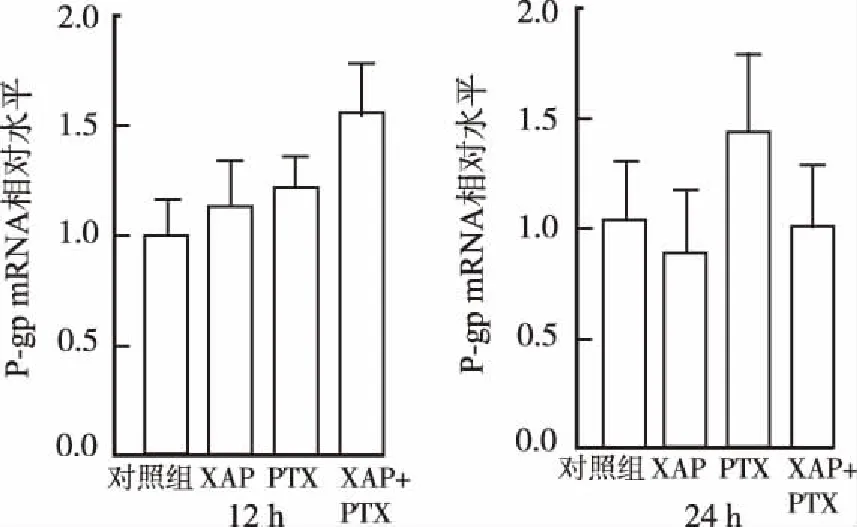
2.4对A2780细胞内CYP2C8、CYP3A4、CYP3A5和P-gp mRNA表达水平的影响 各药物作用12和24 h后,与对照组比较,PTX10 nmol·L-1组CYP2C8 mRNA表达显著增加(P<0.01),而PTX+XAP组CYP2C8 mRNA表达与PTX组相比明显降低(P<0.01)(图6)。各药物作用12和24 h后,CYP3A4 mRNA的表达变化趋势与CYP2C8相似,但仅PTX作用12 h可导致CYP3A4 mRNA表达显著增加(P<0.05),其余各组均差异无统计学意义(图7)。各药物作用12和24 h后,CYP3A5和P-gp mRNA表达变化均差异无统计学意义,见图8,9。结果提示,PTX能够显著上调A2780细胞中CYP2C8和CYP3A4 mRNA的表达,与XAP联用后,CYP2C8的表达水平降低。
与PTX组比较,*1P<0.05,*2P<0.01

Compared with PTX group,*1P<0.05,*2P<0.01
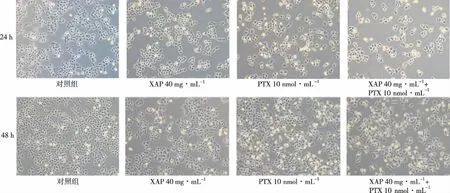
图3 XAP和PTX作用于A2780细胞24和48 h后形态(×200)
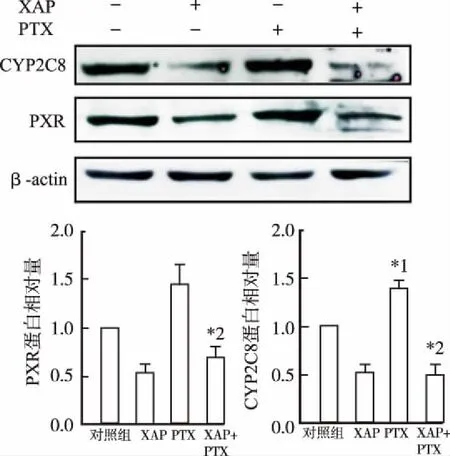
与对照组比较,*1P<0.01;与PTX组比较,*2P<0.01

Compared with control group,*1P<0.01; Compared with PTX group,*2P<0.01


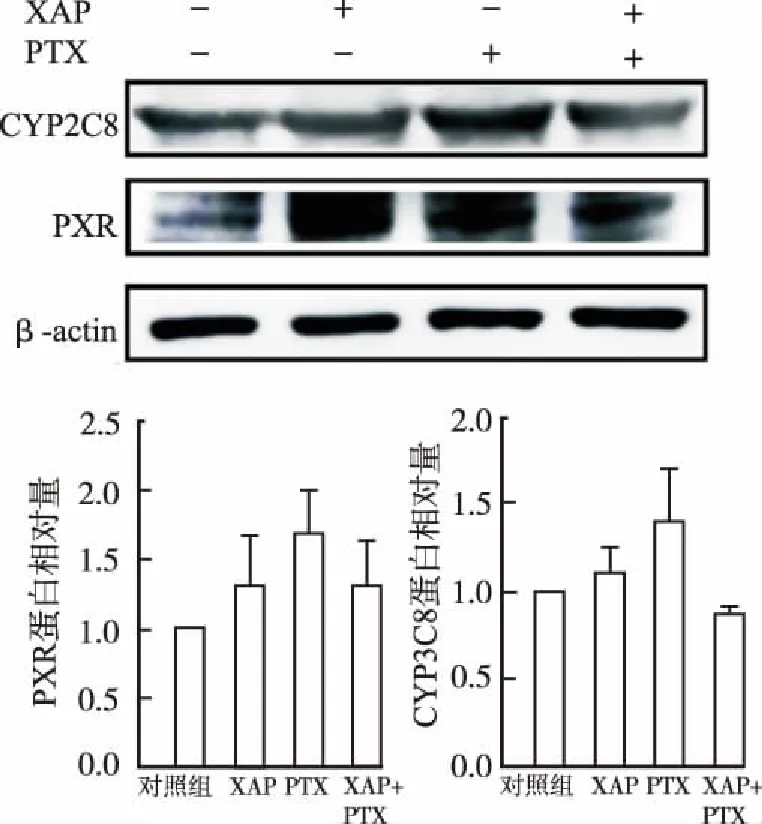
2.5对A2780细胞内PXR和下游药物代谢酶CYP2C8蛋白表达水平的影响 Western blotting结果显示,药物作用24 h,与对照组比较,PTX10 nmol·L-1组PXR和CYP2C8蛋白表达升高;与XAP联用后,因PTX激活PXR、CYP2C8蛋白表达降低,但差异无统计学意义(图10)。药物作用48 h,PTX 10 nmol·L-1组PXR、CYP2C8蛋白表达高于对照组,XAP和PTX合用可显著抑制PXR、CYP2C8蛋白的表达(P<0.05)(图11)。结果提示,XAP+PTX可抑制由PTX激活的PXR、CYP2C8的蛋白表达。
3 讨论
卵巢癌是妇科肿瘤中发病率第二、病死率第一的恶性肿瘤,PTX作为卵巢癌的一线化疗药物,目前已在临床上广泛应用。但其严重的毒副反应[12]和易引发耐药[13]的特点,影响它的疗效,因此临床常将PTX与其他抗癌药物联用[14],以期达到增加药效、逆转耐药的治疗效果。近年来,化疗药物与中药联用逐渐引起重视,PTX与人参皂苷[15]、香菇多糖[16]、白藜芦醇[17]等中药单体或提取物联用均已证实对肿瘤治疗有一定增效作用。
与对照组比较,*1P<0.01;与PTX组比较,*2P<0.01

Compared with control group,*1P<0.01; Compared with PTX group,*2P<0.01

与对照组比较,*1P<0.05

Compared with control group,*1P<0.05




XAP可单用治疗肺癌、肝癌、胃肠肿瘤,联合放化疗治疗非小细胞肺癌等恶性肿瘤[18],具有增效减毒的作用,能明显提高放化疗的临床疗效。有研究表明,XAP可阻滞肿瘤细胞周期[19];诱导肿瘤细胞凋亡;甚至可以逆转肿瘤耐药,提高肿瘤细胞对化疗药物的敏感性。本研究首先探究XAP单用和与PTX联用对卵巢癌A2780细胞增殖的抑制作用,寻找适合进行后续实验的药物浓度。由于XAP是中药制剂,故药物浓度用每毫升含有生药量表示。通过预实验确定实验药物浓度为XAP 20,40,80,160 mg·mL-1和PTX 10,40,80,160 nmol·L-1,MTT实验结果证明,XAP对肿瘤细胞活力的抑制作用随浓度增加和作用时间延长而显著增强,此结果与已发表文献基本一致[2]。在与PTX联用24和48 h后,PTX对细胞增殖的抑制作用明显增强,PTX的IC50降低2~3倍。依据此实验结果,选用XAP40 mg·mL-1单用时对A2780细胞抑制率约为25%,且联合用药时可显著降低细胞存活率至40%~60%的药物浓度进行后续实验。而较高浓度XAP(80 mg·mL-1)与PTX联用后对细胞形态及密度影响太大,不适合采用此浓度进行联合作用机制的研究。
与对照组比较,*1P<0.05;与PTX组比较,*2P<0.05

Compared with control group,*1P<0.05; Compared with PTX group,*2P<0.05
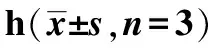
PTX在人体内主要是经由药物代谢酶CYP2C8、CYP3A4/5和转运体P-gp介导的代谢消除,其中2/3的代谢清除是经由CYP2C8代谢转化为6α-羟基紫杉醇,而核受体PXR、CAR被证实可以调控多种药物代谢酶的转录表达,其中就包括CYP2C8、CYP3A4等CYP酶及转运体P-gp,且PXR、CAR底物种类繁多,PTX就是其激活剂之一,对PXR和CAR激活或抑制都会引起下游代谢酶及转运体的表达变化。本课题组前期研究发现XAP可以抑制人肝微粒体CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19及CYP3A4/5的活性[20],故需要在细胞分子水平上证明XAP与PTX联合增效作用及其对核受体PXR/CAR和下游药物代谢酶和转运体在mRNA和蛋白水平表达量的变化。本研究采用RT-PCR的方法检测消癌平注射液对PXR和CAR两种核受体mRNA及紫杉醇的主要代谢酶CYP2C8、CYP3A4/5和转运体P-gp mRNA的影响,结果显示,PTX作用12和24 h均可显著增强细胞中核受体PXR mRNA的表达,进而引起其下游药物代谢酶CYP2C8 mRNA的表达水平显著升高,而联用PTX后,PXR和CYP2C8的mRNA水平明显降低。为检测XAP对mRNA翻译后蛋白表达的影响,笔者采用Western blotting检测有显著改变的基因编码的蛋白的表达情况。结果显示,XAP作用48 h对PXR和CYP2C8蛋白的表达有显著抑制作用,证实在卵巢癌A2780细胞内核受体PXR与药物代谢酶CYP2C8表达呈正相关性,XAP可以抑制核受体PXR,影响XAP经CYP2C8的代谢消除,从而增加PTX在肿瘤细胞内的浓度,导致PTX药效增强。以往研究中药与PTX联用增效的角度大都局限在肿瘤凋亡、自噬等机制,本研究创新性地将核受体-药物代谢酶途径对PTX药效的影响作为立足点,探究中药制剂XAP通过影响PTX代谢效率而增强其药效的作用,为中药化疗药联用增效机制提供了新思路。
综上所述,XAP可增强PTX对卵巢癌A2780细胞生长的抑制作用,其机制可能与XAP抑制PTX对PXR的激活和下游药物代谢酶CYP2C8的表达,从而影响PTX代谢消除过程,增强肿瘤细胞对PTX敏感性有关。以上结果提示,XAP与PTX联用对卵巢癌的治疗有一定增效作用,为临床上XAP与PTX联用提供理论依据。但此实验仅为体外细胞实验,还需要进一步在体内实验及酶活性实验中对两药的联合作用效果和作用机制进行验证。
