宫廷奶酪中优良乳酸菌菌株的分离与鉴定
2019-06-17吴凤玉吴梦盈杨昊寰杨贞耐
吴凤玉, 郑 喆, 李 柳, 吴梦盈, 杨昊寰, 杨贞耐
(北京工商大学 北京食品营养与人类健康高精尖创新中心/食品添加剂与配料北京市高等学校工程中心, 北京 100048)
宫廷奶酪,也称为米奶酒或扣碗酪,是我国北方少数民族的传统乳制品。这种利用牛乳汁与米酒混合制成的半凝固食品,口感软嫩爽滑,具有独特的酒香与奶香,很容易被我国消费者接受。宫廷奶酪口感与风味的形成与其发酵过程中米酒微生物的作用密切相关[1]。腾军伟等[2-3]在酒曲中分离得到11株细菌和2株真菌,筛选出1株高产凝乳酶的解淀粉芽孢杆菌; Liu等[4]分析了绍兴黄酒中的微生物,发现芽孢杆菌和明串珠菌等为主要菌属;Lv等[5]报道传统米酒发酵起始物中的优势菌株为乳酸菌和芽孢杆菌;Huang等[6]报道红曲糯米酒中随着发酵的进行,乳杆菌和明串珠菌成为主要菌属。甜酒曲中也存在丰富的乳酸菌如肠球菌,乳杆菌等。乳酸菌在发酵过程中可能由于氧和营养成分的变化而产生不同的有机酸[7],不仅是酸香味的主要来源,还具有抑制有害菌生长的特性[8]。然而,有关米酒微生物发酵制作的宫廷奶酪中乳酸菌的分离鉴定及其功能特性的研究较少。
研究采集了4种北京市售宫廷奶酪,采用形态学观察、生理生化实验以及16S rDNA分子生物学鉴定方法,结合菌株的抑菌作用、抗氧化活性和产酸能力测定,分离筛选乳酸菌优良菌株,为进一步研究开发功能性乳制品奠定基础。
1 材料和方法
1.1 实验材料
实验样品:宫廷奶酪样品来自4个市售品牌。
指示菌:大肠杆菌、金黄色葡萄球菌、阪琦杆菌、志贺氏菌、沙门氏菌、李斯特菌,菌株由北京工商大学乳品实验室菌种保藏库保藏。
1.2 仪器与设备
BX53型显微镜,日本Olympus公司;U- 3900型分光光度计,日本HITACHI公司;HZQ- Q型气浴恒温摇床,上海一恒科学仪器有限公司;VCX500型细胞破碎仪,美国Sonics公司。
1.3 实验方法
1.3.1培养基的配制
MRS液体培养基:蛋白胨10 g、牛肉膏5 g、酵母粉4 g、葡萄糖20 g、吐温80 1 mL、K2HPO4·7H2O 2 g、无水乙酸钠3.02 g、柠檬酸三铵2 g,MnSO4·4H2O 0.05 g、MgSO4·7H2O 0.2 g、琼脂15 g、蒸馏水1 000 mL,将培养基调至pH值6.2,121 ℃灭菌15 min。
MRS固体培养基:向100 mL液体培养基中添加2 g琼脂,121 ℃,15 min灭菌。
钙平板培养基:向100 mL固体培养基中添加1 g的碳酸钙,121 ℃,15 min灭菌。
1.3.2乳酸菌的初筛
取10 g的样品于100 mL MRS液体培养基中,37 ℃富集培养,将富集培养的样品用质量分数0.9%的生理盐水做梯度稀释,取合适梯度平板涂布,37 ℃培养48 h。挑取单菌落对其进行平板划线分离纯化,得到形态一致的单一菌落。
1.3.3乳酸菌的复筛
钙平板实验:将初筛的菌株活化后用三点法接种到钙平板培养基,37 ℃恒温培养24 h,观察是否产生溶钙圈。
过氧化氢酶实验: 挑取纯培养物1环于载玻片上,与体积分数3%H2O2混匀,若有气泡产生,为阳性,反之为阴性。
1.3.4基于16S rDNA的菌种分子生物学鉴定
将样品送至北京鼎国昌盛生物技术有限责任公司测序。测序结果与Gen Bank中已知菌株的相应序列进行比对,利用MEGA 6.0软件将实验菌株与选取的序列相似性较高的菌株序列进行对比分析,构建系统发育进化树。
1.3.5乳酸菌发酵液抑菌活性测定
采用牛津杯法[9],取200 μL浓度一定的指示菌悬液在LB平板培养基上涂布。将灭菌后的牛津杯放置在平板上,吸取200 μL离心后的发酵液于牛津杯中,37 ℃培养24 h,测定抑菌圈直径大小。
1.3.6乳酸菌羟自由基清除能力测定
样品制备:将乳酸菌37 ℃培养24 h,6 000 r/min离心,用PBS(pH值7.2)缓冲溶液洗涤3次,重悬。调整菌悬液浓度为109CFU/mL,从而制得菌体细胞。取10 mL调好浓度的菌体细胞悬液置于冰浴中超声破碎,设置超声破碎时间为30 min,超声4 s,间隔5 s,超声探头温度4 ℃。8 000 r/min离心10 min,离心后获得的上清液即为无细胞提取液。破碎率计算见式(1)。
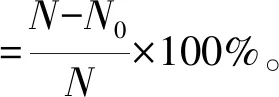
(1)
式(1)中,N表示原始细胞数量,N0表示破碎后完整细胞数量。
采用Fenton法[10],取1 mL菌体细胞悬液和无细胞提取物,在试管中依次加入1 mL 0.435 mmol/L 亮绿,2 mL 0.5 mmol/L 硫酸亚铁,1.5 mL体积分数3% H2O2,37 ℃水浴20 min后在624 nm处测定上清液吸光度。羟自由基清除率计算见式(2)。

(2)
式(2)中,A1表示Fenton试剂、亮绿及样品的吸光度,A0表示Fenton试剂与亮绿的吸光度,A表示亮绿的吸光度。
1.3.7乳酸菌DPPH自由基清除能力测定
样品制备同1.3.6节,向1 mL菌体细胞悬液和无细胞提取物中加入2 mL 0.5 mmol/L DPPH和体积分数95%乙醇溶液,充分混匀,室温下避光静置,反应30 min,8 000 r/min离心10 min,取上清液519 nm处测吸光度。DPPH自由基清除率计算见式(3)。
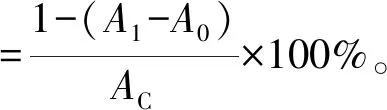
(3)
式(3)中,A1表示DPPH乙醇溶液与样品的吸光度,A0表示样品与乙醇溶液的吸光度,AC表示DPPH乙醇溶液的吸光度。
空白组以等体积的乙醇溶液代替DPPH乙醇溶液;对照组以等体积的无菌水代替菌体细胞悬液和无细胞提取液。
1.4 数据分析
用SPSS 17.0软件进行方差分析,Origin 8.6软件绘图。
2 结果与讨论
2.1 乳酸菌的筛选结果
富集培养的样品经过稀释涂布平板法和平板划线法分离纯化后,共得到15株菌株。菌株产酸实验结果如图1。与原始MRS培养基pH值相比,除MRSC1菌株以外,其余菌株发酵液pH值都有明显下降;其中菌株MRSA1、MRSA2、MRSB1、MRSD3发酵液与初始发酵液相比,pH值下降明显,培养24 h后,发酵液pH值分别低至3.73、3.79、3.71、3.87,产酸效果较其他菌株更好。
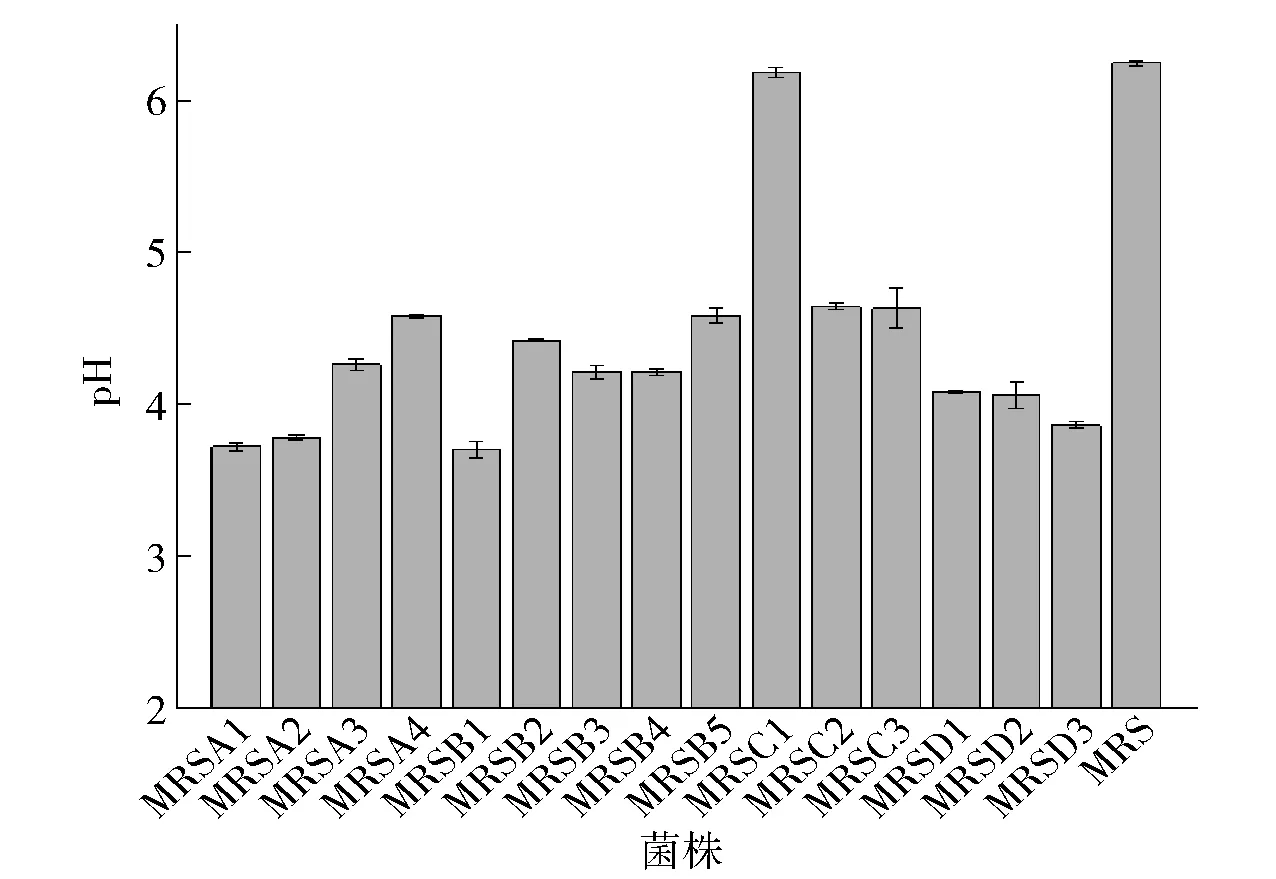
图1 初筛菌株发酵液pH值Fig.1 pH values of fermentation liquor of isolated strains
对菌株MRSA1、MRSA2、MRSB1、MRSD3进行钙平板鉴定、革兰氏染色、过氧化氢酶实验以及菌落特性和菌体形态观察,结果见表1。4株菌在钙平板上均有透明圈出现,说明菌株产酸,使得pH值降低,平板中碳酸钙溶解,形成透明圈。根据其良好的产酸能力、革兰氏染色阳性、过氧化氢酶实验阴性等特性,初步判断此4株菌为乳酸菌。
2.2 16S rDNA基因序列同源性比对与系统发育分析
将菌株MRSA1、MRSA2、MRSB1、MRSD3的16S rDNA基因序列与Gene Bank内已知菌株的相应序列进行对比,通过同源性比对结果构建系统发育树,结果如图2。菌株MRSA2、MRSD3与LeuconostoclactisLMAU40043在同一分支上,且通过Bootstrap的验证表明它们具有较高的置信度,支持率达到100%,因此可将MRSA2、MRSD3鉴定为乳明串珠菌。明串珠菌属通常存在于乳制品、肉类或其他食品中[11]。与其他乳酸菌一样,明串珠菌属是重要的工业发酵微生物,用于多种工业和食品发酵过程,如奶酪、黄油、酸奶和泡菜的生产[12]。 明串珠菌是乳制品生产中重要的风味微生物[13],在风味酸奶、干酪生产中应用较多,其通过代谢柠檬酸盐等有机酸产生的风味物质和CO2等,不仅对发酵乳制品的风味和组织状态有重要影响,还具有潜在的益生作用[14]。

表1 微生物菌落形态及特性观察

图2 4株乳酸菌系统发育进化树Fig.2 Phylogentic tree of four isolated strains based on 16S rDNA sequence
菌株MRSA1、MRSB1与EnterococcusfaeciumHY07 CP032308在同一分支上,且通过Bootstrap的验证表明它们具有较高的置信度,支持率达到99%,因此可将MRSA1、MRSB1鉴定为屎肠球菌。
2.3 乳酸菌抑菌和抗氧化活性分析
2.3.1抑菌活性分析
菌株MRSA1、MRSA2、MRSB1、MRSD3在37 ℃发酵24 h后,发酵液pH值无显著性差异(P>0.05)。对大肠杆菌、沙门氏菌、金黄色葡萄球菌、李斯特菌、志贺氏菌、阪琦杆菌6株病原菌的抑菌实验结果如图3和表2。这4株乳酸菌对6株病原菌均有抑制作用,MRSA2的抑菌效果最强,对指示菌的抑菌效果显著高于其余菌株 (P<0.05),对大肠杆菌、金黄色葡萄球菌、阪琦杆菌、沙门氏菌、志贺氏菌均具有较强抑菌效果,抑菌圈直径均在16 mm以上。菌株MRSA1对金黄色葡萄球菌有良好抑菌效果,MRSB1对阪琦杆菌和沙门氏菌有良好的抑菌效果,MRSD3对指示菌的抑菌效果较弱。这些菌株的不同抑菌效果,可能与其产生的不同抑菌物质有关。对发酵液用NaOH溶液调pH值至7,进一步分析抑菌活性,表明4株乳酸菌发酵液经碱中和后,对6株病原菌的抑菌活性全部消失,由此推测这4株乳酸菌的主要抑菌活性物质为酸性物质。
乳酸菌在发酵过程中能产生具有抑制腐败菌的代谢产物,如有机酸、过氧化氢、细菌素和二乙酰等[15]。在中和处理酸性代谢产物后,大多数乳酸菌的抗菌活性丧失[16]。苏本宪等[17]分析植物乳杆菌、瑞士乳杆菌、副干酪乳杆菌代谢产物对化脓性链球菌的抑制作用,发现主要抑菌物质为有机酸和H2O2。某些明串珠菌能够产生抑菌成分,抑制发酵乳制品中有害菌的生长[18]。李东霞等[19]用牛津杯双层法从蔬菜废弃物中筛选出2株具有高抑菌活性的乳明串珠菌,其主要抑菌活性物质为酸性物质,与本研究结果一致。具有良好抑菌活性的明串珠菌可以抑制自然发酵食品中致病菌的生长,因此具有重要研究意义[20]。

1—MRSA1; 2—MRSA2; 3—MRSB1; 4—MRSD3。图3 菌株抑菌活性测定Fig.3 Antibacterial activities of strains

菌株发酵液pH大肠杆菌金黄色葡萄球菌李斯特菌阪琦杆菌沙门氏菌志贺氏菌MRSA13.99±0.04+++++++MRSA23.84±0.06+++++++++++++++++MRSB13.85±0.05++++++++MRSD34.01±0.04++++++
抑菌圈直径包含牛津杯外径(7.8 mm);+:抑菌圈直径8.00~12.00 mm,抑菌效果较弱;++:12.00~16.00 mm,抑菌效果良好;+++:16.00~20.00 mm,抑菌效果较强。数值以平均值±标准差表示。
2.3.2抗氧化活性分析
实验中细胞菌悬液经细胞破碎仪处理,菌株的破碎率达100%。4株乳酸菌的抗氧化活性测定结果如图4,菌株对DPPH自由基和羟自由基均有不同程度的清除作用,且菌悬液的抗氧化能力高于无细胞提取物。菌株MRSA1和MRSA2的DPPH自由基清除能力显著高于其他2株菌(P<0.05),完整细胞菌悬液的清除能力显著高于无细胞提取液(P<0.01),因此初步推测乳酸菌清除DPPH自由基的活性物质主要存在于细胞表面。不同菌株之间羟自由基清除能力无显著性差异(P>0.05)。
氧化作用是生物体内重要的生理过程,在此过程中会产生自由基,当自由基超过一定量时,就会对机体造成损伤[21]。乳酸菌的抗氧化活性已经通过体内和体外实验证明,含有乳酸菌的功能性食品也越来越受到青睐[22]。不同乳酸菌的抗氧化能力存在差异,可能是由于菌株分泌的抗氧化活性物质种类和含量不同引起的[23]。刘宏宇等[24]研究了25株不同乳酸菌的抗氧化活性,发现肠膜明串珠菌的DPPH自由基清除能力最高可达30.73%,本研究的乳明串珠菌DPPH自由基清除能力高达60.67%。

DPPH-1、Hydroxyl-1表示细胞破碎前菌悬液,DPPH-2、Hydroxyl-2表示无细胞提取液。图4 菌株对DPPH自由基和羟自由基的清除率Fig.4 DPPH and hydroxyl radical scavenging activities of selected strains
3 结 论
从4种市售宫廷奶酪中分离并经初筛和复筛得到4株乳酸菌,其中菌株MRSA1和MRSB1鉴定为屎肠球菌,MRSA2和MRSD3为乳明串珠菌。抑菌实验结果表明,此4株乳酸菌均有抑菌活性,其中MRSA2对大肠杆菌、金黄色葡萄球菌、沙门氏菌、阪琦杆菌和志贺氏菌有较强抑制作用;而将发酵液pH值调至中性后,抑菌效果消失,推测抑菌活性物质为酸性物质。抗氧化活性实验结果表明,4株菌均对DPPH自由基和羟自由基具有清除能力,菌悬液的自由基清除率显著高于无细胞提取液。菌株MRSA1和MRSA2的DPPH自由基清除能力分别高达55.04%和60.67%,4株菌的羟自由基清除能力无明显区别。本研究筛选的具有良好抑菌特性、抗氧化活性和产酸能力的乳明串珠菌在功能性发酵食品中有潜在的应用前景。
