软枣猕猴桃不定根不同溶剂提取物抗氧化活性比较分析
2019-06-14郝悦君安晓丽孙浩丁廉美兰金美玉
高 原, 郝悦君, 安晓丽, 孙浩丁, 廉美兰, 金美玉
(延边大学农学院,吉林 延吉 133002)
软枣猕猴桃(Actinidiaarguta)又名软枣子、藤枣,是猕猴桃科(Actinidiaceae)、猕猴桃属(Actinidia)多年生落叶藤本植物[1],主要分布于我国东北、华北以及长江流域等地[2]。软枣猕猴桃果实可直接食用,味道酸甜可口,其根可作为药材,具有清热利水、增强免疫力等药用功效。软枣猕猴桃根中的化合物大致可分为6种,分别是黄酮类、蒽醌类、五环三萜类、甾体类和生物碱类等,其中黄酮类化合物是软枣猕猴的主要有效活性物质之一,具有抗氧化、预防心血管疾病、调理肝脏等效果[3-5]。在抗癌、防癌以及抑制脂肪酶方面也有明显功效[6],广泛应用于医药生产[7]。目前,在软枣猕猴桃根化学成分的提取分离和定量测定、抗肿瘤特性、抗炎特性等方面有许多研究报道[8]。但由于软枣猕猴桃萌芽所需温度低,发根时间长[9],扦插成活率低等问题,导致软枣猕猴桃根资源短缺,成为实现产业化亟待解决的问题之一[10]。因此,一些学者开始寻找可以大量获取植物资源的有效替代途径。目前植物细胞或器官的培养可实现短期内大量生产代谢产物的目的,成为一种可替代植物资源传统生产的有效途径[11]。本研究利用生物反应器培养软枣猕猴桃不定根,利用5种不同的溶剂对软枣猕猴桃不定根进行提取后,采用DPPH、ABTS和铁离子螯合力等3种方法评价了不定根不同溶剂提取物的抗氧化活性,旨在为软枣猕猴桃不定根应用于抗氧化相关产品的生产提供理论依据。
1 材料与方法
1.1 材料
软枣猕猴桃组培苗由延边大学农学院提供。软枣猕猴桃不定根见图1。

图1 软枣猕猴桃不定根
将组培苗根切至1 cm长接种于含25 mL培养基(MS+IBA 0.25 mg/L+蔗糖30 g/L+8 g琼脂,pH值5.8)的培养皿中诱导不定根(图1A),将诱导出的不定根切至1 cm长,精密称取30 g不定根接种于含4 L液体培养基的5 L气球型生物反应器中进行培养(图1B)。培养基为MS+IBA 0.25 mg/L+蔗糖30 g/L,pH值5.8,通气量调节为100 mL/min,在25 ℃的暗环境中培养30 d后,收获不定根(图1C),在流水下冲洗3次,沥干,置于45 ℃恒温烘干箱中烘至恒重(48 h),将其作为试验材料。
1.2 试剂和仪器设备
1,1-二苯基-2-三硝基苯肼(DPPH,索莱宝公司,中国),2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS,索莱宝公司,中国),过硫酸钾(K2S2O8,麦克林公司,中国),抗坏血酸(VC,Sigma公司,美国),氯化亚铁(FeCl2·2H2O,索莱宝公司,中国),其余试剂均为分析纯。
YHW1103远红外快速干燥箱(天津市华北实验仪器有限公司);UV1102紫外分光光度计(上海天美科学仪器有限公司);JA2002电子天平(上海精天电子仪器有限公司)。
1.3 方法
1.3.1 软枣猕猴桃不定根提取物的制备
称取干燥的不定根2 g,分别使用乙酸乙酯、正丁醇、水、甲醇和乙醇按照料液比1∶30进行超声提取,提取时间为1.5 h,收集滤液,重复3次后减压浓缩至膏状,置于45 ℃烘干箱中烘至恒重,置于-20 ℃冰箱中备用。
1.3.2 软枣猕猴桃不定根提取物总黄酮含量的测定
参照李伟等[12]方法测定总黄酮含量,并略作改动。分别称取不同溶剂提取物0.01 g,用75%酒精溶解并定容至25 mL做样品待测液。分别取浓度为0.04 mg/mL的芦丁标准液0、0.1、0.2、0.4、0.6、0.8和1.0 mL于试管中,取各样品待测液0.4 mL 于试管中,用75%酒精定容至2 mL,加5%的NaNO2溶液0.3 mL,反应6 min后,加10%的Al(NO)3溶液反应6 min,再加4% NaOH溶液2 mL,在510 nm处测得吸光值。以吸光度为横坐标,浓度为横坐标,绘制标准曲线并得线性回归方程:
y=4.183 2 x-0.001 1,R2=0.998 2
黄酮含量/(mg/g)=CVD×100
式中,C为样品溶液浓度;V为样品溶液体积;D为稀释倍数。
1.3.3 清除DPPH自由基活性测定
采用DPPH法[13],将5种软枣猕猴桃不定根提取物分别配置成0.1、0.2、0.3、0.4、0.5 mg/mL的浓度,分别取2 mL上述样品至试管中,加入2 mL浓度为0.1 mol/L的DPPH溶液,Vc做阳性对照,避光反应30 min,对照组用2 mL甲醇代替样品,在517 nm处测定OD值。
清除率=(A对照-A样品)/A样品×100%
1.3.4 清除ABTS自由基活性测定
参照楚秉泉等[14]的方法,并略作改动。用去离子水配置2.45 mmol/L过硫酸钾和7 mmol/L的ABTS+·混合溶液。避光静置16 h,使用前用去离子水稀释至吸光值为 0.700±0.02(734 nm)的ABTS+·工作液。将5种软枣猕猴桃不定根提取物分别配置成0.2、0.4、0.6、0.8、1.0 mg/mL的浓度,分别取0.1 mL待测样本加入3.9 mL的ABTS+·工作液;空白组加入0.1 mL去离子水;空白对照组为加入0.1 mL甲醇。混匀后室温下反应6 min,在734 nm下测定OD值。Vc溶液作为阳性对照。
ABTS+·清除率/%=[1-(A待测样-A空白组)/A空白对照]×100%
1.3.5 铁离子螯合能力测定
根据Fu等[15]的方法并稍作改进,将5种软枣猕猴桃不定根提取物分别配置成0.625、1.25、2.5、5、7.5、10 mg/mL的浓度,分别取50 μL待测样品于96孔板中,加入137.5 μL蒸馏水,2.5 μL浓度为2 mmol的FeCl2溶液,摇匀后加入10 μL浓度为5 mmol的菲洛嗪溶液,室温下静置10 min。对照组以2.5 μL蒸馏水代替FeCl2溶液,空白组以50 μL蒸馏水代替样品,于562 nm下测定OD值,同等浓度下柠檬酸做阳性对照,计算铁离子螯合能力。
螯合能力%=[1-(A样品-A对照)/A空白]×100%
1.3.6 数据处理
所有数据均为3次重复结果的平均值,利用Graphpad Prism 7软件程序,采用T测验对数据进行比较。采用SPSS 22软件程序,采用邓肯氏新复极差法对数据进行分析,P<0.05具有统计学意义。
2 结果与分析
2.1 不同溶剂提取物中总黄酮含量
分别对5种不同溶剂提取的软枣猕猴桃不定根提取物中总黄酮含量进行测定,从图2可以看出,不同溶剂间总黄酮含量有显著性差异,黄酮含量依次为:乙酸乙酯>乙醇>正丁醇>甲醇>水,其中,乙酸乙酯提取物中总黄酮含量达到最高,为165.56 mg/g,其次是乙醇提取物,总黄酮含量为101.19 mg/g,甲醇和正丁醇提取物中总黄酮含量与乙醇提取物无显著性差异,水提物黄酮含量仅为62.27 mg/g。
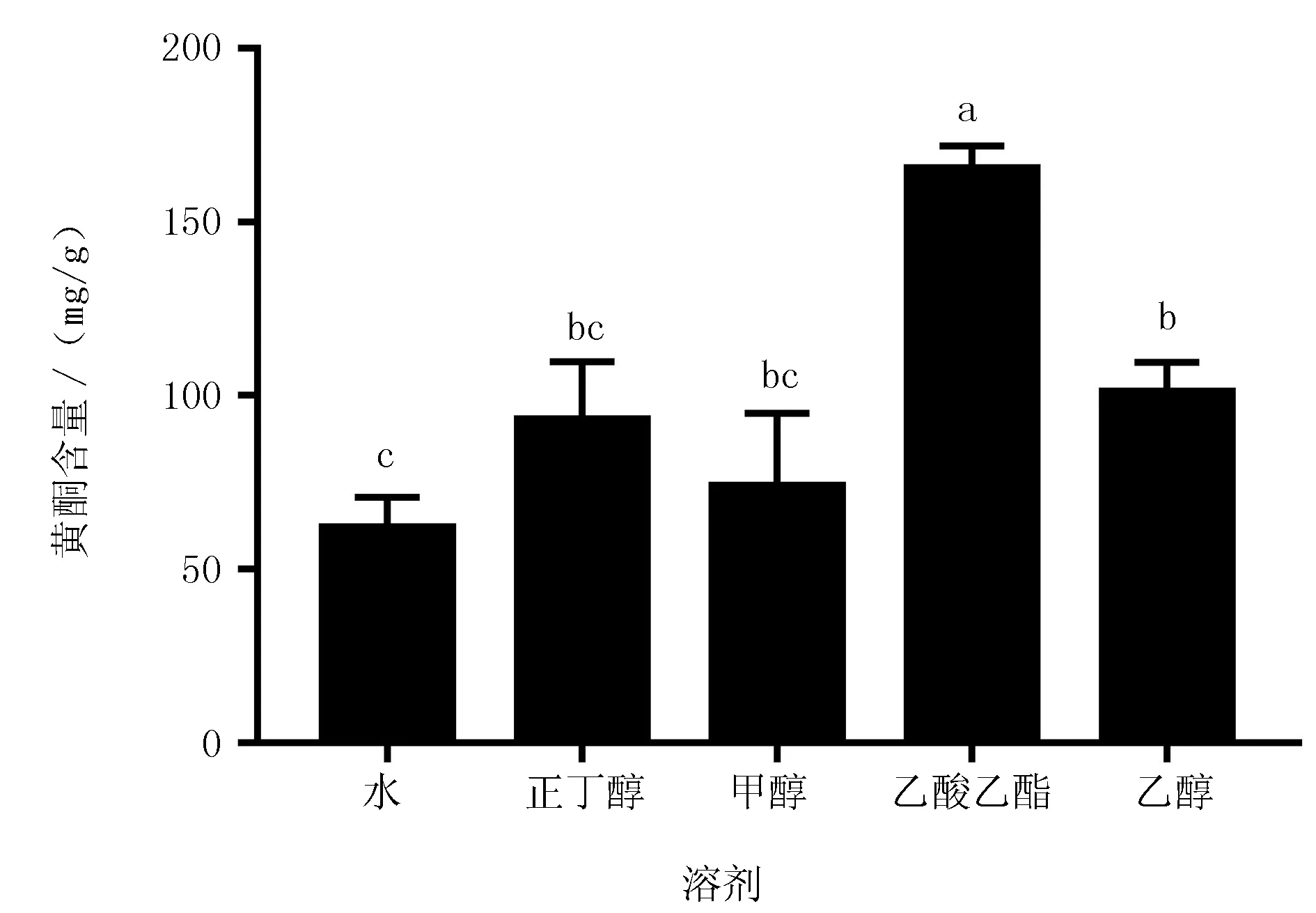
图2 不同溶剂提取软枣猕猴桃不定根总黄酮含量
2.2 不同溶剂提取物清除DPPH自由基能力
由图3可知,软枣猕猴桃不定根的5种提取物对DPPH自由基都有一定的清除能力,其中,乙酸乙酯提取物在浓度为0.1 mg/mL时,清除率达到了88.09%,而甲醇提取物在浓度为0.2 mg/mL时,清除率也达到了86.41%,清除能力稍低于VC(90.60%)。当提取物浓度为0.1 mg/mL时,不同溶剂提取物清除DPPH自由基的能力依次为:乙酸乙酯>甲醇>乙醇>正丁醇>水。
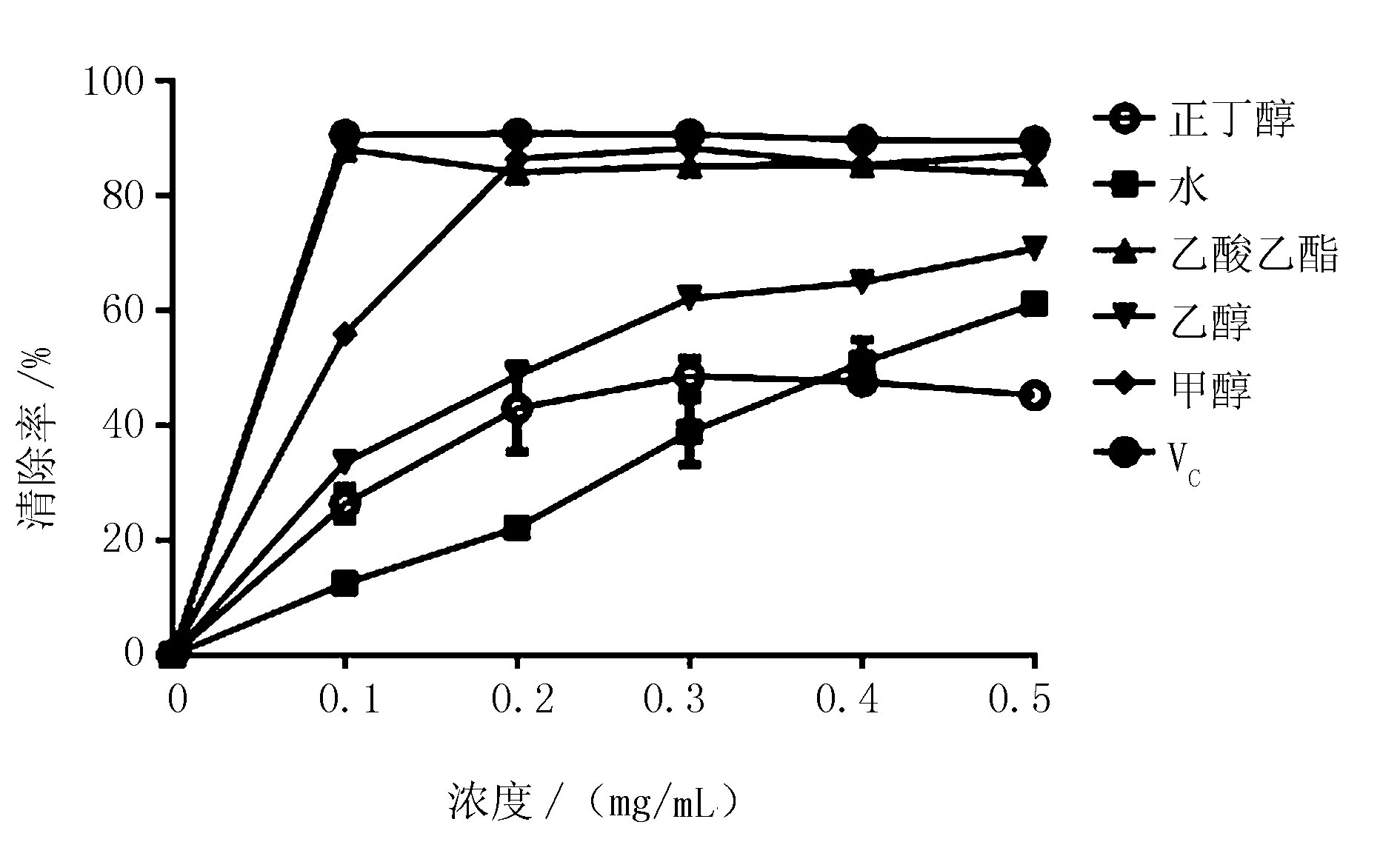
图3 软枣猕猴桃不定根不同溶剂提取物清除DPPH自由基能力
2.3 不同溶剂提取物清除ABTS自由基能力
由图4可知,不同溶剂提取物清除ABTS自由基的能力,在一定浓度范围内(0~1.0 mg/mL)存在着明显的量效关系。乙酸乙酯提取物清除能力最强,在浓度为1.0 mg/mL时,清除率达到了95.62%,稍低于阳性对照VC(100%)。其次为甲醇提取物,水提取物的清除能力最弱。
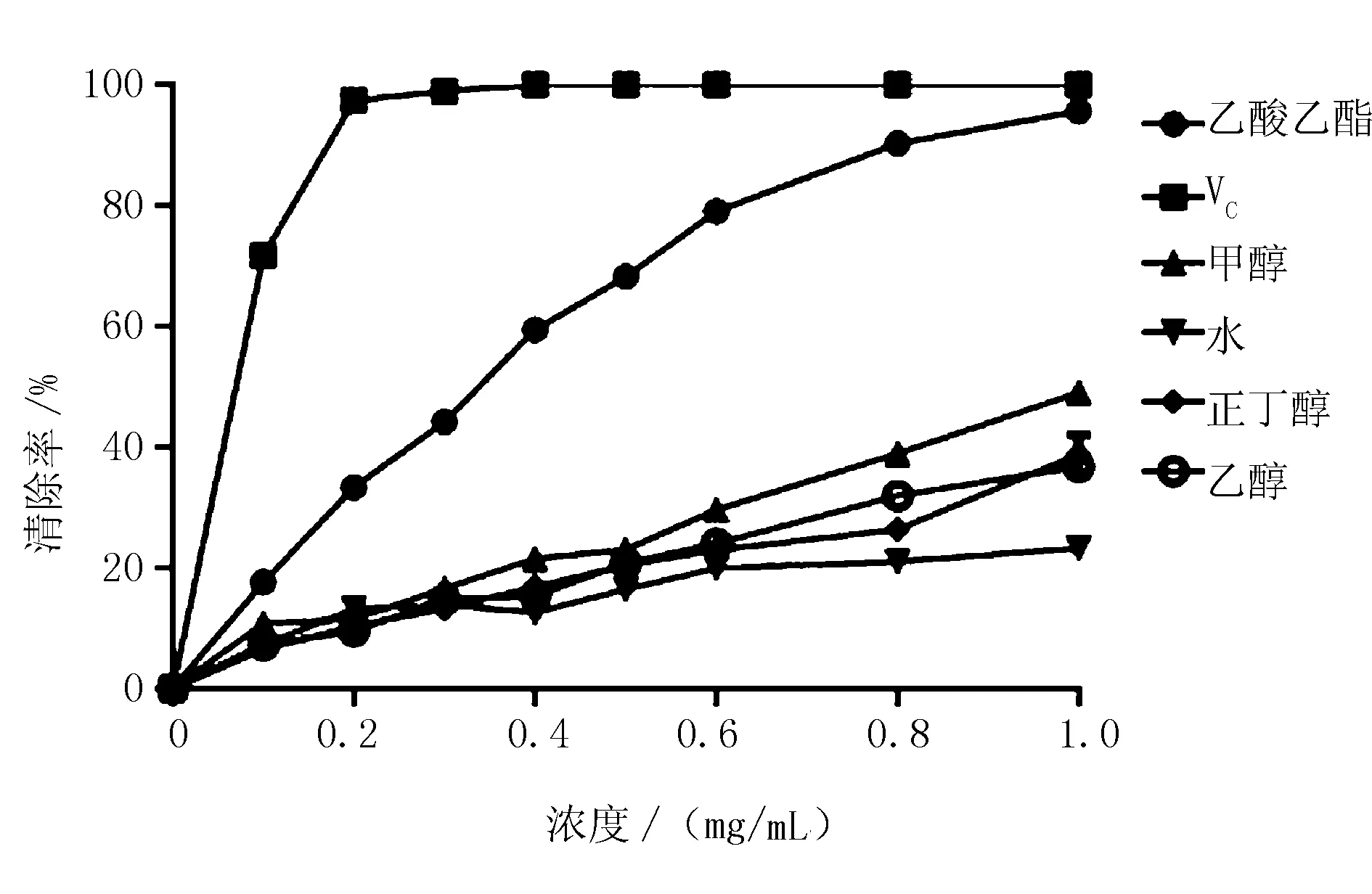
图4 软枣猕猴桃不定根不同溶剂提取物清除ABTS自由基能力
2.4 不同溶剂提取物对铁离子的螯合能力
由图5可知,不同溶剂提取物对铁离子螯合能力的影响,随着提取物浓度升高,螯合能力呈正相关,当达到一定浓度后,铁离子螯合能力保持平稳。其中,乙醇提取物螯合能力在7.5 mg/mL时达到了84.29%,其次是甲醇提取物螯合能力达到了69.38%,而乙酸乙酯提取物螯合能力也达到了61.79%,高出阳性对照柠檬酸(58.90%)。
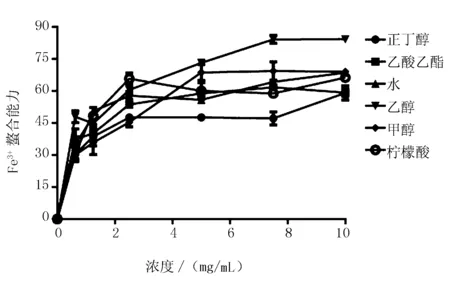
图5 软枣猕猴桃不定根不同溶剂提取物铁离子熬和能力
2.5 软枣猕猴桃不定根不同溶剂提取物抗氧化活性EC50
由表1可知,在3种方式下测定的软枣猕猴桃不定根不同溶剂提取物都具有一定的抗氧化活性,所有提取物在清除DPPH自由基和对铁离子螯合能力上,都表现出较强的活性,在清除ABTS自由基试验中,乙酸乙酯提取物清除能力较为突出,其他提取物表现不明显,而水提取物在清除自由基试验中效果均不理想,这可能与在乙酸乙酯提取物中检测到最高含量的总黄酮有相关性。
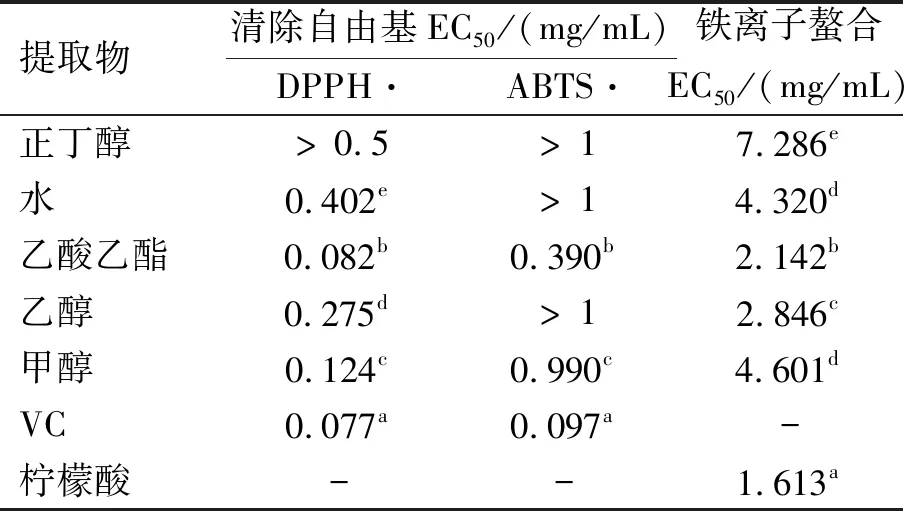
表1 软枣猕猴桃不定根不同溶剂提取物抗氧化活性EC50
注:不同字母表示差异显著(P<0.05);-表示无活性;EC50超出测定浓度范围的数据不进行差异比较。
3 讨论与结论
抗氧化与人体健康关系密切,当人体的正常抗氧化机制出现问题时,如脂质的过氧化、自由基的产生和抗氧化酶活力降低等,都会致使细胞损伤,容易引发癌症、心脏病、机体衰老等[16]。体外抗氧化指标主要可分为自由基的猝灭、还原力的衡量、金属离子的螯合等[17]。而黄酮类化合物作为一种天然的抗氧化剂,可以通过与铁离子络合,与超氧阴离子反应等途径,切断羟基自由基的生成,制止自由基反应引发,起到抗氧化作用[18]。黄春辉等[19]通过对几种猕猴桃果实发育过程中总酚和类黄酮含量以及抗氧化活性差异的研究,发现猕猴桃的果实中酚类物质含量丰富,且随着果实的不断成熟,呈现出逐渐降低的趋势,抗氧化能力与总酚和类黄酮含量呈显著正相关。吴优等[20]通过对软枣猕猴桃挥发油GC-MS的分析及其抗氧化活性测定,发现软枣猕猴桃挥发油在DPPH自由基清除和H2O2清除试验以及总还原能力测试中,均具有很好的抗氧化活性。张声源等[21]采用DPPH法、ABTS法等方法对虎舌红不同溶剂提取物的抗氧化活性进行了分析,发现不同溶剂提取物都表现出抗氧化活性,其中乙酸乙酯提取物的还原能力和清除自由基的能力均强于其他几种溶剂。滕坤等[22]对软枣猕猴桃栽培根的体外抗氧化活性进行探究,发现栽培根提取物清除DPPH和ABTS自由基的EC50分别为27.01 mg/mL和29.55 mg/mL,而本研究中软枣猕猴桃不定根乙酸乙酯提取物清除DPPH和ABTS自由基的EC50要显著低于栽培根,这可能与用生物反应器培养的软枣猕猴桃不定根含有更多的生物活性物质含量,进而提高了抗氧化活性。本试验中,5种溶剂提取的软枣猕猴桃不定根提取物中均含有黄酮,其中乙酸乙酯提取物中总黄酮含量最高,为165.56 mg/g。几种溶剂对于DPPH和ABTS自由基均具有清除能力,其中乙酸乙酯提取物清除能力最强,在浓度为1.0 mg/mL时,对ABTS自由基的清除率达到了95.62%。随着提取物浓度升高,铁离子螯合能力呈现正相关,当达到一定浓度后,铁离子螯合能力保持平稳。在3种方式下测定的软枣猕猴桃不定根不同溶剂提取物,都具有一定的抗氧化活性。本试验中,乙酸乙酯提取物在几种测试中均表现出较好的抗氧化活性,这可能与在乙酸乙酯提取物中检测到最高含量的总黄酮有相关性。因此,乙酸乙酯可以作为软枣猕猴桃不定根抗氧化活性深入研究的极性溶剂,可用于今后软枣猕猴桃不定根抗氧化产品的开发和利用。
