磁敏感成像结合传统影像技术用于帕金森病脑深部电刺激术术前针道设计
2019-06-14黄辉崔桂云路莉祖洁崔晨晨张伟董瑞果江慧于成徐凯肖其华于如同
黄辉 崔桂云 路莉 祖洁 崔晨晨 张伟 董瑞果 江慧 于成 徐凯肖其华 于如同○☆
脑深部电刺激术(deep brain stimulation,DBS)是目前治疗中晚期帕金森病最有效的方法,但极少数患者可导致颅内出血及静脉性梗塞,严重者可引起长期昏迷甚至死亡。其重要原因是穿刺及植入电极过程中损伤颅内血管,因此在术前针道设计时仔细避开血管非常重要。目前常用的3D T1像及T2像往往只能部分显示硬脑膜及脑表面血管,用于针道设计会遗漏很多血管。因3D T1增强像在显示脑组织内动脉性血管有优势,有些帕金森病中心将其用于针道设计,但脑组织内静脉性血管在设计时仍可能遗漏。SWI在卒中筛查中能清楚显示脑组织内静脉性血管[1],本研究将SWI与T1增强像及T2像结合以期提高针道设计时颅内血管的检出率,降低DBS手术的出血风险。收集徐州医科大学附属医院帕金森病诊疗中心2017年6月到2017年10月采用丘脑底核(subthalamic nucleus,STN)DBS手术的 10例帕金森病患者,术前行T2像、3D T1增强像及SWI扫描,重点比较其在术前针道设计中对颅内血管的检出率,现报道如下。
1 材料与方法
1.1 一般资料DBS手术病例入选标准:①原发性帕金森病,其诊断符合英国帕金森病学会脑库帕金森病临床诊断标准;②既往多巴胺类药物治疗有效;③抗帕金森病药物疗效明显下降或出现严重运动症状波动,影响生活质量;④无特殊基础病及慢性病;⑤Hoehn-Yahr分级集中在 3~4级,病程5年以上。以下情况予以排除:①严重认知障碍、精神症状患者;②各种继发性帕金森综合征;③有明显脑萎缩或颅内肿瘤患者;④有慢性基础疾病且预期寿命不超过1年。共收集10例患者,男女各 5 例,年龄 53~76 岁,平均(62±3)岁,病程7~15年,中位病程10年。术前评估及手术方法详见以前报道[2]。术前评估采用:①多巴胺冲击试验,UPDRSⅢ评分提高均在35%以上,UPDRSⅡ提高30%以上;②认知及精神测试。手术方法:植入电极均为美国 Medtronic公司3389型,脉冲发生器为 KINETRA7428型。手术方法采用国际标准化操作流程。术后1个月,启动脉冲发生器并设置刺激参数,6个月后逐渐减少美多芭等药物剂量,使抗帕金森病药物与电刺激协同作用,多次调整刺激参数,以获得最佳综合治疗效果。
1.2 影像学检查患者均在GE750W3.0MRI上扫描,术前MR检查包括3D T1平扫及增强、T2轴位及冠位、SWI,应用瑞典Leksell SurgiPlan系统将T1、T2及SWI等图像进行融合。采用仰卧位,先扫描T1定位像(中线部位15层即可),明确AC-PC线,调整后续扫描线使轴位与之平行,冠位与之垂直,中线则与人体轴线平行。FSE-T2WI轴位扫描参数:平行于前后联合,TR 5348 ms,TE 102 ms,翻转角度 111°,FOV 240 mm,层厚/层间距 2.0/0.0 mm,共50层,激励次数为3,带宽±31.25 kHz。FEST2WI冠状位扫描参数:垂直于前后联合,TR 5339ms,TE 102 ms, 翻转角度 111°,FOV 240 mm,层厚/层间距2.0/0.0 mm,共50层,激励次数为3,带宽±31.25 kHz。SWI(即GE公司的ESWAN序列)扫描参数:TE 5.5 ms,TR 44.5 ms,翻转角度20°,带宽±41.67 kHz,FOV240 mm, 层厚/层间距2.0/0.0 mm。
1.3 针道设计及观察方法T1增强像、T2像及SWI融合后先确定AC-PC线,再设计STN内靶点,分中央、前方、后方、内侧及外侧共5个,中央靶点坐标为 X 轴 10~12 mm,Y 轴 1~2.5 mm,Z轴 4~6 mm,周围4个靶点距中央分别为2 mm(如前方靶点Y轴减少2 mm,X轴及Z轴与中央靶点一致;其余靶点类推),如图1所示。中央靶点针道设计为Arc 左侧 105°右侧 75°及 Ring 58°,前方、后方、内侧及外侧针道与中央针道平行。每个患者双侧STN共10个针道,10例患者100个针道。每个针道及靶点设计完毕后在Leksell SurgiPlan软件的重建模型上从硬膜、脑表面及脑内行走至靶点,三维(冠状位、水平位及有矢状位)动态观察针道及其周围2 mm是否存在血管,如果存在血管则统计整个针道出现的血管数量。同时在T2像及SWI上测量过中央靶点与STN长轴垂直的STN宽度。由神经外科及影像科各一名专家分别参与观察与统计,取二者相加后平均值作为最终数值。
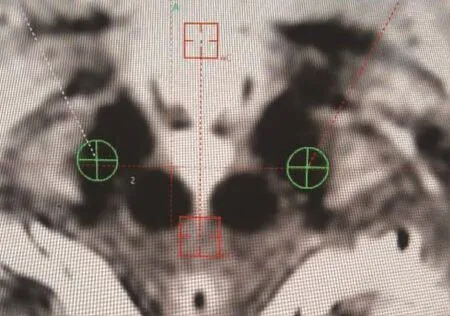
图1STN内靶点设计及过中央靶点测量STN宽度示意图(红点):A,中央;B,前方;C,后方;D,内侧;E,外侧;F,STN 外侧界;G,STN内侧界;线段FG为过中央靶点的STN宽度(垂直于STN长轴)
1.4 统计方法采用SPSS 18.0进行统计学分析,定量数据描述采用均数±标准差(x±s)表示。采用配对t检验,检测水准α=0.05。
2 结果
2.1 三种成像方法显示的血管数比较三种MRI成像方法均设计有100个针道。T2像上有12个针道(12%)观察到血管,总血管数为26根,其中24根血管位于脑膜及脑表面 (占血管数92.3%),每个针道显示的血管数为2.0±0.2。T1增强像上有22个针道(22%)观察到血管,总血管数为72根,其中脑膜及脑表面41根(56.9%),脑组织内31根(43.1%),每个针道显示的血管数为3.0±0.3。SWI上有62个针道观察到血管,总血管数为266根,其中脑膜及脑表面42根(15.8%),脑组织内224根(84.2%),每个针道显示的血管数为4.0±0.3。
对存在血管的针道数、血管总数及每针道血管数三个值进行比较,结果显示SWI上最多、T1增强像其次、T2像最少。T2像主要显示脑膜及脑表面血管(占血管数92.3%),对脑组织内血管很少显示。T1增强像脑表面及脑组织内血管均可显示,但主要是动脉性血管。SWI上显示的血管数远远多于T2像及T1增强像,主要是脑组织内血管尤其是静脉性血管。
2.2 SWI与T2像测量的STN宽度比较100个针道中,SWI上测量的 STN宽度为 3.0±0.3mm,T2像上为 4.0±0.6mm,后者明显大于前者(t=1.371,P=0.0271)。
3 讨论
STN-DBS手术取得良好疗效的关键是将电极精准植入特定的靶点,术前靶点及针道设计极其重要。术前设计主要依赖于影像学检查,目前常用的T2像及T1增强像仍然存在核团显示不清及血管显示不完全等问题,因此有必要开发新的影像学检查方法。SWI因其能清晰显示顺磁性物质含量丰富的基底节及脑内小血管,近年来逐渐应用于脑卒中及神经变性疾病的病情评估,亦有少量报道用于DBS术前检查[3]。DBS手术严重并发症如梗塞及出血的发生率极低(约1%~3%)。但一旦发生则可能导致患者偏瘫、失语,甚至昏迷及死亡[4]。其发生与手术穿刺过程中对脑血管的干扰有很大关系,因此术前设计针道应该从脑回处进针且全程避开血管及脑室。如果针道设计不细致,术中穿刺就可能损伤血管导致症状性出血和梗塞[5]。动脉损伤会导致蛛网膜下腔或脑实质出血,引起急性神经功能障碍。静脉损伤可引起特征性的脑水肿或电极附近形状不规则的皮质下出血,往往导致亚急性神经功能缺损[6]。针道设计依赖术前MR检查,不仅要求能清晰显示靶点(如STN),而且应尽可能提高脑内血管的可视化水平。T2像因“开花现象”显示的STN往往比实际偏大(主要体现在宽度),背外侧与苍白球传出纤维束分界模糊不清,严重影响术前靶点设计。而且T2像因“流空效应”仅能显示脑膜脑表面及脑内较大血管,用于针道设计会遗漏很多小血管。近年来常用的T1增强对较小动脉血管能清楚显示,已经成为针道设计的常规参考方法。但增强扫描时需注射造影剂,在特定情况下会引起不良反应,如过敏反应、消化道反应、神经毒性、血管毒性、肾毒性等,其中过敏反应最常见,少数患者可导致严重后果。SWI不需注射造影剂,是否显像清楚主要与顺磁性物质如铁含量的多少有关,基底节如STN等铁含量丰富故能较清楚显示。不管是脑表面还是脑内的血管特别是小静脉血管也能在SWI上清楚显像,因其含铁丰富并与周围脑组织能形成强烈的对比的缘故[7]。
本研究发现T1增强像、T2像及SWI三种扫描方法中,显示血管的效果SWI最优、T2最差。T1增强像及T2像能显示的血管在SWI中均能清楚显示,SWI还能额外显示一些细小的脑组织内血管。40%的针道在SWI中有血管而在T1增强像中未显示,可能与造影剂显像的延迟性与滞后性有关。分析发现SWI额外显示的血管多为脑实质内小的静脉性血管或横穿支血管,可能原因为静脉含有较多的脱氧血红蛋白,其钙及含铁血黄素丰富,这相对于周围脑组织是顺磁性的,因此在SWI上能低信号显影[8]。SWI能显示比T1增强像及T2像更多的脑血管,如果不做SWI只按照T2规划针道有很大概率在术中穿刺时碰到血管。本组10例患者术前采用T1增强像、T2像及SWI融合规划针道,术中无一例出现出血及梗塞。但整体病例数偏少,SWI在术前靶点及针道设计中的优势还需要今后大宗病例研究。回顾本中心2014年5月到2017年5月完成的72例DBS手术,术前规划采用T2像设计针道(没有扫描T1增强像及SWI),手术中仅1例出现少量皮质出血(10mL以下),术后一侧肢体轻偏瘫,保守治疗两周完全恢复。本中心实施的DBS手术出血率为 1.4%(1/72),与文献报道基本一致[4,9]。DBS手术穿刺及植入电极时大的动脉血管往往被推离移位而不会被损伤,故引起出血往往是小的血管尤其是静脉血管的损伤。SWI因其在显示脑组织内小血管特别是静脉血管的独特优势,故在DBS术前针道设计中具有极大的应用价值。
本研究还发现T2像显示的STN宽度明显大于SWI,主要体现在外侧界。可能原因是T2像显示的STN外侧界有一部分是苍白球传出纤维束,故比实际边界偏外。而STN背外侧含铁量稀少,故SWI上显示的外侧界往往偏内。DBS中电极植入STN的背外侧运动区才能起到良好疗效,因此术前影像学检查是否能清楚显示STN外侧界用于靶点设计十分重要[8]。STN的实际外侧界往往在T2像及SWI显示的外侧界之间,故二者结合用于靶点设计更加合理。
目前有文献研究表明随着帕金森病进展,铁在基底节区沉积会越来越多,故应用SWI序列扫描帕金森病患者的基底节(如STN等)可反应病情的严重程度[10]。而且SWI扫描可清晰显示STN的边界(特别是外侧界及与黑质的分界),结合其他MR扫描可用于靶点设计[6]。本研究提示SWI与T1增强像及T2像结合不仅能清楚显示脑表面及脑组织内血管还能显示STN的边界,用于术前规划设计具有很大的应用价值。
